羰基蝶啶类衍生物的合成及抗肿瘤活性
2021-12-02郭婷婷朱双圆孟宇晨黄军海
郭婷婷, 胡 锦, 朱双圆, 李 明, 孟宇晨, 黄军海*
(1. 上海工程技术大学 化学化工学院,上海 201620; 2. 中国医药工业研究总院 上海医药工业研究院 创新药物与制药工艺国家重点实验室,上海 201203)
随着烈性传染病的有效控制和人类平均寿命的延长,癌症已经成为严重危害人类健康的重大疾病之一[1]。靶向治疗是现代肿瘤治疗的重要手段,VEGFR(Vascular Endothelial Growth Factor Receptor)是该类靶向治疗药物的代表性靶点。已上市的VEGFR抑制剂结构母核大致可以分为5类: (1)以Sorafenib为代表的二芳基脲类[2]; (2)以Sunitunib为代表的吲哚酮类[3]; (3)以Vandetanib为代表的喹唑啉类; (4)以Lenvatinib为代表的喹啉类[5]; (5)其他类,如Axitinib[6]。
对这些VEGFR抑制剂关键结构进行分析,发现其结构主要为平面刚性(如Lenvatinib)或相对柔性(如Sorafenib)结构,而半刚性平面扭曲结构母核较为欠缺。进一步分析发现,喹唑啉母核N原子与VEGFR受体有氢键作用,吲哚酮羰基结构与亚胺结构均可与VEGFR受体形成氢键[7]。有文献报道“蝶啶-7(8H)-酮”母核对多肿瘤细胞系有一定的抑制作用[8],本研究对该半刚性结构母核2-位、6-位和8-位进行结构改造,合成8个未见文献报道的羰基蝶啶类抗肿瘤衍生物(TM1~TM8),其结构经过1H NMR,13C NMR和LC-MS(ESI)表征。初步对多种肿瘤细胞进行抗增殖活性研究,发现化合物TM1显示出较好的抗肿瘤活性,本研究为该类半刚性结构母核抗肿瘤药物的研究提供参考和实验依据。
化合物TM1~TM8的合成路线:以2,4-二氯-5-硝基嘧啶(1)为起始原料,利用两个氯原子活泼性差异先后两步取代反应得到化合物3a~3b;再经过还原、关环得到化合物5a~5b;将5a~5b中甲硫醚氧化为亚砜得到中间体化合物6a~6b;吗啉环是药物中常用的结构,可以提高药物的水溶性,增加口服的可能性[9],以吗啉环取代亚砜得化合物7a~7b;再经溴化得化合物TM1和TM2;以化合物TM1~TM2为原料,在碱性催化下得化合物TM3~TM4;通过Suzuki耦联反应得化合即TM5~TM6;与氨基化合物取代得化合物TM7~TM8(Scheme 1)。
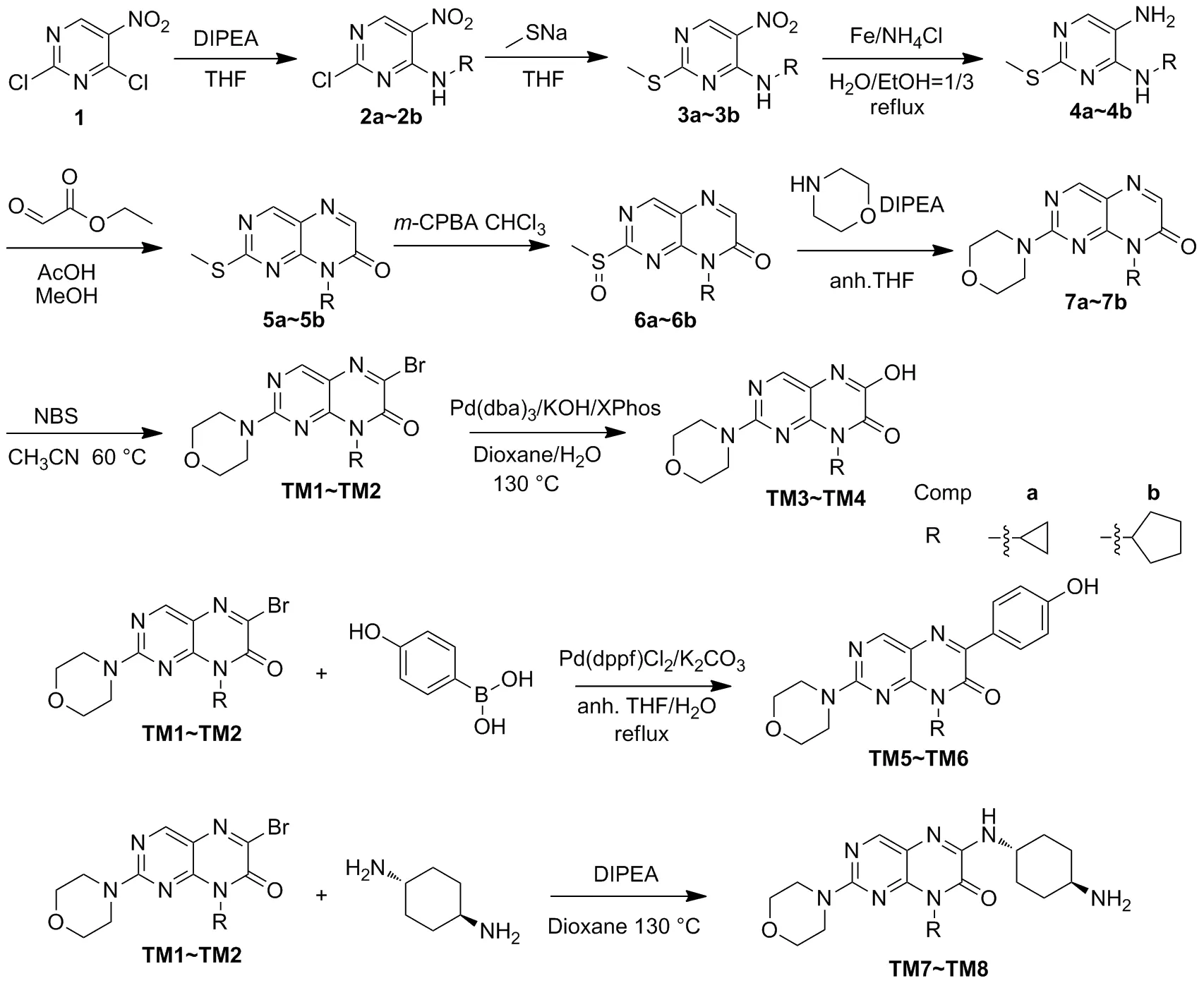
Scheme 1
1 实验部分
1.1 仪器与试剂
WRS-18型数字熔点仪;Bruker 400 MHz型核磁共振仪(TMS为内标);Waters 2767/515/2489型液相-质谱联用仪;Varioskan Flash 型全波长多功能酶标仪。
所用试剂均为分析纯。
1.2 合成
(1)2a~2b的合成(以2a为例[10])
在-25 ℃冷阱中,将2,4-二氯-5-硝基嘧啶(1)5.00 g(25.9 mmol)溶于THF(50 mL) 中,加入DIPEA 10 mL(51.8 mmol)搅拌均匀后,加入环丙胺1.50 g(26.7 mmol),搅拌1 h(TLC检测)。过滤反应液中的白色固体,滤饼用乙酸乙酯洗涤(3×15 mL ),滤液减压浓缩,加入乙酸乙酯(3×200 mL) 和水(150 mL) 萃取,有机层以饱和NaCl水溶液(150 mL) 洗涤,无水硫酸钠干燥,减压浓缩后,残余物经硅胶柱层析[洗脱剂:V(乙酸乙酯)/V(石油醚)=1/20]纯化得黄色固体2a3.70 g,收率65%;1H NMR(400 MHz, CDCl3)δ: 9.04(s, 1H), 8.34(s, 1H), 3.21~3.09(m, 1H), 1.08~1.00(m, 2H), 0.78~0.70(m, 2H); LC-MS(ESI)m/z: 215.1{[M+H]+}。
2b:黄色固体,收率72%;1H NMR(400 MHz, CDCl3)δ: 9.02(s, 1H), 8.38(s, 1H), 4.67~4.53(m, 1H), 2.24~2.10(m, 2H), 1.87~1.75(m, 2H), 1.75~1.65(m, 2H), 1.62~1.48(m, 2H); LC-MS(ESI)m/z: 243.1{[M+H]+}。
(2)3a~3b的合成(以3a为例[11])
称取2a2.00 g(9.4 mmol)溶于THF(20 mL)中,加入甲硫醇钠4.90 g(6.3 mmol, 20%水溶液),搅拌(TLC监测)。反应完毕后,加60 mL水淬灭反应,固体析出,过滤,滤饼经硅胶柱层析[洗脱剂:V(PE)/V(乙酸乙酯)=20/1]纯化得黄色固体3a1.50 g,收率71%;1H NMR(400 MHz, CDCl3)δ: 8.98(s, 1H), 8.35(s, 1H), 3.16~3.00(m, 1H), 2.60(s, 3H), 1.00~0.90(m, 2H), 0.74~0.66(m, 2H); LC-MS(ESI)m/z: 227.1{[M+H]+}。直接参与下步反应。
(3)4a~4b的合成(以4a为例[12])
称取铁粉6.10 g(109.7 mmol) 与NH4Cl 2.90 g(54.8 mmol)溶解于EtOH(90 mL) 与(30 mL) 的混合溶液中,加热至回流,搅拌1 h后,缓慢加入化合物3a6.20 g(27.4 mmol),继续搅拌0.5 h(TLC检测)。用硅藻土趁热过滤,甲醇洗涤(3×30 mL),滤液减压浓缩后,用半饱和碳酸钠水溶液(200 mL)与乙酸乙酯(3×300 mL)萃取,饱和NaCl溶液(150 mL) 洗涤,无水硫酸钠干燥,减压旋干得紫红色固体4a5.40 g,直接参与下一步反应。
(4)5a~5b的合成(以5a为例)[13]

Chart 1
称取4a5.40 g(27.5 mmol)溶解于乙醇(60 mL)中,加入乙醛酸乙酯 6.70 g(33.0 mmol, 50%甲苯溶液)、醋酸2.50 g(41.2 mmol),升温至回流,搅拌12 h(HPLC监测)。反应完毕后,自然冷却,有固体析出,过滤,滤饼以乙醇(3×5 mL)洗涤得5a4.30 g,收率 67%;1H NMR(400 MHz, CDCl3)δ: 8.84(s, 1H), 8.10(s, 1H), 3.07~2.93(m, 1H), 2.66(s, 3H), 1.40~1.25(m, 2H), 1.09~0.93(m, 2H); LC-MS(ESI)m/z: 235.1{[M+H]+}。
化合物5b合成类似于5a,但因取代基团位阻增大需要在150 ℃进行反应。
5b: 黄色固体,收率45%;1H NMR(400 MHz, CDCl3)δ: 8.87(s, 1H), 8.10(s, 1H), 5.86~5.70(m, 1H), 2.63(s, 3H), 2.39~2.25(m, 2H), 2.16~2.02(m, 2H), 1.98~1.86(m, 2H), 1.78~1.66(m, 2H); LC-MS(ESI)m/z: 263.1{[M+H]+}。
(5)6a~6b的合成(以6a为例)[14]
称取5a5.00 g(21.4 mmol)溶解于氯仿(50 mL)中,在-5 ℃冰盐浴条件下,缓慢加入m-CPBA 4.80 g(23.5 mmol, 85%纯度),搅拌一段时间后有固体析出(TLC 监测)。反应完毕后,加入5%亚硫酸钠水溶液(50 mL)搅拌0.5 h,加入二氯甲烷(2×100 mL)萃取,二氯甲烷相加入半饱和碳酸钠水溶液(100 mL)萃取,饱和NaCl水溶液(100 mL)洗涤,无水硫酸钠干燥,减压旋干,得到橙黄色固体6a4.50 g,收率83%;直接参与下一步反应。
(6)7a~7b的合成(以7a为例)[15]
称取6a4.00 g(16.0 mmol)于无水THF(40 mL)中,加入DIPEA(4.5 mL, 32.0 mmol)、吗啉2.10 g(24.0 mmol),搅拌过夜(TLC监测)。反应完毕后,加水(400 mL),过滤,得黄色固体7a3.80 g,收率 88%, m.p.192~195 ℃;1H NMR(400 MHz, CDCl3)δ: 8.67(s, 1H), 7.85(s, 1H), 3.95(t,J=4.8 Hz, 4H), 3.79(t,J=4.8 Hz, 4H), 2.97~2.84(m, 1H), 1.34~1.18(m, 2H), 1.06~0.98(m, 2H);13C NMR(101 MHz, CDCl3)δ: 160.02, 159.42, 158.23, 151.77, 145.83, 120.25, 66.84, 44.72, 24.62, 8.69; LC-MS(ESI)m/z: 274.1{[M+H]+}。
7b: 淡粉色固体,收率90%, m.p.145~148 ℃;1H NMR(400 MHz, CDCl3)δ: 8.68(s, 1H), 7.84(s, 1H), 5.76~5.60(m, 1H), 3.91(t,J=4.8 Hz, 4H), 3.79(t,J=4.8 Hz, 4H), 2.41~2.25(m, 2H), 2.10~1.95(m, 2H), 1.94~1.80(m, 2H), 1.73~1.62(m, 2H);13C NMR(101 MHz, CDCl3)δ: 159.95, 159.68, 157.34, 150.71, 146.28, 120.48, 66.82, 53.30, 44.81, 27.88, 25.7; LC-MS(ESI)m/z: 302.2{[M+H]+}。
(7)TM1~TM2的合成(以TM1为例[16])
称取7a1.00 g(3.7 mmol)于乙腈(20 mL) 中,加入NBS 0.70 g(4.3 mmol),油浴温度60 ℃,氮气保护下搅拌(TLC监测)。反应完毕后,减压浓缩,残余物经硅胶柱层析分离[洗脱剂:V(乙酸乙酯)/V(二氯甲烷)=1/20]纯化得淡黄色化合物TM11.00 g,收率78%, m.p.185~188 ℃;1H NMR(400 MHz, CDCl3)δ: 8.63(s, 1H), 3.94(t,J=4.8 Hz, 4H), 3.79(t,J=4.8 Hz, 4H), 3.04~2.88(m, 1H), 1.37~1.18(m, 2H), 1.08~0.90(m, 2H);13C NMR(101 MHz, CDCl3)δ: 159.83, 158.67, 154.52, 151.75, 138.07, 119.60, 66.82, 44.79, 26.30, 9.05; LC-MS(ESI)m/z: 352.1{[M+H]+}。
TM2: 黄色固体,收率90%, m.p.215~218 ℃;1H NMR(400 MHz, CDCl3)δ: 8.66(s, 1H), 5.83~5.68(m, 1H), 3.97~3.87(br, 4H), 3.79(t,J=4.8 Hz, 4H), 2.33~2.20(m 2H), 2.13~2.00(m, 2H), 1.95~1.82(m, 2H), 1.73~1.62(m, 2H);13C NMR(101 MHz, CDCl3)δ: 159.75, 158.89, 153.25, 150.68, 138.90, 119.94, 66.78, 54.76, 44.85, 28.03, 25.99; LC-MS(ESI)m/z: 380.2{[M+H]+}。
(8)TM3~TM4的合成(以TM3为例)
称取TM1500.0 mg(1.4 mmol)、 Pd(dba)330.0 mg(0.03 mmol)、 KOH 160.0 mg(2.8 mmol)和XPhos 20.0 mg(0.04 mmol)加入到5 mL微波管中,再加入二氧六环(2 mL)与水(2 mL),130 ℃微波反应0.5 h(TLC监测)。反应完毕,用5%稀盐酸将反应液调至pH至4,加入二氯甲烷(3×20 mL)与水(20 mL)萃取,无水硫酸钠干燥,减压浓缩后,残余物经硅胶柱层析分离[洗脱剂:V(甲醇)/V(二氯甲烷)=1/30]纯化后,再加入少量二氯甲烷(3 mL),石油醚(20 mL),减压浓缩除去二氯甲烷,过滤,得黄色固体TM3100.0 mg,收率25%, m.p.310~313 ℃;1H NMR(400 MHz, DMSO-d6)δ: 11.73(s, 1H), 8.06(s, 1H), 3.67(s, 8H), 2.84~2.74(m, 1H), 1.17~1.07(m, 2H), 0.82-0.74(m, 2H);13C NMR(101 MHz, DMSO-d6)δ: 157.71, 157.08, 152.56, 147.34, 143.12, 112.04, 65.90, 44.36, 24.97, 8.53; LC-MS(ESI)m/z: 290.1{[M+H]+}。
TM4: 淡黄色固体,收率24%, m.p.300~304 ℃;1H NMR(400 MHz, DMSO-d6)δ: 11.80(s, 1H), 8.10(s, 1H), 5.66~5.50(m, 1H), 3.71~3.65(m, 4H), 3.65~3.58(m, 4H), 2.23~2.07(m, 2H), 1.99~1.86(m, 2H), 1.85~1.73(m,2H), 1.67~1.54(m,2H);13C NMR(101 MHz, DMSO-d6)δ: 156.98, 156.73, 152.34, 146.04, 143.80, 112.13, 65.86, 53.07, 44.37, 27.46, 25.24; LC-MS(ESI)m/z: 318.2{[M+H]+}。
(8)TM5~TM6的合成(以TM5为例[17])
称取TM1500.0 mg(1.4 mmol)、 4-羟基苯硼酸386.2 mg(2.8 mmol)、 Pd(dppf)Cl230.0 mg(0.04 mmol)和K2CO3393.0 mg(2.8 mmol)加入到无水THF(10 mL)中搅拌均匀,氮气保护下升温至剧烈回流,搅拌0.5 h后滴加水(2 mL)到反应液中,继续搅拌3 h(TLC监测)。反应结束,减压浓缩,用二氯甲烷(3×30 mL)和水(20 mL)萃取,饱和NaCl水溶液(20 mL)洗涤,无水硫酸钠干燥,减压浓缩后经硅胶柱层析分离[洗脱剂:V(乙酸乙酯)/V(二氯甲烷)=1/20]纯化后,加入少量二氯甲烷(3 mL),大量石油醚(20 mL),减压浓缩除去二氯甲烷,过滤,得黄色固体TM5240.0 mg,收率45%, m.p.213~214 ℃;1H NMR(400 MHz, CD3OD)δ: 8.67(s, 1H), 8.08(ddd,J=2.0 Hz, 2.8 Hz, 9.6 Hz, 2H), 8.83(ddd,J=2.0 Hz, 2.8 Hz, 9.6 Hz, 2H), 3.95(t,J=4.8 Hz, 4H), 3.78(t,J=4.8 Hz, 4H), 2.98~2.90(m, 1H), 1.30~1.26(m, 2H), 1.00~0.93(m, 2H);13C NMR(101 MHz, CDCl3: DMSO-d6=10 : 1)δ: 159.09, 158.73, 158.01, 157.63, 151.28, 150.00, 130.93, 126.78, 119.72, 114.93, 66.61, 44.59, 24.95, 8.80; LC-MS(ESI)m/z: 366.1{[M+H]+}。
TM6: 黄绿色固体,收率82%, m.p.245~249 ℃;1H NMR(400 MHz, CDCl3/ CD3OD=10/1)δ: 8.66(s, 1H), 8.05~7.95(m, 2H), 6.86~6.74(m, 2H), 5.82~5.64(m, 1H), 3.85(t,J=4.0 Hz, 4H), 3.75(t,J=4.0 Hz, 4H), 2.38~2.21(m, 2H), 2.08~1.92(m, 2H), 1.90~1.76(m, 2H), 1.72~1.56(m, 2H);13C NMR(101 MHz, CDCl3/CD3OD=10/1)δ: 159.25, 158.87, 158.72, 156.81, 150.52, 150.16, 131.03, 127.25, 120.10, 115.03, 66.73, 53.64, 44.68, 27.76, 25.77; LC-MS(ESI)m/z: 394.2{[M+H]+}。
(9)TM7~TM8的合成(以TM7为例[18])
称取M1500.0 mg(1.4 mmol)、反式-1,4-环己二胺265.0 mg(5.6 mmol)和DIPEA(980.0 μL, 5.6 mmol)加入5 mL微波管中,再加入二氧六环(5 mL),150 ℃微波反应4 h(TLC监测)。反应完毕,用5%稀盐酸将反应液调至pH至4,加入二氯甲烷(3×20 mL)与水(20 mL)萃取,饱和NaCl水溶液(50 mL)洗涤,无水硫酸钠干燥,减压浓缩后经硅胶柱层析分离[洗脱剂:V(甲醇)/V(二氯甲烷)=1/30]纯化后,加入少量二氯甲烷(3 mL),石油醚(20 mL),减压浓缩除去二氯甲烷,过滤,得黄色固体TM7200.0 mg,收率39%, m.p.135~137 ℃;1H NMR(400 MHz, CD3OD)δ: 8.31(s, 1H), 3.87~3.79(m, 1H), 3.76(s, 8H), 2.99~2.87(m, 1H), 2.75~2.62(m, 1H), 2.15~2.02(m, 2H), 1.99~1.89(m, 2H), 1.48~1.26(m, 4H), 1.24~1.16(m, 2H), 0.97~0.89(m, 2H);13C NMR(101 MHz, CD3OD)δ: 158.77, 156.33, 153.97, 149.82, 184.41, 121.23, 67.78, 50.86, 50.27, 46.03, 35.38, 32.12, 26.04, 9.36; LC-MS(ESI)m/z: 386.2{[M+H]+}。
TM8: 黄色固体,收率58%, m.p.90~94 ℃;1H NMR(400 MHz, CD3OD)δ: 8.39(s, 1H), 5.90~5.75(m, 1H), 3.89~3.80(m, 1H), 3.80~3.69(m, 8H), 2.75~2.64(m, 1H), 2.41~2.25(m, 2H), 2.14~1.98(m, 4H), 1.98~1.82(m, 4H), 1.76~1.63(m, 2H), 1.47~1.24(m, 4H);13C NMR(101 MHz, CDCl3)δ: 157.66, 154.48, 153.89, 147.26, 146.97, 120.40, 66.91, 53.68, 50.22, 48.80, 44.98, 34.19, 31.39, 28.13, 25.86; LC-MS(ESI)m/z: 414.2{[M+H]+}。
1.3 体外抗肿瘤活性测试
将待测化合物用DMSO溶解,用对应细胞所需培养基进行梯度稀释。稀释倍数的选择先进行粗筛,得到IC50值的粗略范围;按2~3倍梯度稀释成6个浓度,使得粗筛结果落在6个浓度中间。取对数生长期的细胞配成3×104~4×104个mL浓度,每孔100 μL铺于96孔板中,设置空白组、对照组以及给药组,周围铺上100 μL PBS溶液防止边缘效应,置于37 ℃、 5%CO2培养箱中培养。24 h后,弃去96孔板中培养基,换为用含有已设计药物浓度的完全培养基,继续置于37 ℃ 5% CO2培养箱中培养72 h,避光加入CCK8试剂,避光培养1 h(OD值在1.0附近)。
2 结果与讨论
2.1 活性
(1)选择人肝癌细胞(HepG2)、乳腺癌细胞(MCF7)、人肺腺癌细胞(NCI-H1975)和人非小细胞肺癌细胞(HCC827)为测试细胞株,以Sorafenib、 Axitinib与Lenvatinib为阳性对照,采用CCK8法[19-20]对目标化合物TM1~TM8进行抗肿瘤细胞活性测试,结果以IC50值的形式体现在表1。

由表可知,化合物TM1和TM8对四种肿瘤均表现出良好的抑制活性;与阳性对照相比,TM1、TM4、TM5、TM6和TM8对HepG2细胞的抑制效果均强于Lenvatinib;TM1、TM2、TM4、TM6和TM8对MCF7细胞的抑制作用均强于Axitinib和Lenvatinib;TM1对MCF7、 H1975和HCC827细胞抑制效果强于阳性对照药物Axitinib。
2.2 构效关系
从细胞生物活性结果可知,在化合物8-位,体外抗肿瘤活性三元环大于五元环,后续可进一步尝试位阻较小的基团,如甲基、异丙基等;6-位进行了3种类型的取代:溴原子、芳香环基团和以氮原子为桥梁连接的基团,其中溴原子取代的化合物活性最好,芳香环基团取代化合物活性稍强于以氮原子为桥梁连接的基团,后续可以选择位阻小于芳香环的基团进行结构改造。
本研究以羰基蝶啶为半刚性结构母核,设计合成了8种抗肿瘤化合物(TM1~TM8),体外活性测试结果显示:TM1对人肝癌细胞(HepG2)、乳腺癌细胞(MCF7)、人肺腺癌细胞(NCI-H1975)和人非小细胞肺癌细胞(HCC827)均有良好的抑制作用,IC50值分别为20.96、 12.63、 3.63和6.41 μmol·L-1。在此基础上提出了该类母核不同取代位点的初步构效关系,为后续结构优化提供方向与建议。
