miR-29a-3p对宫颈癌细胞增殖和侵袭特性的影响
2021-12-02陆文睿丁华峰倪观太张莹王庆玮郭楠
陆文睿,丁华峰,倪观太,张莹,王庆玮,郭楠
(皖南医学院弋矶山医院妇科,安徽 芜湖241001)
宫颈癌发病率在女性生殖器官恶性肿瘤中占首位。近年,包括中国在内的广大发展中国家,宫颈癌的发病率和死亡率一直呈逐年增高趋势。2015年我国宫颈癌发病率为16.56/10万[1],现已证实高危型人乳头瘤病毒持续性感染是导致宫颈癌发生发展的必要条件[2]。
microRNAs是一组具有19~25个核苷酸的非编码RNA,与人类癌症的发生和发展密切相关[3],主要通过与其靶基因的mRNA的3′-非翻译区(UTR)结合来调控基因表达[4]。microRNAs及其相互调控的下游靶基因启动了下游信号通路,在宫颈癌细胞增殖、凋亡、分化、迁移和侵袭等基本生物学过程中发挥着重要作用[5-6]。近期研究发现miR-29a-3p的过表达抑制了HeLa细胞的迁移和增殖,并且SNIP1下游基因(HSP27、c-Myc和cyclin D1)的mRNA表达被miR-29a-3p下调[7]。本研究为进一步探讨miR-29a-3p在宫颈癌发生发展中的作用机制,选择miR-29a-3p作为研究对象,探讨其在宫颈癌细胞增殖、侵袭中的作用。
1 材料与方法
1.1 标本收集 将2019年1月至2020年1月于皖南医学院弋矶山医院妇科经病理组织学确诊为宫颈癌患者的宫颈组织10例作为病例组,对照组选择因子宫良性疾病进行全子宫切除术患者的正
常宫颈组织10例,所有患者术前均知情同意并签署知情同意书,本研究经医院伦理委员会批准。
1.2 细胞与试剂 人宫颈癌HeLa、SiHa细胞株均购自于中国科学院细胞库。RPMI 1640培养基、胎牛血清(赛默飞世尔(中国)科技公司)。cDNA、实时荧光定量聚合酶链反应(qRT-PCR)试剂盒(天根生化科技(北京)有限公司),转染试剂、引物(广州锐博生物科技有限公司)。CCK-8试剂盒(贝博生物科技有限公司),Transwell小室(康宁生物科技有限公司)。
1.3 qRT-PCR检测宫颈癌组织中的表达 收集的宫颈癌组织及宫颈正常组织,进行匀浆处理,多次反复离心后加入氯仿、异丙醇溶液、75%乙醇,最终洗涤沉淀,加入RNase-Free ddH2O。使用Trizol试剂提取总RNA。根据FastQuant cDNA第一链合成试剂盒进行逆转录。利用qRT-PCR仪检测miR-29a-3p的表达量,引物序列见表1。采用2-△△Ct法计算miR-29a-3p的相对表达量。
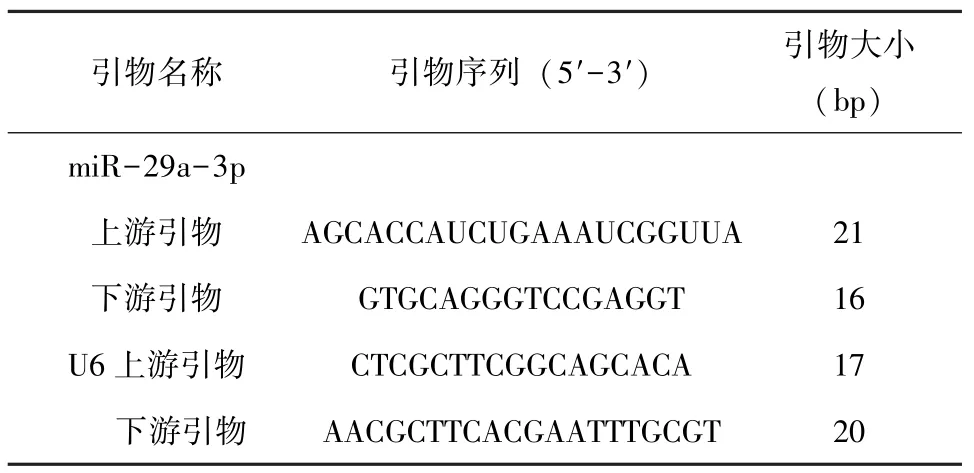
表1 引物序列
1.4 细胞培养与miR-29a-3p mimics转染 将HeLa细胞置于含10%胎牛血清的RPMI 1640培养基中,SiHa细胞接种在DMEM培养基中,置于37℃含5%CO2的培养箱中培养。取对数生长期、状态良好的细胞,接种于6孔板、每孔(2~3)×105细胞,当细胞生长至30%~50%时,按照转染说明书分别用miR-29a-3p mimic及miR-29a-3p NC分别转染HeLa细胞和SiHa细胞。采用qRT-PCR法验证转染效率。
1.5 CCK8检测细胞的增殖情况 实验转染后的细胞以每孔3×103细胞数接种于96孔板中,每组设置3个复孔。于24、48、72 h后加入10μl CCK8试剂共同培养2 h后,使用酶标仪在波长450 nm处检测光密度值(OD值)。每组实验重复3次,对比细胞的增殖能力变化。
1.6 Transwell实验检测细胞的侵袭情况 以1∶6的比例用无血清培养基稀释Matrigel,覆盖Transwell小室的上室,将其放入37℃的孵箱中孵育2 h,使Matrigel聚合成凝胶。收集miR-29a-3p mimics及NC mimics转染24 h后的细胞,在Transwell小室上室以每孔5×105/ml细胞和200μl无血清培养基培养,下室加入500μl培养基,在培养箱中培养24 h,后用棉签轻轻擦拭内室中的细胞和基质,甲醇固定30 min,用0.1%结晶紫染色溶液染色30 min,用PBS冲洗3次,取出上部小室的细胞,在高倍镜下观察细胞,拍照计数。
1.7 统计学方法 采用GraphPad、SPSS 20.0软件进行统计学分析。计量资料采用均数±标准差表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-29a-3p在宫颈癌组织中表达降低 qRT-PCR结果表明miR-29a-3p在宫颈癌组织中的表达量低于正常宫颈组织(P<0.05),见图1。
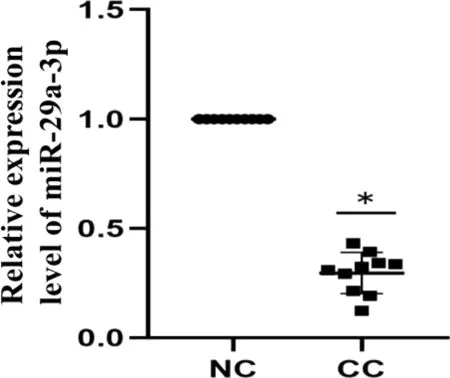
图1 miR-29a-3p在正常宫颈组织(NC)及宫颈癌(CC)组织中的表达
2.2 过表达miR-29a-3p对宫颈癌细胞增殖的影响 细胞转染24 h后,qRT-PCR验证转染效率,miR-29a-3p mimics组较对照组miR-29a-3p NC表达量明显增高(P<0.05),见图2;通过CCK-8实验表明miR-29a-3p mimics组较对照组中宫颈癌细胞的增殖能力明显下降(P<0.05),见图3。
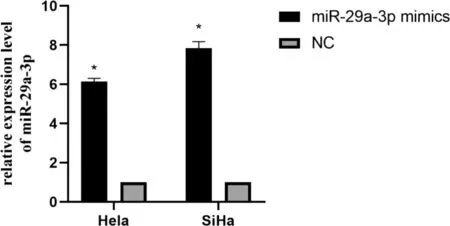
图2 miR-29a-3p在宫颈癌细胞株中转染效率的验证
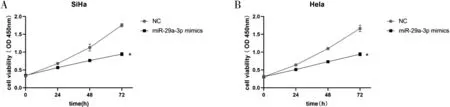
图3 CCK-8实验验证miR-29a-3p对宫颈癌SiHa细胞(A)和Hela细胞(B)增殖能力的影响
2.3 过表达miR-29a-3p对宫颈癌细胞迁移的影响 miR-29a-3p mimics组相较于对照组细胞的数目减少明显,见图4A;结果比较差异有统计学意义(P<0.05),见图4B。
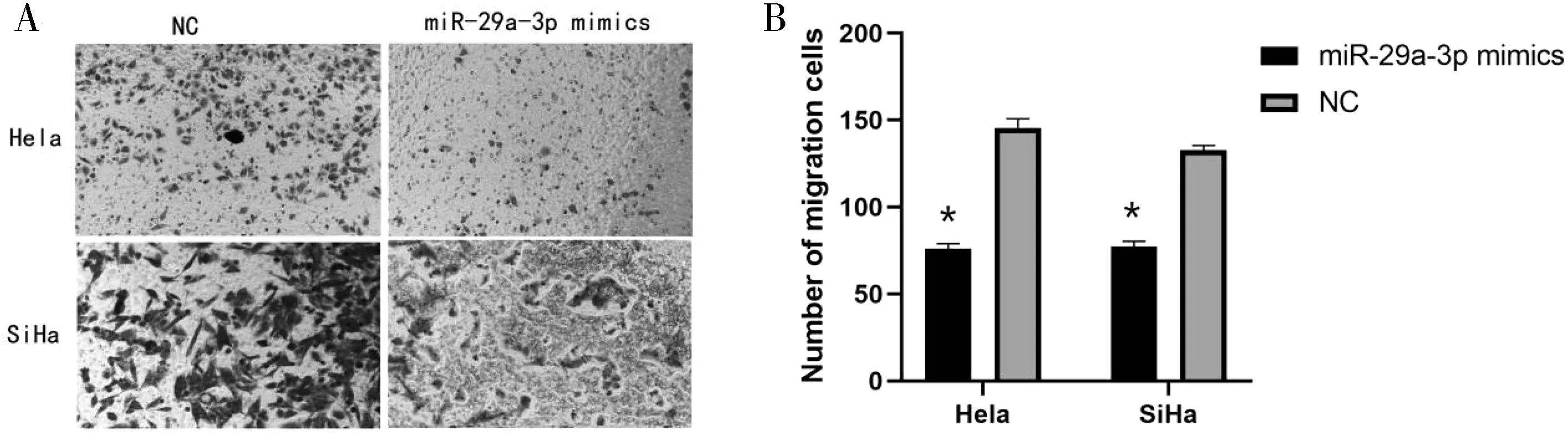
图4 Transwell实验验证miR-29a-3p对宫颈癌细胞侵袭能力的影响
3 讨论
筛选出宫颈癌中有生物学意义的microRNAs来进一步探究宫颈癌发生发展分子机理,得到了许多学者的关注。microRNAs通过靶向调节原癌基因、抑癌基因、转移基因、上皮间质转化、微环境、肿瘤干细胞特性、外泌体等多个方面来调节肿瘤的侵袭和迁移[8]。
宫颈癌的发病过程受到多种因素的调控,在发生、发展过程中会受到一些复杂的异常调控[9]。从发病机制的角度出发,寻找有意义的分子生物学靶标研究宫颈癌的发生发展过程,成为了目前的主要研究方向。microRNAs的调节功能参与所有致癌过程和对病毒感染的应答,人乳头瘤病毒可以诱导许多细胞microRNAs的异常表达,但这种失调可以作为人乳头瘤病毒感染、宫颈鳞状上皮内病变和癌症的早期诊断的标志物[9]。已有研究报道了microRNAs在调控宫颈癌细胞的增殖方面发挥着重要作用,Ni等[10]的研究表明miRNA-802在宫颈癌细胞和宫颈癌组织中表达明显下调,可以通过靶向MYLIP调控宫颈癌细胞的增殖和迁移;Yang等[11]发现在宫颈癌组织中miR-155的表达降低,同时miR-155作为被LncRNA UCA1调控的下游基因,参与了宫颈癌细胞上皮间质转化过程,影响了宫颈癌细胞的增殖、迁移和侵袭。
本研究qRT-PCR结果显示miR-29a-3p在宫颈癌组织中低表达,过表达miR-29a-3p后可以有效抑制宫颈癌细胞的增殖和侵袭。已有研究报道,miR-29a-3p影响了胃癌细胞的增殖、侵袭和迁移,参与了胃癌的发生和发展[12];Chen等[7]发现miR-29a-3p的过表达抑制了宫颈癌HeLa细胞的迁移和增殖,本研究结论与其一致。
综上所述,本研究结果表明miR-29a-3p在宫颈癌的发病过程中发挥着抑癌基因的作用,过表达miR-29a-3p抑制了人宫颈癌细胞的增殖和侵袭。因此,miR-29a-3p可能成为宫颈癌治疗的新靶点。
