骨保护素及骨形态发生蛋白2对冠状动脉钙化的影响
2021-12-02金忠志刚赵红丽姜贞宇王小溪马妍
金忠志刚,赵红丽*,姜贞宇,王小溪,马妍
(1.沈阳医学院附属第二医院心内科,辽宁 沈阳110002;2.科教科)
冠状动脉斑块内点状钙化可引发斑块内出血,导致急性冠状动脉综合征发生;中重度钙化、钙化结节可导致血管壁硬化变脆,顺应性降低,介入术中易出现球囊通过困难、扩张不良、球囊破裂,冠状动脉内膜夹层、冠状动脉穿孔、支架膨胀不良及贴壁不良,晚期支架再狭窄及支架内血栓,手术难度增加、手术费用高,预后不良。冠状动脉钙化 (coronary artery calcification,CAC)是在冠状动脉粥样硬化基础上由多种酶、蛋白质及细胞因子等调控的有序的、主动的调节过程,动脉钙化的关键一步是血管平滑肌细胞由收缩表型向成骨细胞样转变,这一过程中有许多成骨细胞和破骨细胞标志性分子参与,例如骨桥蛋白、骨形态发生蛋白 (bone morphogenetic protein,BMP)、骨保护素(osteoprotegerin,OPG)和细胞核因子κB受体活化因子配体(RANKL)等;体内外诸多因素对上述分子起着促进或是抑制性调控作用,进而影响动脉钙化的进程,但CAC的发生、发展机制尚不完全明确。OPG是一种无跨膜结构的可溶性糖蛋白,在心、肾、肝、脑、肺、胃肠道、皮肤、甲状腺、胸腺等广泛表达,在糖代谢、脂代谢、骨代谢中均有参与[1]。BMP是一种多功能糖蛋白,主要在骨皮质、神经系统中表达,其中BMP-2不仅是成骨活性最强的细胞因子,也是能够诱导异位成骨的细胞因子[2]。本研究拟探寻OPG及BMP-2对CAC的影响,探讨OPG及BMP-2在CAC的作用。
1 资料与方法
1.1 一般资料 选取2018年7月至2020年10月在沈阳医学院附属第二医院住院的冠心病患者115例,其中男64例,女51例,平均年龄(63.0±8.24)岁;不稳定型心绞痛98例,急性非ST段抬高型心肌梗死17例。均行冠状动脉造影检查及前降支血管内超声(IVUS)检查,根据测定结果将患者分为无钙化组30例,Ⅰ级钙化组(<90°)24例,Ⅱ级钙化组(90~180°)23例,Ⅲ级钙化组(181~270°)20例,Ⅳ级钙化组(>270°)18例。排除标准: (1)肾上腺、甲状腺及甲状旁腺疾病、骨软化症等影响骨代谢疾病患者; (2)风湿性关节炎等免疫性疾病患者; (3)影响钙及维生素D吸收及调节的消化道(胃切除、肠切除、慢性腹泻、肝衰竭)和肾脏(肾功能不全)疾病患者;(4)合并肿瘤、血液病患者;(5)长期服用糖皮质激素和其他影响骨代谢药物患者; (6)严重肝肾功能不全者; (7)不同意参与试验者。本研究经医院伦理委员会批准,患者均知情同意并签署知情同意书。
1.2 血管钙化情况检测 应用血管内超声机(型号:H749i-Lab220CART0,美国Boston Scientific公司),采取桡动脉或股动脉入路途径植入动脉鞘,将指引导管置于冠状动脉口,推送冠状动脉工作导丝至前降支血管远端,经指引导管向冠状动脉内推注硝酸甘油200μg,经冠状动脉导丝推送Opti Cross TMCoronary Imaging超声导管(3.0 F×135 cm,40 MHz)于病变处远端,0.5 mm/s匀速回撤超声探头行血管内超声检查。由2名具有3年以上血管超声使用经验的介入医生利用QIvus iMap Basic Viewer 3.0软件解读测量影像,以钙化最重处为准,测定钙化弧度。血管钙化在IVUS影像上表现为强回声,钙化部位下方伴有强回声影;微小钙化表现为高回声;无钙化血管表现为低回声或无回声。根据钙化弧度,血管钙化分为4级:Ⅰ级钙化(<90°)、Ⅱ级钙化(90~180°)、Ⅲ级钙化(181~270°)、Ⅳ级钙化(>270°)[3]。
1.3 血清OPG及BMP-2水平测定 取患者清晨空腹静脉血5 ml置于含有2%EDTA-Na2100μl试管中,4℃3 000 r/min离心10 min,分离上层血清于-70℃冰箱保存待检。采用ELISA法,按照OPG、BMP-2 ELISA检测试剂盒(江苏酶标生物科技有限公司)说明书进行测定,应用ST-30型酶标仪(上海科华实验系统有限公司)450 nm波长下测定吸光度(OD)并测定相应方程曲线,计算出OPG、BMP-2水平值。
1.4 统计学方法 采用SPSS 23.0软件进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验和方差分析。计数资料采用[n(%)]表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 CAC组与非CAC组基线指标比较 2组年龄、性别、高血压、糖尿病、左室舒张末期内径、左室射血分数、白细胞计数、血红蛋白、血小板计数、甘油三酯、总胆固醇、低密度脂蛋白、血尿酸、肌酐、谷氨酰胺转肽酶等比较差异无统计学意义(P>0.05)。见表1。
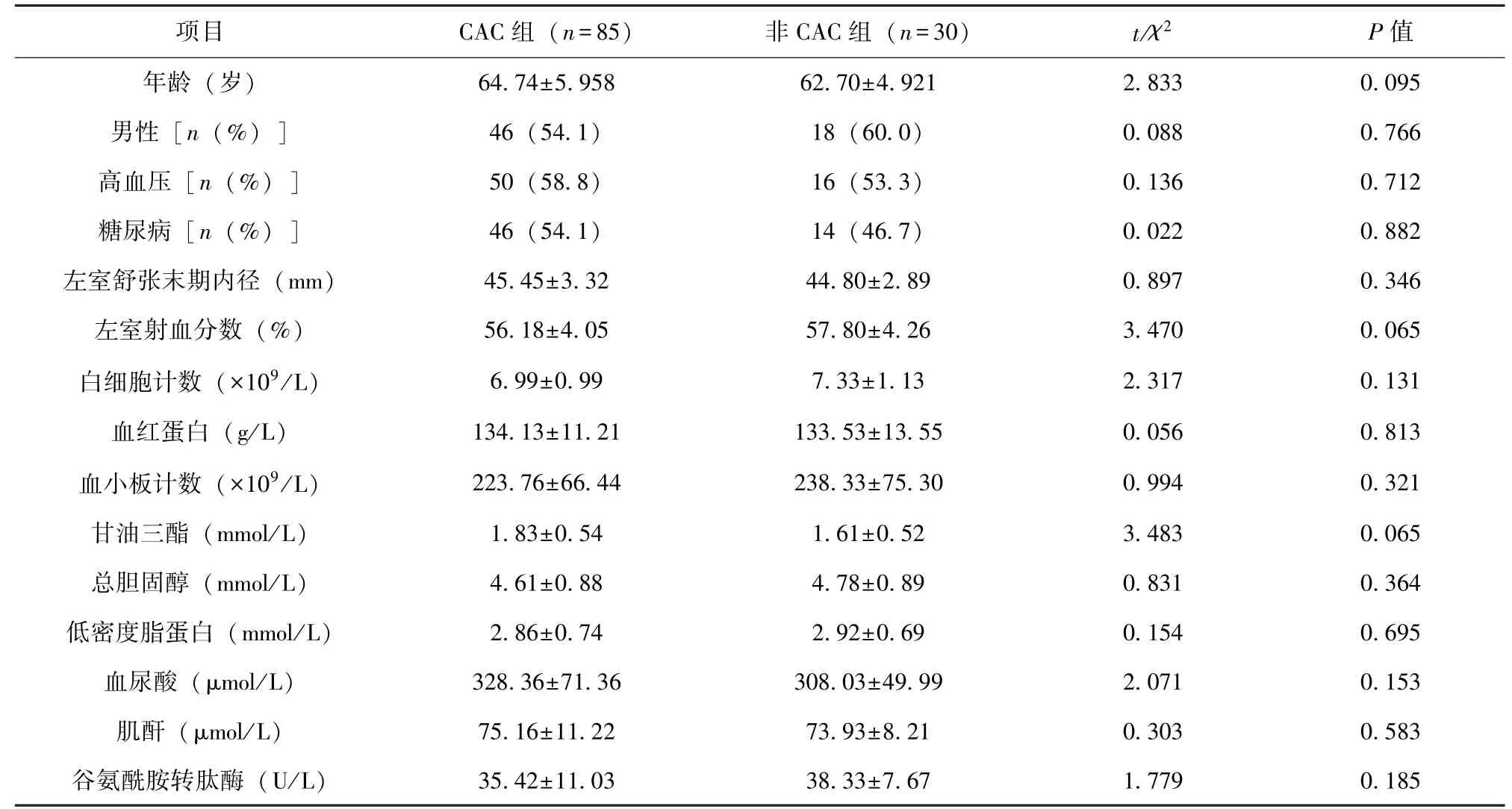
表1 CAC组与非CAC组一般资料比较
2.2 CAC组与非CAC组血清OPG和BMP-2水平比较 CAC组与非CAC组血清OPG水平分别为(2 312.08±615.86)pg/ml和(1 009.18±42.50)pg/ml,BMP-2水平分别为(25.56±6.82)μg/L和(13.07±0.98)μg/L,CAC组血清OPG和BMP-2水平均显著高于非CAC组,差异均有统计学意义(t=133.286、99.295,P<0.01)。
2.3 各CAC组血清OPG及BMP-2水平的比较 Ⅱ、Ⅲ、Ⅳ级CAC组较Ⅰ级组血清OPG及BMP-2水平明显升高(P<0.01),Ⅲ、Ⅳ级CAC组较Ⅱ级组血清OPG及BMP-2水平明显升高(P<0.01),Ⅲ级CAC组与Ⅳ级组血清OPG及BMP-2水平比较差异无统计学意义。见表2。
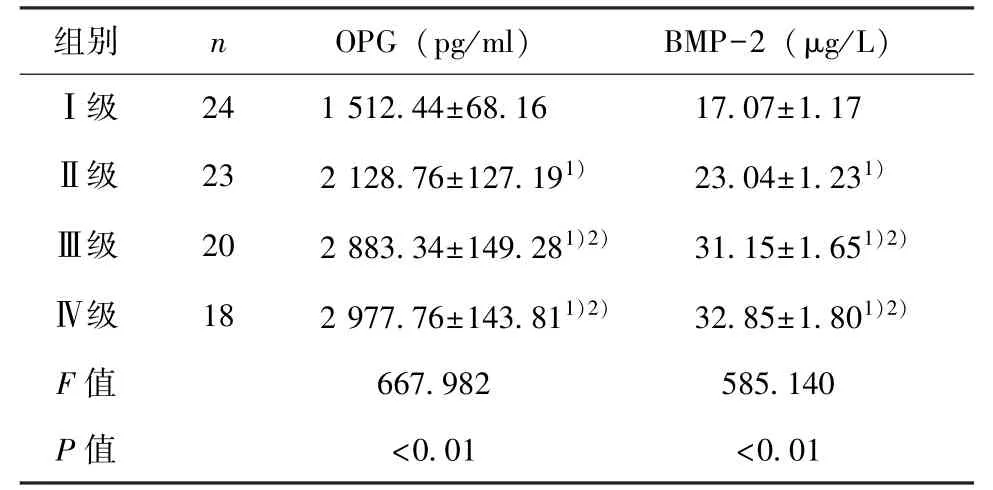
表2 各CAC组间血清OPG及BMP-2水平比较
3 讨论
CAC是冠状动脉粥样硬化基础上钙盐沉积于血管壁的病理生理现象。CAC使冠状动脉明显重塑,血管顺应性降低,进一步影响心肌灌注,介入治疗是目前改善心肌灌注的主要治疗方法,但轻中重度CAC均可导致斑块不稳定,可增加介入手术难度及手术费用,并导致预后不良。研究表明,CAC是心血管事件的潜在预测因子[4]。IVUS是目前诊断CAC的金标准,IVUS是将微超声探头置于血管腔并发射高频超声,通过阻抗不一样的组织界面时,产生反射、透射、散射现象,收集这些超声回波信号并经系统电路处理后形成图像,可实时显示管壁及管腔结构,对CAC敏感性及特异性均大于90%,可很好地判断钙化的位置和弧度[5]、评估钙化横向和纵向范围[6]、对钙化结节敏感性也很高[6]。根据钙化病变累及血管腔范围,将病变依据钙化范围<90°、90~180°、181~270°、>270°分为Ⅰ~Ⅳ级。但IVUS对CAC的评估也有局限性,由于钙化声影的影响,不能评估钙化厚度[6],易低估钙化程度。
CAC的机制目前尚不明确,研究表明,血管钙化是由多种酶、蛋白质及细胞因子等调控的有序的、主动的调节过程[7],同时,基因、遗传、内皮损伤、氧化应激、饮食、环境、感染、药物等多种因素均参与血管钙化发生发展。Fuery等[8]对动脉钙化斑块病理学研究发现钙化斑块中有骨骼成骨的典型表现,表明动脉钙化的发生与成骨机制类似,许多骨形成机制中的调节因子如BMP、骨桥蛋白、OPG和RANKL等同样参与血管钙化的发生发展。
OPG是一种可溶性分泌型糖蛋白,属于肿瘤坏死因子受体超家族成员之一,拥有调控骨密度和预防骨质疏松的作用。RANKL与破骨细胞前体细胞表面的核因子-κB受体活化因子(RANK)特异性结合以刺激破骨细胞前体细胞活化为成熟破骨细胞,OPG作为RANKL竞争受体,亦可竞争性地与RANKL结合,进而抑制破骨细胞分化、成熟,诱导破骨细胞凋亡,从而增加骨密度和预防骨质疏松[9]。近年来,OPG参与血管钙化发生发展已获得大家认可,但OPG在血管钙化发生发展中起促进还是抑制作用呈现两极化观点。动物实验研究结果显示OPG可抑制血管钙化,防止血管损伤[10-11];但临床研究结果显示,CAC患者血清OPG水平明显高于非钙化患者,认为OPG是高血压患者血管钙化的危险因素[12]。
BMP作为转化生长因子β(TGF-β)超家族成员之一,是一种多功能的糖蛋白,在人体内主要存在于骨皮质、神经组织及多种间充质组织中,是目前发现惟一能够诱导异位成骨的细胞因子。目前已发现40余种单体亚型中,BMP-2是成骨活性最强的细胞因子,其可能通过microRNAs、MGP、细胞凋亡、氧化应激及高血糖等多方面诱导细胞趋化、细胞有丝分裂增生、细胞分化,最终诱导异位骨形成,导致CAC形成。Chen等[13]研究发现外源BMP-2可促进体外血管平滑肌细胞钙的沉积;Dhore等[14]发现在CAC时BMP-2表达明显上调。本研究结果均与上述研究一致,提示BMP-2在CAC中的重要促进作用。
本研究中,CAC各组血清OPG及BMP-2水平均较无钙化组明显升高(P<0.01),Ⅱ、Ⅲ、Ⅳ级钙化组较Ⅰ级钙化组,Ⅲ、Ⅳ级钙化组较Ⅱ级钙化组血清OPG及BMP-2水平明显升高(P<0.01),提示血管钙化程度与血浆OPG及BMP-2水平明显相关,但这不能说明OPG就是促进血管钙化的危险因子,基于OPG在体内的作用机制,OPG水平升高可能是机体对血管钙化的保护性反应,升高的血清OPG可能起到对抗血管钙化进一步发展和加重的作用;BMP-2表达上调加速血管钙化发生发展。本研究中,Ⅲ级与Ⅳ级钙化组血清OPG及BMP-2水平比较差异无统计学意义,考虑IVUS评估CAC角度时,因钙化声影的影响,无法充分评估重度斑块厚度,特别当钙化角度>180°时,更易低估钙化程度,当钙化角度>180°时,钙化角度可能与全身血管病变总钙化量不成正比。
综上所述,血管钙化程度与血清OPG及BPM-2水平相关,但本研究入选病例较少,且由于患者对IVUS检查接受程度、检查费用、急诊手术开通血管时间要求等原因影响,未能将隐匿性心肌缺血、稳定型心绞痛、急性ST段抬高型心肌梗死患者纳入研究,造成冠心病患者入选的相对局限性。OPG及BMP-2是否可作为有无CAC及钙化程度的临床评测指标还待大样本研究。同时,CAC目前尚无有效治疗方法,OPG补充剂或刺激因子以及BMP-2抑制剂能否成为预防或延缓CAC的治疗方法,还待进一步研究。
