基于电化学发光和阻抗技术研究DNA 单碱基错配
2021-12-02姚武崔朋胡晓倩
姚武,崔朋,胡晓倩
(1.黄山学院 化学化工学院,安徽 黄山 245041;2.黄山学院 生命与环境科学学院,安徽 黄山 245041)
0 引言
人类基因研究揭示了单核苷酸多态性(single nucleotide polymorphisms,SNP)与遗传性疾病有直接关系。因此,DNA 单碱基错配的识别和稳定性研究在疾病分子诊断、临床预测、疾病预防和治疗等领域有重要作用[1-3],得到国内外研究者的持续关注。
基于DNA 杂交、聚合酶、连接酶、内切酶等技术,结合不同信号表达方法,已有不同类型的DNA单碱基错配识别传感器,包括荧光[4-6]、电化学[7-9]、电化学阻抗(EIS)[10-12]、电化学发光(ECL)[13-14]、石英晶体微天平(QCM)[15]、质谱(MS)[16-17]、表面等离子体共振(SPR)[18]、可见光谱与可视化技术[19-21]等,并取得了长足进步。然而,单碱基错配识别仍存在巨大挑战,由于单碱基错配识别取决于其热力学稳定性,所以DNA 链中不同类型和不同位点的单碱基错配识别和稳定性差异研究尤为重要。
为发挥ECL 和EIS 技术的优势,并对结果进行相互印证,提高研究结果的可靠性,本文在同一电化学DNA 传感器(EE-DNA 传感器)平台上,首次同时采用ECL 和EIS 技术,研究与胞嘧啶碱基C 不同类型和不同位点单碱基错配碱基对的识别和稳定性差异。EE-DNA 传感器平台的构建参照文献[13-14]并做适当修改。传感器表面具有茎环构象的分子探针DNA(pDNA)与互补DNA(cDNA)杂交后,转化为刚性线形的双螺旋DNA,ECL 信号显著减弱,EIS 信号显著增强。pDNA 在与不同类型或不同位点的单碱基错配DNA 杂交时,由于单碱基错配的稳定性减弱程度不同,ECL 信号有不同程度的减弱,而EIS 信号有不同程度的增强。
1 实 验
1.1 仪器与试剂
CHI660c 型电化学工作站(上海晨华仪器公司)用于三电极系统电解和EIS 信号采集。BPCL-2-KIC 型超微弱发光分析仪(中国科学院北京生物物理研究所)用于ECL 信号采集。日立U-3010 型紫外分光光度计(日本)用于测定紫外可见吸收光谱。
二-(2,2'-联吡啶)-4'-甲基-4-羧基联吡啶钌(Ⅱ)琥珀酰胺酯-二-六氟磷酸盐(Ru(bpy)2(cbpy)NHS)购自Fluka 化学试剂公司,三丙基胺(TPA)(99%)购自ACROS 化学试剂公司,三-(2-羧基乙基)膦盐酸盐(TCEP)和2-巯基乙醇(ME)购自阿法埃莎(天津)化学有限公司。探针DNA(pDNA)、互补DNA(cDNA)和单碱基错配DNA(mDNA)等寡核苷酸链均购自生工生物工程(上海)股份有限公司,寡核苷酸链序列见表1。pDNA 序列的两端为6个互补碱基,可以形成茎环分子构象,3'端修饰的氨基用于标记联吡啶钌分子,5'端修饰的巯基用于pDNA 通过Au—S 键在金电极上进行自组装。在含29 个碱基长度的单碱基错配DNA 中,mDNA1、mDNA2、mDNA3、mDNA4、mDNA5 分别表示距5'端第1,8,13,20,27 号位点的C-A 单碱基错配的5种情形,mDNA6、mDNA7 分别表示 距5'端第13 号位点C-T 和C-C 单碱基错配的2 种情形。其他试剂均为分析纯,使用时未经纯化。

表1 寡核苷酸序列Table 1 Oligonucleotide sequences
1.2 联吡啶钌分子标记pDNA
依照文献[22-23]的方法对pDNA 的联吡啶钌发光分子标记做适当修改后进行合成和表征。将0.25 mg 的Ru(bpy)2(cbpy)NHS 溶解于15 μL N,N-二甲基甲酰胺(DMF)中,然后将其加入85 μL 0.1 mol·L−1的硼砂缓冲溶液(pH 8.5)中,并将此溶液加入50 μL pDNA 水溶液(1 OD)中,振荡摇匀,室温下连续振荡,过夜。此时,Ru(bpy)2(cbpy)NHS 中的琥珀酰胺酯被pDNA 3'端的氨基取代,生成酰胺键,从而Ru(bpy)2(cbpy)被标记到pDNA 3'端,得到发光分子联吡啶钌标记的pDNA(pDNARu)。振荡过夜后,在其中加入30 μL 3 mol·L−1醋酸钠溶液和600 μL 冻乙醇,振荡摇匀,于−18 ℃冷冻放置24 h,在4 ℃和12 000 r·min−1条件下,进行30 min 的冷冻离心,弃上层溶液,沉淀,用75%的冻乙醇溶液洗涤2 次,再次在4 ℃和12 000 r·min−1条件下离心,弃上层溶液,将所得沉淀物在室温下干燥,再加37 μL 高纯水溶解,作为pDNA-Ru 储备液,置于4 ℃冰箱密封保存,待用。标记产物用紫外可见吸收光谱进行表征。
1.3 EE-DNA 传感器构建
依次用α-Al2O3粉进行抛光,超纯水和无水乙醇超声清洗金电极,然后在0.5 mol·L−1H2SO4溶液中进行循环伏安扫描,直至出现典型且稳定的金电极循环伏安曲线。取出金电极,用超纯水清洗干净,并用高纯氮气吹干待用。
取一定量的pDNA-Ru 储备液配制浓度为2 μmol·L−1的溶液(10 mmol·L−1PBS,0.1 mol·L−1NaCl,5 mmol·L−1MgCl2,1 mmol·L−1TCEP,pH 7.4)。将处理干净且吹干的金电极迅速插入500 μL的上述溶液中,在室温下浸泡4 h,pDNA-Ru 通过5'端修饰的巯基借助Au—S 键自组装到金电极表面,用0.1 mol·L−1的PBS 缓冲溶液(pH 7.4)淋洗电极表面,洗去物理吸附的pDNA-Ru。将该电极浸泡于2 mmol·L−1ME 溶液(10 mmol·L−1PBS,1 mol·L−1NaCl,pH 7.4)中,钝化30 min,除去非特异性键合的pDNA-Ru 和封闭未键合的pDNA-Ru 的金电极表面位点。完成EE-DNA 传感器组装,待用。
1.4 EE-DNA 传感器的ECL 和EIS 信号测量
分别将新组装的EE-DNA 传感器、Ag/AgCl(饱和KCl)电极和铂丝电极作为工作电极、参比电极和对电极,组成三电极系统。
第1步,将三电极系统插入2.0 mL 5 mmol·L−1的[Fe(CN)6]4−/3−(0.1 mol·L−1KCl)溶液中,选择电化学工作站交流阻抗方法测量EE-DNA 传感器的EIS 信号(电荷转移电阻Rct)。交流电压振幅为5 mV,EIS 测量的频率范围为0.05 Hz~100 kHz。用0.1 mol·L−1的PBS 缓冲溶液(pH 7.4)清洗三电极系统。再将三电极系统插入2.0 mL 0.1 mol·L−1的TPA 溶液(0.1 mol·L−1PBS,pH 7.4)中,选择电化学工作站循环伏安法进行电解,同时用超微弱发光仪测量EE-DNA 传感器的ECL 信号。循环伏安扫描电位范围为0~0.75 V,扫描速度为100 mV·s−1。超微弱发光仪的光电倍增管偏压设为−900 V。
第2 步,将EE-DNA 传感器放入cDNA 或不同单碱基错配DNA 溶液(10 mmol·L−1PBS,0.1 mol·L−1NaCl,5 mmol·L−1MgCl2,pH 7.4)中,于37 ℃下孵化杂交30 min,取出,用0.1 mol·L−1的PBS 缓冲溶液(pH 7.4)淋洗电极表面。重复第1步,分别测定孵化杂交后的EIS 和ECL 信号。
2 结果与讨论
2.1 pDNA-Ru 的紫外可见吸收光谱表征
用紫外可见吸收光谱表征pDNA-Ru,如图1 所示。图内插图为pDNA-Ru 吸收光谱曲线的局部放大。450 nm 的吸收峰对应联吡啶钌琥珀酰胺酯452 nm 的特征吸收,是联吡啶钌配离子中金属钌到配体的电荷转移特征吸收带,说明联吡啶钌已被成功地标记在pDNA 链上。
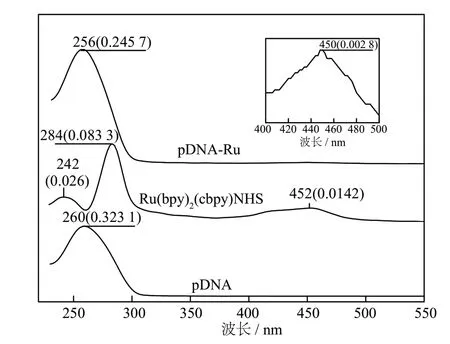
图1 pDNA、Ru(bpy)2(cbpy)NHS 和pDNA-Ru 的紫外可见吸收光谱Fig.1 The UV-Vis spectra of pDNA、Ru(bpy)2(cbpy)NHS and pDNA-Ru
2.2 EE-DNA 传感器的循环伏安表征
电化学探针[Fe(CN)6]4−/3−的循环伏安曲线常被用于表征电极修饰过程和DNA 杂交过程。图2 是不同修饰阶段的金电极在[Fe(CN)6]4−/3−溶液中的循环伏安曲线,由图2 中a,b 曲线可知,裸金电极用pDNA-Ru 修饰,并经 ME 溶液钝化后,探针[Fe(CN)6]4−/3−的氧化和还原峰电流均明显减小,峰电位差显著增大。这是由于pDNA 通过Au—S 键自组装到金电极表面后,金电极表面被一层pDNA-Ru 覆盖,DNA 链中带负电荷的磷酸基团与带负电荷的电化学探针[Fe(CN)6]4−/3−之间存在静电排斥作用,减弱了探针[Fe(CN)6]4−/3−与电极表面的电荷传递。由图2 中的c 和d 曲线可知,当探针pDNA-Ru 分别与0.2 和20 nmol·L−1的目标cDNA杂交后,探针[Fe(CN)6]4−/3−的峰电流进一步减小,峰电位差进一步增大。这是由于杂交形成双链DNA后,金电极表面的DNA 进一步增多,负电荷量继续增加,进一步阻碍了探针[Fe(CN)6]4−/3−在电极表面的电化学反应。
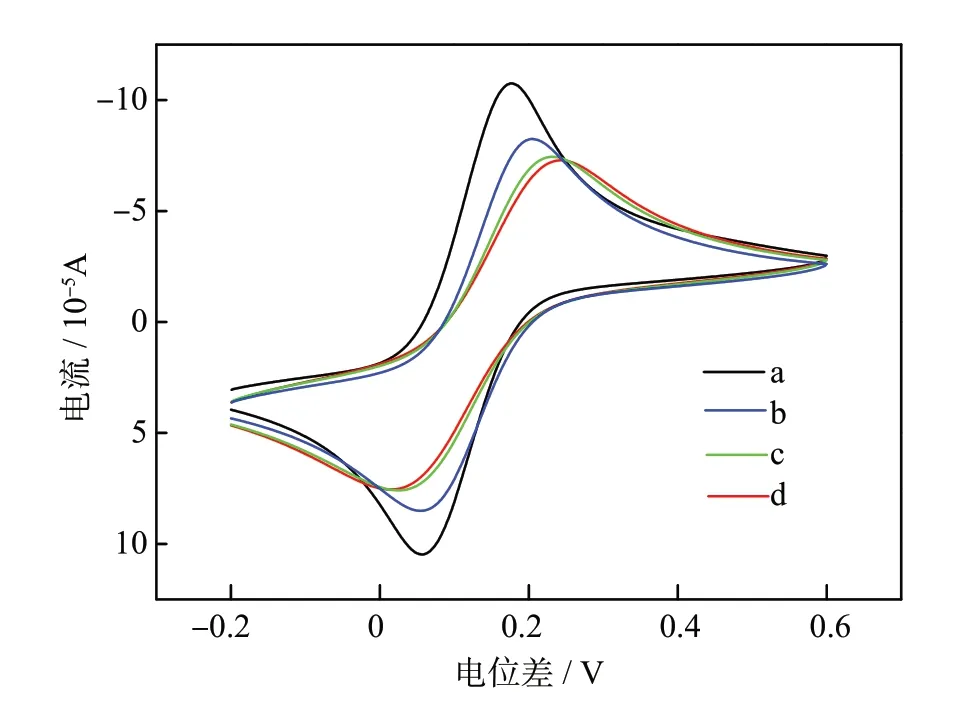
图2 裸金电极(a),pDNA-Ru 修饰电极(b),pDNA-Ru 分别与0.2 和20 nmol·L−1 cDNA 杂交后的修饰电极((c)和(d))在5 mmol·L−1[Fe(CN)6]4−/3−(0.10 mol·L−1 KCl)溶液中的循环伏安曲线Fig.2 CVs of the modified electrode at different stages in 5 mmol·L−1[Fe(CN)6]4−/3−(0.10 mol·L−1 KCl)solution.(a)bare Au electrode;(b)pDNA-Ru modified Au electrode;(c)and(d)pDNA-Ru modified Au electrode after hybridization with 0.2 and 20 nmol·L−1 cDNA solution,respectively
2.3 实验条件优化
探针pDNA-Ru 的自组装时间对ECL 信号有显著影响。当自组装时间低于4 h 时,pDNA-Ru 组装量不够,ECL 信号较弱。当自组装时间接近4 h 时,ECL 信号最强。当自组装时间大于4 h 时,ECL 信号减弱,这可能是由于自组装时间过长,在金电极表面非特异性吸附的pDNA-Ru 增多,在后续的钝化过程中不能完全排除,虽然联吡啶钌分子增加了,但电极表面的电阻也大大增加,导致导电性减弱,不利于电极表面发生电化学反应,从而使ECL 信号减弱。因此,选择pDNA-Ru 自组装时间为4 h。
EE-DNA 传感器的电解电位是影响ECL 信号强度和重复性的重要参数,如图3 所示。当电位为0~0.60 V 时,几乎无ECL 信号产生。当电位为0~0.70 V 时,ECL 信号很弱,连续测定2 次,信号基本稳定。当电位为0~0.75 V 时,ECL 信号显著增强,连续测定3 次,信号基本稳定。当电位为0~0.80 V时,第1 次扫描测定,ECL 信号强度比高位为0.75 V时还高,但继续扫描第2,3 次,ECL 信号显著减小。继续增高电位,ECL 信号显著降低。产生这种现象的原因可能是电位达到0.80 V 或更高后,Au—S 键因氧化被破坏,探针pDNA-Ru 从金电极表面脱落,导致ECL 信号减弱且不稳定。因此,选择循环伏安电解电位为0~0.75 V。
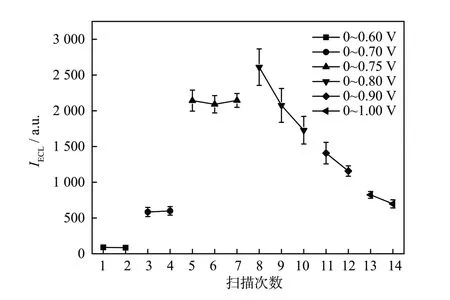
图3 电解电位对EE-DNA 传感器ECL 信号强度的影响Fig.3 The dependence of the ECL intensity and reproducibility on the applied potential
pDNA-Ru 与目标DNA 的孵化杂交时间对传感器ECL 信号的变化也有显著影响。随着EEDNA 传感器与cDNA 孵化杂交时间从10 min 增至30 min,ECL 信号逐渐减弱,当孵化杂交时间超过30 min 后,ELC 信号基本保持稳定。可见孵化30 min 可以使杂交达到饱和。因此,选择孵化杂交时间为30 min。
2.4 pDNA-Ru 与cDNA 和单碱基错配mDNA3 杂交前后ECL 和EIS 信号的变化
在上述优化实验条件下,pDNA-Ru 与0.2 和20 nmol·L−1的目标cDNA 杂交前后,EE-DNA 传感器的ECL 信号强度(IECL)和EIS 信号强度(Rct)发生了显著变化,如图4 所示。在pDNA-Ru 与互补cDNA 杂交前,其IECL为2 182 a.u.,Rct为705 Ω。在pDNA-Ru 分别与0.2 和20 nmol·L−1的cDNA 杂交后,IECL显著降低,降至922 和365 a.u.,Rct分别增至1 381 和1 709 Ω。杂交前后的IECL变化(−ΔIECL)和电荷转移电阻变化(ΔRct)分别为1 260,1 817 a.u.和676,1 004 Ω。
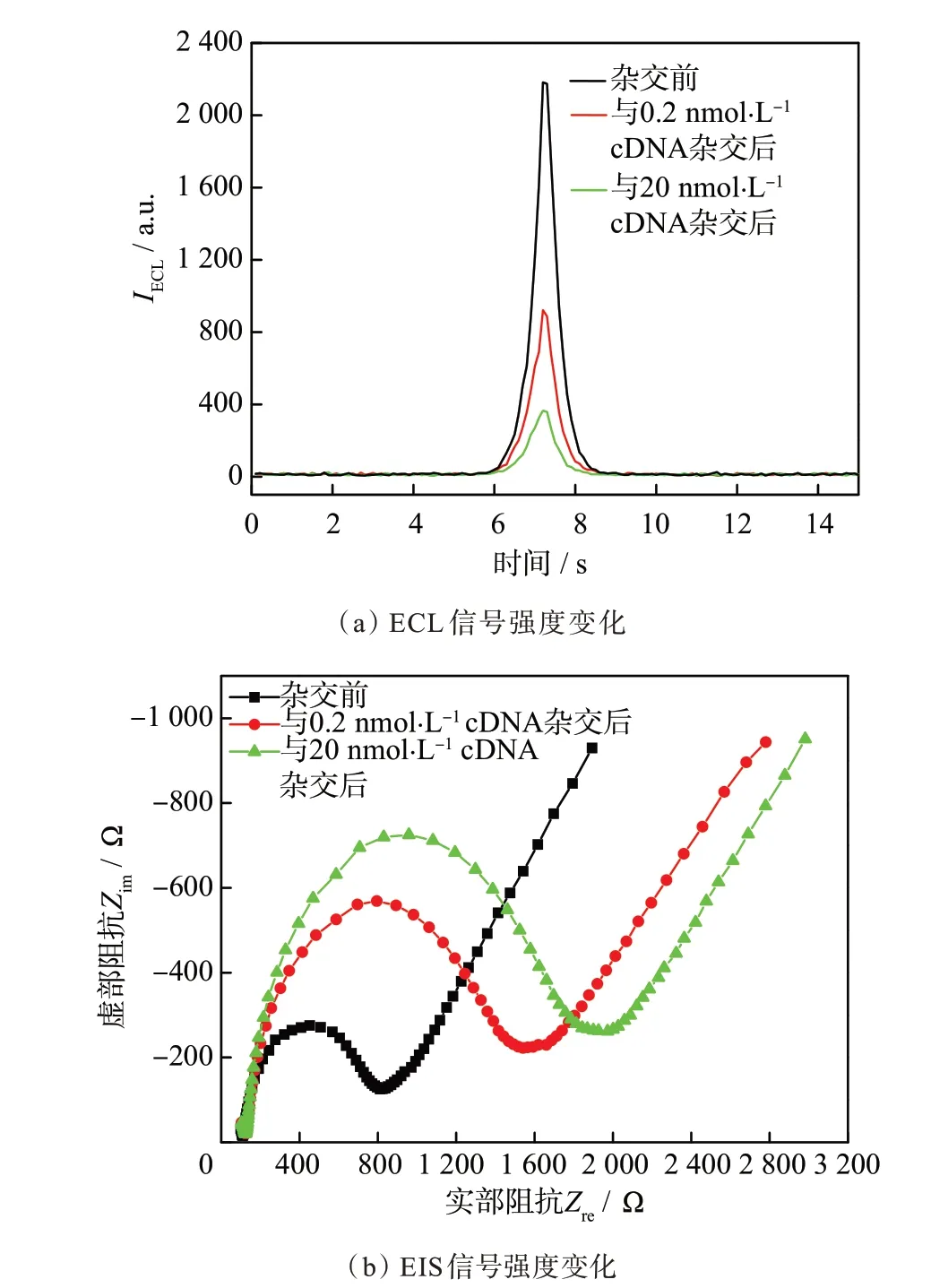
图4 pDNA-Ru 杂交前、分别与0.2 和20 nmol·L−1 cDNA 杂交后的ECL 曲线和EIS 曲线Fig.4 ECL spectra and EIS spectra of pDNA-Ru,pDNA-Ru after hybridization with 0.2 and 20 nmol·L−1 cDNA,respectively
产生此结果的原因是,当pDNA-Ru 与cDNA充分杂交后,茎环构象转变为刚性线形的双链DNA结构,导致ECL 信号分子联吡啶钌远离电极表面,电极反应速率下降,ECL 信号强度显著降低。同时,由于电极表面DNA 量增多,负电荷数增加,进一步阻碍了电化学探针[Fe(CN)6]4−/3−在电极表面的电化学反应,电荷转移电阻显著增大,导致−ΔIECL和ΔRct较大。
pDNA-Ru 与0.2 和20 nmol·L−1的单碱基错配mDNA3(距5'端第13 位点C-A 单碱基错配DNA)杂交前后,IECL和Rct变化相对较小,如图5 所示。杂交前IECL为2 300,Rct为625 Ω,杂交后IECL分别降至1 624 和1 174 a.u.,Rct分别 增至789 和804 Ω。此时,杂交前后的−ΔIECL和ΔRct分别为676,1 126 a.u.和164,179 Ω。
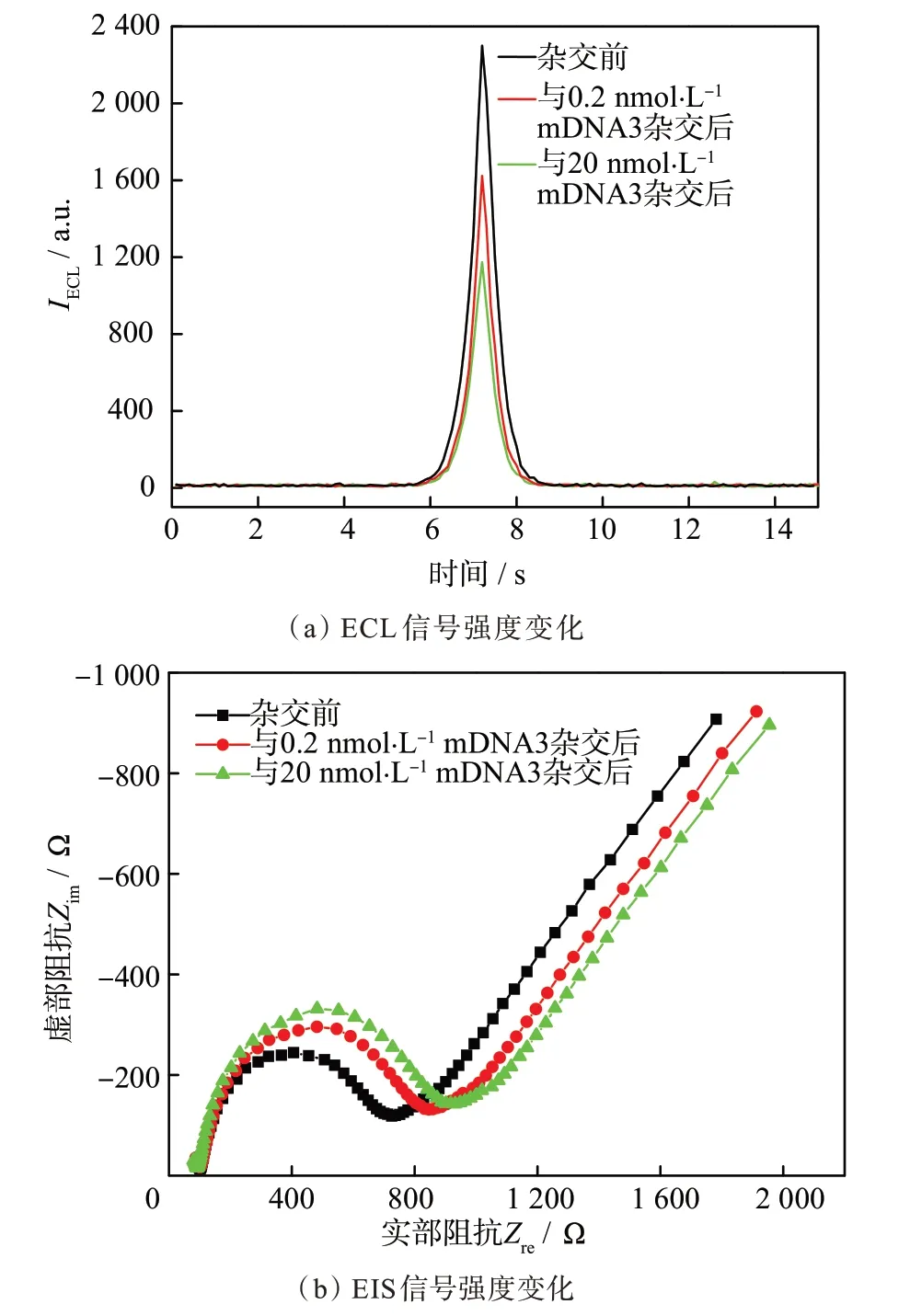
图5 pDNA-Ru 杂交前、分别与0.2 和20 nmol·L−1 mDNA3杂交后的ECL 曲线和EIS 曲线Fig.5 ECL spectra and EIS spectra of pDNA-Ru,pDNA-Ru after hybridization with 0.2 and 20 nmol·L−1 mDNA3,respectively
当具有茎环构象的pDNA-Ru 与第13 位点的C-A 单碱基错配mDNA3 孵化时,杂交前后的−ΔIECL和ΔRct大大减小,说明pDNA-Ru 与mDNA3 的结合较弱,杂交稳定性明显降低,使得具有颈环构象的pDNA-Ru 形成刚性线形双链DNA的概率大大降低,导致−ΔIECL减小,ΔRct降低。
2.5 不同类型或不同位点单碱基错配DNA 的识别和稳定性差异
图6 为探针pDNA-Ru 分别与0.2 nmol·L−1的cDNA 和不同类型或不同位点单碱基错配DNA 杂交前后的−ΔIECL和ΔRct。可 知,pDNA-Ru 与cDNA 杂交前后,−ΔIECL和ΔRct分别为1 260 a.u.和676 Ω。探 针 pDNA-Ru 与 mDNA1、mDNA2、mDNA3、mDNA4、mDNA5 杂交前后,−ΔIECL和ΔRct分别为1 177,991,660,906,788 a.u.和587,365,164,295,271 Ω。探针pDNA-Ru 与mDNA6、mDNA7 杂交前后,−ΔIECL和ΔRct分别为813,594 a.u.和288,157 Ω。因此可根据−ΔIECL和ΔRct对不同类型、不同位点单碱基错配DNA 进行识别和稳定性差异研究。
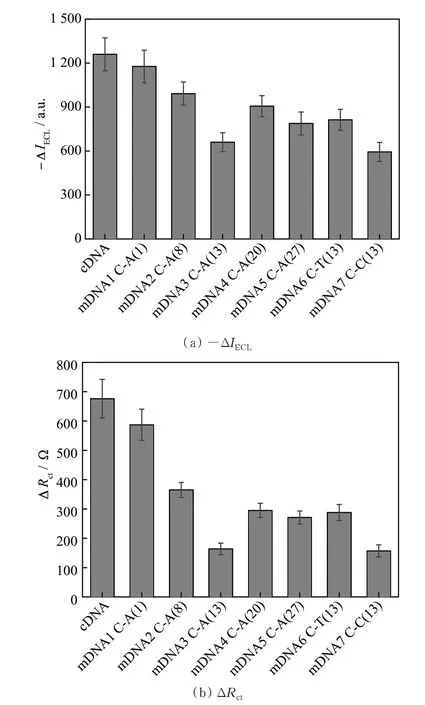
图6 pDNA-Ru 与cDNA(0.2 nmol·L−1)和单碱基错配DNA(0.2 nmol·L−1)杂交前后的−ΔIECL(a)和ΔRct(b)Fig.6 −ΔIECL(a)和ΔRct(b)of pDNA-Ru before and after hybridization with cDNA(0.2 nmol·L−1)and different singlebase mismatch DNAs(0.2 nmol·L−1)
比 较 pDNA-Ru 与 mDNA1、mDNA2、mDNA3、mDNA4、mDNA5 杂交前后的−ΔIECL和ΔRct,可知在DNA 链中间位点的C-A 单碱基错配mDNA3 的−ΔIECL和ΔRct最小,而链两端位点C-A单碱基错配DNA 的−ΔIECL和ΔRct相对较大,说明链中间位点的C-A 单碱基错配的稳定性小于链两端位点的,该结论 与ABAD-VALLE 等[24]和LI等[25]的实验结果一致。
KELLEY 等[26]认为,错配的单碱基对离电极表面越近,对杂交的稳定性影响越大,而ITO 等[12]和TAWA 等[27]得到了相反的结论,认为在DNA 杂交过程当中,单碱基错配出现在离固体基底最远的位置,即越接近溶液的单碱基错配越不稳定,越容易被识别。通过比较本文图6 中mDNA1 和mDNA5、mDNA2 和mDNA4 的−ΔIECL和ΔRct的变化可知,靠近键合电极表面双链链端的C-A 单碱基错配的稳定性小于非键合电极表面双链链端的,此结果与KELLEY[26]等的研究结果相同。
WU 等[20]采用可见光谱与可视化技术研究了与胞嘧啶C 单碱基错配的识别,得到的稳定性顺序为C-G≫C-T>C-A>C-C。HUANG 等[5]用氧化石墨烯荧光淬灭技术进行了与胞嘧啶C 单碱基错配的识别检测,得到的稳定性顺序为C-G≫C-A≈C-C≈C-T。本文研究了单碱基错配DNA 中心位点分别为C-A、C-T、C-C 3 种错配情况对杂交稳定性的影响,通过比较研究cDNA、mDNA3、mDNA6 和mDNA7 的−ΔIECL和ΔRct变化,发现C-T 单碱基错配的稳定性略高于C-A 和C-C 的,稳定性顺序为C-G ≫C-T>C-A≥C-C。该结果 与WU 等[20]的研究结果较接近。
3 结论
将具有茎环构象、标记有联吡啶钌分子的DNA链作为探针,构建DNA 生物传感器,通过该pDNARu 与cDNA 和单碱基错配DNA 杂交前后ECL 和EIS 信号变化的差异进行单碱基错配DNA 识别,并研究了不同类型和不同位点单碱基错配的稳定性差异。结果表明,DNA 链中心位点的C-A 单碱基错配稳定性小于链两端的,靠近键合电极表面双链链端的C-A 单碱基错配稳定性小于非键合电极表面双链链端的,同一中心位点的碱基对稳定性顺序为C-G ≫C-T>C-A≥C-C。研究结果可为核酸多态性研究提供参考。
