应激大鼠模型结肠组织中spexin 的表达变化及代谢物质研究
2021-12-02马燕华樊保敏林成源
赖 奇,马燕华,樊保敏,赵 玲,林成源
(1.云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500;2.香港浸会大学 中医药学院,香港 999077)
Spexin(SPX)是通过现代生物信息学技术发现并鉴定的神经肽[1],属于甘丙肽(galanin) 家族,可有效激活甘丙肽受体2(GALR2)和甘丙肽受体3(GALR3)[2].病理生理学研究发现,spexin 作为一种内源性神经调节因子,与肥胖、糖尿病、非酒精性脂肪肝、以及抑郁和焦虑相关疾病的发病机理密切相关[3-5].通过对spexin 生理功能和调节机制的深入研究可为针对相关疾病的药物开发提供新的科学证据.
近期研究表明,spexin 及其受体在调节动物摄食和胃肠道功能方面发挥重要的生理学功能[1, 6].小鼠饥饿状态下spexin 表达量显示规律性变化,且能够参与调节小肠和结肠的运动[7].小鼠血液及消化道组织样本代谢组学分析发现,spexin 在脂类代谢通路中发挥重要作用,可通过调节肝脏中胆汁酸的合成影响胆汁酸的肝肠循环途径[8].肠道脂质代谢的正常运作对于确保向人体各个器官提供充足的能量(以脂质形式)非常重要.人体脂质吸收过程异常可能导致色素性视网膜炎,脊髓小脑变性,生长迟缓等[9-10].此外,肠道中脂类代谢产物的变化显著影响肠道运动,与便秘或者腹泻症状的发病过程密切相关[11-12].
众所周知,早年的压力和逆境是人类晚年胃肠道疾病发作和严重程度的主要危险因素[13].应激压力会引起胃肠道炎症以及运动失调从而导致便秘或者腹泻的产生.前期研究发现,并且通过脑注射spexin 可有效缓解小鼠焦虑的症状,表明spexin 是机体内重要的精神调节因子[14].然而,应激状态下spexin 在肠道中的表达状况尚需进一步研究.综合现有研究结果来看,应激所导致的肠道运动功能紊乱很有可能与肠道中spexin 的表达及脂代谢的变化水平有关.因此,我们通过对应激诱导的大鼠模型结肠中spexin 及其受体的基因检测和结肠组织代谢组学研究深入探索这一推论的可能性,以期发现spexin 在焦虑或抑郁等精神疾病所导致的消化道功能紊乱中的作用.
1 材料与方法
1.1 材料与试剂
RNAiso Plus、PrimeScript. RT reagent Kit with gDNA Eraser、SYBR. Premix Ex Taq. Ⅱ 购买于TaKaRa 公司(Tokyo,日本);PCR 引物由上海生物工程有限公司合成;代谢组学所用化学标准品购自Sigma-Aldrich 公司(美国).大鼠饲养所需普通饲料和玉米芯垫料均购自四川省医学科学院四川省人民医院实验动物研究所.
1.2 仪器
超高性能液相色谱系统(UHPLC,Agilent 1290 Infinity,美国);四极杆飞行时间质谱仪(QTOF-MS,Agilent 6543,美国);组织匀浆仪TissueLyser(Qiagen,德国);ViiA.7 实时PCR 系统(Applied Biosystems,美国);Eppendrof 5424R 低温高速离心机(德国).
1.3 应激动物模型的建立
SD大鼠购自四川省医学科学院四川省人民医院实验动物研究所.所有动物实验操作均依据《云南省实验动物管理条例》进行,并经云南民族大学实验动物伦理委员会批准,许可证编号SYXK(滇)K2017-0001 .
大鼠饲养于SPF 级动物房,温度控制在21~23 ℃,湿度 50%~65%,光照控制 12 h 明/12 h 暗,所喂饲料、水及所用垫料、笼盒均经过严格高压灭菌,大鼠可自由采食和饮水,除在哺乳期的母鼠,每一笼内小鼠不超过4 只,垫料每周更换一次.
怀孕SD 雌性大鼠单独饲养于SPF 级独立通气笼.大鼠分娩后立即将新生幼鼠随机分配到不同试验组.母婴分离模型(NMS)大鼠在出生后2~14 d ,每天与母鼠分开 3 h,而对照组幼鼠则保持与母鼠同笼状态.断奶PD 22 d 后将所有雌性大鼠排除在外仅保留雄性鼠进行进一步试验.大鼠成年后(PD 56),一半未处理的大鼠每天从PD 57 ~63 暴露于避水应激(WAS )状态持续 1 h[15].其余未处理的大鼠分配为对照组.试验共分为4 组,每组8 只.1)对照组NH+SS;2)母婴分离组NMS+SS;3)避水应激组NH+WAS;4)双重应激组NMS+WAS .观察实验期间1 h内大鼠的排便颗粒数,并收集样品(远端结肠和近端结肠).将所有样品立即保存在 -80 ℃ 直至下一步分析.
1.4 实时荧光定量PCR 检测
使用组织匀浆仪TissueLyzer 将重量为50 mg 的大鼠近端或远端结肠组织样品匀浆,通过RNAiso Plus 试剂提取总RNA.互补DNA 通过PrimeScript. RT 试剂盒合成.使用SYBR. Premix Ex Taq. Ⅱ在ViiA.7 实时PCR 系统上进行定量实时荧光定量PCR 检测spexin 以及GALR2 受体的表达情况.将β肌动蛋白基因作为内标,并使用ΔΔCT 分析方法进一步分析[16].
1.5 UPLC 分离亲水性和亲脂性代谢组
参照液-液萃取法使用水、甲醇和氯仿的混合物(体积比,1∶2、5∶1)提取结肠组织样品[17].涡旋并离心后,将所得上清液与 10 μL 作为内标(IS)的L-4-氯苯丙氨酸溶液(0.2 mg/mL)混合进行代谢组学分析.使用超高效液相色谱系统(UHPLC,Agilent 1290 Infinity, 美国)分别用亲水和亲脂色谱柱分离内源性极性和非极性代谢组.流动相由含0.1%甲酸的水(A)和含0.1%甲酸的乙腈(B)组成.使用 1.7 μm BEH Amide 色谱柱(2.1 mm×100 mm, Waters,美国)分离亲水性代谢组.梯度程序在 12 min 内从90%B 开始至30%B,将30% B 保持 1 min,然后在 0.1 min 内恢复到起始条件,重新平衡直至 18 min.流速为 0.25 mL/min,恒温 40 ℃.使用 1.7 μm C18色谱柱(2.1 mm×50 mm,Waters,美国)快速分离亲脂性代谢物.梯度程序如下:从30%B 开始,在 6 min 内升至100%B,在100%B 下保持 2 min,然后在 2 min 内回到30%B.随后将分离出的组分使用质谱仪进行分析.
1.6 QTOF-MS 分析和代谢物鉴定
四极杆飞行时间质谱仪(QTOF-MS,Agilent 6543,美国)与电喷雾电离源结合用于离子碎片收集.全扫描MS 分析,QTOF-MS 条件设置如下:脱溶剂气体的温度为 300 ℃;气体流量为8 L/min.对于ESI+,毛细管电压和锥电压分别设置为 3.2 kV 和 35 V;对于ESI-,毛细管电压和锥电压分别设置为 3 kV 和 50 V.质量检测范围设定为80至 1 000m/z.扫描时间设置为 0.3 s,帧间扫描延迟设置为 0.02 s.在目标MS/MS 采集模式下,将MS/MS 范围设置为30至 800m/z,并将碰撞能量设置为10、20和 40 eV,以便与化学标准品或METLIN 数据库进行比对.其他参数与全扫描模式下的设置相同.
1.7 数据处理和统计分析
使用MassHunter 定性分析程序(B.06 版,Agilent )和XCMS 软件包对获取的数据进行处理[18].使用SIMCA-P(11.0 版,Umetrics,Umea,瑞典)分析包含任意分配的峰指数(保留时间-m/z对),样品名称(观察值)和离子强度信息(变量)的矩阵.进行主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)来可视化与反应表型相关的特征性代谢谱.PLS-DA 和R分析[19]分别得出的重要特征是VIP> 1,调整后的p值<0.1 为显著差异(调整后的p值采用Benjamini 和Hochberg FDR 计算法).将识别出的特征基于MetaboAnalyst 3.0(http://www. metaboanalyst.ca )上的代谢物组富集分析(MSEA )的富集途径分析.其他值采用平均值±SEM 表示.使用GraphPad Prism 5.0 软件(GraphPad Software Inc.) 进行计算和绘图.使用Student′s t -test统计各组基因表达的差异.显著性差异用星号表示(*p<0.05;**p<0.01;***p<0.001)
2 结果
2.1 母婴分离(NMS)和避水应激(WAS )显著增加大鼠排便颗粒数
正常状态下(NH+SS),观测到的成年大鼠 1 h 内平均排便颗粒数为1.3~2.5 之间.分别在母婴分离应激(或对照组)大鼠出生后第57、58、59、60、61、62 和 63 d 观测成年雄性大鼠在避水应激(或对照状态下)1 h内粪便排除颗粒数.采用T检验与NH+SS组比较对数据进行分析,*p<0.05,**p<0.01,***p<0.001单独的母婴分离(NMS)应激组大鼠,在第 57 d 和第 63 d 发现排便颗粒数有增加趋势但统计不显著.在避水应激(WAS )刺激下,大鼠 1 h 内排便颗粒数显著增加,而NMS 和WAS 双重应激对大鼠的排便颗粒数有叠加效应(图1).说明应激状态下大鼠的结肠运动显著增强.
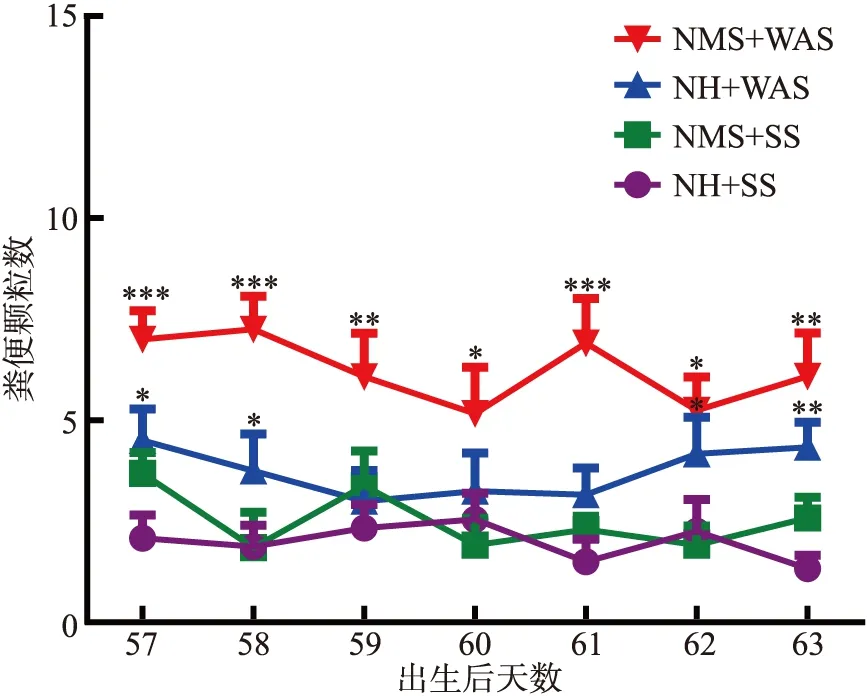
图1 大鼠排便颗粒数统计
2.2 应激显著增加大鼠结肠中spexin的基因表达
为了更加准确的反映应激诱导的spexin 基因表达的变化,分别对近端结肠和远端结肠组织样本进行了分析.结果显示,大鼠近端结肠中spexin 的表达水平在NMS、WAS 以及双重应激状态下均显著增加,且在双重应激组有叠加效应(图2A).将大鼠随机分为:对照组NH+SS、母婴分离组NMS+SS、避水应激组NH+WAS、双重应激组NMS+WAS.分别取近端结肠和远端结肠检测其spexin表达水平.采用T检验与NH+SS组比较对数据进行分析,*p<0.05尽管远端结肠中亦观察到spexin 表达的增加,其增加倍数要小于近端结肠部位.同时,NMS 和WAS 对远端结肠spexin 的表达影响未表现出叠加效应(图2B).
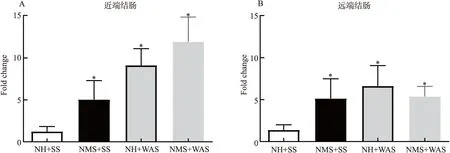
图2 应激反应对结肠组织中spexin 表达的影响
2.3 应激显著增加大鼠结肠中GALR2 的基因表达
前期研究发现,spexin 通过激活GALR2 受体促进肠道运动[7].因此也对应激状态下GALR2 的表达水平进行了检测.将大鼠随机分为:对照组NH+SS、母婴分离组NMS+SS、避水应激组NH+WAS、双重应激组NMS+WAS .分别取近端结肠和远端结肠检测其GALR2表达水平.采用T检验与NH+SS组比较对数据进行分析,*p<0.05.结果显示,大鼠近端结肠中GALR2 的表达水平在NMS、WAS 以及双重应激状态下均显著增加,在双重应激组未呈现出叠加效应(图3A).各组间远端结肠中GALR2 的表达水平差异不显著(图3B).
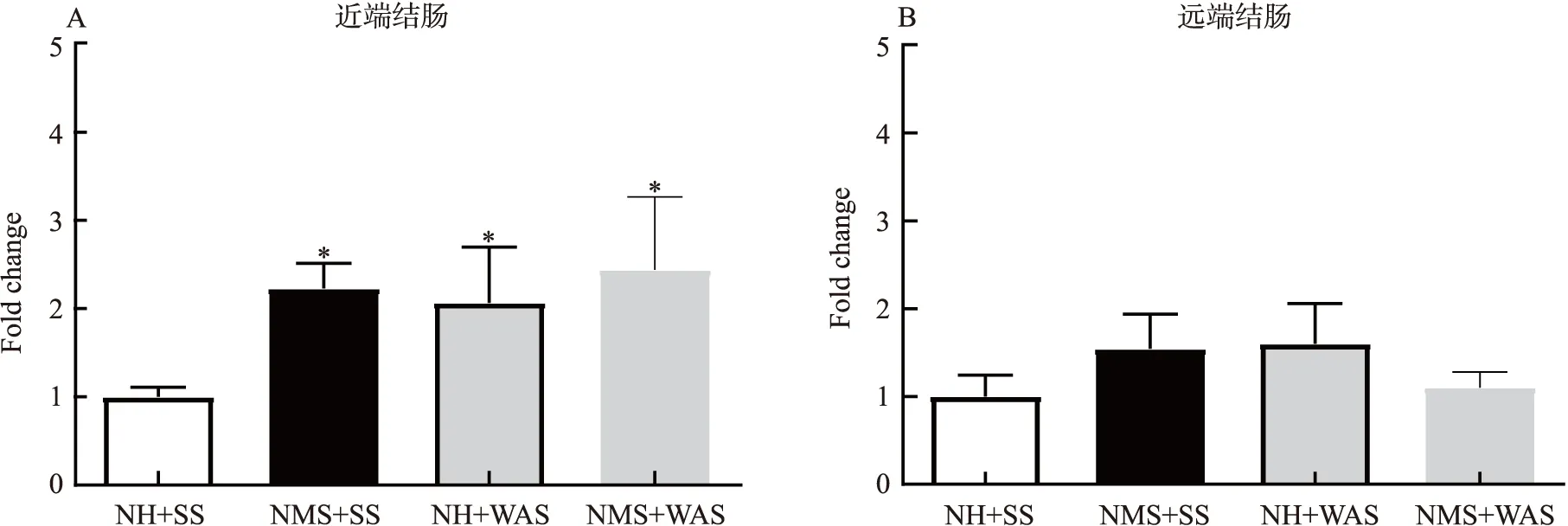
图3 应激反应对结肠组织中GALR2 表达的影响
2.4 应激状态下大鼠结肠中代谢组学的变化
在全局代谢图谱中,在正离子和负离子模式下分别捕获了总共459 个和413 个特征.代表性地,从PLS-DA 模型绘制的三维评分图显示对照组、避水应激组和母婴分离组的结肠组织代谢组明显分离(图4).Control:对照组(n=10);WWAS:避水应激组(n=9);NNMS:母婴分离组(n=9)其中41 个代谢物在应激反应时出现了显著差异,而在避水应激组和母婴分离组大鼠结肠组织中同时出现变化的代谢物有16 个(表1).
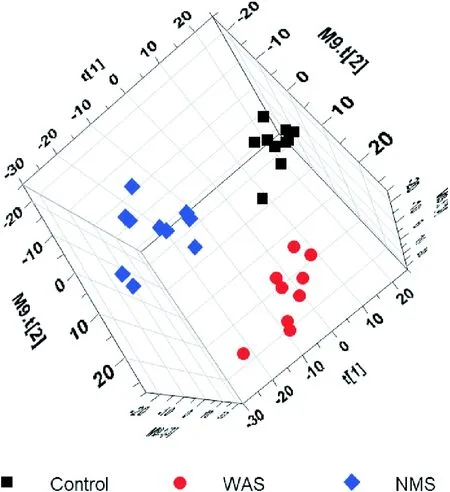
图4 通过PLS-DAA 模型的前3个主要成分计算的结肠样品中代谢组学谱的三维散点图

表1 避水应激和母婴分离引起结肠组织中代谢产物的变化情况
3 结语
已有研究表明spexin 作为内源性神经肽参与胃肠道功能的调节以及焦虑抑郁的发生过程.然而在应激状态下胃肠道中spexin 是否发生变化和参与了肠道运动调控尚需进一步研究.本研究采用2种不同的应激大鼠模型(WAS 和NMS)初步探讨了应激诱导的结肠组织中spexin 以及相关代谢产物的变化情况.
在应激模型中,大鼠的肠道运动显著增加,这一现象与前期研究发现保持一致[20].由于本研究同时采用了WAS 和NMS 2种应激模型,因此在观察对照组粪便颗粒数量的时候设置了与避水应激组相对应的对照模式(无水池,中间设置高台),这可能会导致对照组大鼠出现轻微的应激状态,因此造成NMS 组大鼠与对照组大鼠之间差异不显著.然而在双重应激组的大鼠中表现出的叠加效应反映了NMS 造成的大鼠应激同样会引起肠道运动增加.为了探讨应激诱导的肠道运动增加是否与spexin 信号调控有关,对大鼠结肠组织中spexin 和GALR2 受体的表达进行了检测.在应激模型大鼠近端结肠中,spexin 与GALR2 表达量均表现出较大幅度的显著升高.而远端结肠中GALR2 表达差异不显著,同时spexin 的变化幅度明显小于近端结肠.说明在应激所导致的spexin 信号调控变化可能主要发生在近端结肠部位.
代谢组学分析结果显示,大鼠应激后其结肠中相当一部分代谢产物发生了变化.其中性激素代谢(如孕酮)、鞘脂代谢(如O-磷酸乙醇胺)、α亚麻酸和亚油酸代谢(如亚油酸)、脂肪酸代谢(如琥珀酸和一磷酸腺苷)等代谢通路差异显著.这些发现为针对应激诱导的胃肠道疾病的发病机理研究提供肠道代谢组方面的科学依据.前期研究发现,spexin 能调节小鼠肝脏,肠道以及血清中的胆汁酸等脂代谢通路[8],由此推测上述代谢通路的变化或与spexin 的表达改变有关.后期针对spexin 在应激状态下对脂代谢的调控进一步深入研究将有利于阐明spexin 在胃肠道中的生理功能以及spexin 在胃肠道疾病发病机理中的作用.
