新型冠状病毒肺炎患者细胞免疫指标的动态演变及其对核酸转阴时间的影响
2021-12-01孙峰杨建中刘雪梅燕存子周晨亮
孙峰 杨建中 刘雪梅 燕存子 周晨亮
新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)自2019年12月以来呈全球暴发流行趋势,已成为危害全球人民健康的重大传染性疾病。COVID-19是病毒性肺炎的一种,机体的免疫状态对疾病的发生发展有重要影响,有研究报道发现,外周血CD4、CD8细胞计数水平越低,患COVID-19的风险性越大[1],且与严重程度相关[2]。然而对于细胞免疫指标在整个病程中的动态演变过程及其对核酸转阴时间的影响,尚未见报道。本研究回顾性收集确诊COVID-19患者的临床资料,分析从发病到核酸转阴整个病程中细胞免疫学指标的变化过程,期望阐述新型冠状病毒(SARS-CoV-2)感染对机体免疫状态的影响及与病毒核酸转阴时间的关系,为加快病毒肃清、缩短病程寻找治疗方向。
资料与方法
一、研究对象
通过电子病历系统回顾性收集武汉大学人民医院东院收治且于2020年2月20日至2020年3月15日好转出院的确诊COVID-19患者,根据病历资料及实验室检查,评估临床分型。诊断标准、出院标准及临床严重程度分型参照《新型冠状病毒肺炎诊疗方案(试行第七版)》[3]。排除标准:①病历资料不全或首发症状不典型,不能明确发病时间者;②未完成细胞免疫检测者。
二、研究方法
回顾性收集的所有患者多次免疫学指标检测时间点不均衡,故本研究以发病时间(即出现症状日期)为起点,按照发病0~4 d(P0)、5~7 d(P1)、8~10 d(P2)、11~14 d(P3)、15~21 d(P4)、22~28 d(P5)、29~35 d(P6)、36 d以上(P7)分为8个时间点,将所有免疫学检测指标归入各时间点进行分组比较。按照核酸转阴距离发病时间分为两组:A组,核酸转阴距发病时间≤30d;B组,核酸转阴距发病时间>30d。发病时间以电子病历中记录的首次出现COVID-19典型临床表现(发热或呼吸道症状)的日期为准。研究终点:连续两次呼吸道分泌物检测SARS-CoV-2核酸阴性(采样时间间隔24h以上)。核酸转阴时间,以连续两次呼吸道分泌物检测核酸阴性时的首次核酸阴性日期为准。同时记录病程中是否有使用糖皮质激素的情况。
三、新型冠状病毒核酸检测及判读
病毒核酸检测由武汉大学人民医院检验室完成,采用实时荧光RT-PCR检测,2019nCov核壳蛋白基因和开放阅读编码框1ab同时阳性者判读为阳性,同时阴性者判读为阴性,某一项为阳性者判读为可疑,需重新采样复查。
四、统计学方法
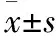
结 果
一、一般资料
本研究共检出COVID-19患者135例,其中12例因病史资料中缺乏COVID-19典型症状无法确定发病日期而剔除,另有7例因未完成细胞免疫检测而剔除。最终本研究纳入病历116例,其中男性60例(50.9%),女性56(49.1%),年龄25~83岁,中位数年龄59.5岁。普通型38例,重型72例,危重型6例。主要的临床首发症状包括:发热102例(87.9%),咳嗽77例(66.4%),咯血7例(6%),呼吸困难(包括胸闷、气促、气短)53例(45.7%),腹泻17例(14.7%),恶心呕吐7例(6%),胸痛9例(7.8%)。有基础疾病者共61例(52.9%),其中较常见的有高血压33例(28.4%),糖尿病15例(12.9%)。发病日期从2020年1月6日到2月17日,核酸转阴时间12~51d,平均30.79±8.48d,中位时间33d。A组与B组分别有患者37例、79例,两组基线资料比较(见表1),性别、年龄、严重程度分型、合并高血压、合并糖尿病比例两组间无显著差异(P>0.05)。

表1 A、B两组基线资料比较
用广义线性混合模型分析细胞免疫指标的动态演变:共收集来自116例COVID-19患者在不同时间点的细胞免疫检测结果238份,广义线性混合模型分析结果(见表2)。CD3、CD4、CD8、CD19计数组间有显著性差异(P<0.05),动态变化(见图1)所示,各指标P0点均在正常范围,随时间逐渐下降,CD3、CD4、CD8、CD19在P2降至最低,CD3、CD4、CD8平均值明显低于正常值,P3时开始恢复。CD19、CD16+/56+的平均值在全程中均在正常范围内。CD4/CD8各组无显著性差异(P>0.05)。年龄对CD8和CD16+/56+变化有影响,随年龄增高,CD8计数下降,CD16+/56+计数升高。合并糖尿病者CD3、CD4、CD16+/56+计数下降。疾病严重程度分型可以影响CD3、CD4变化。甲强龙使用仅影响CD16+/56+计数,使其计数下降。
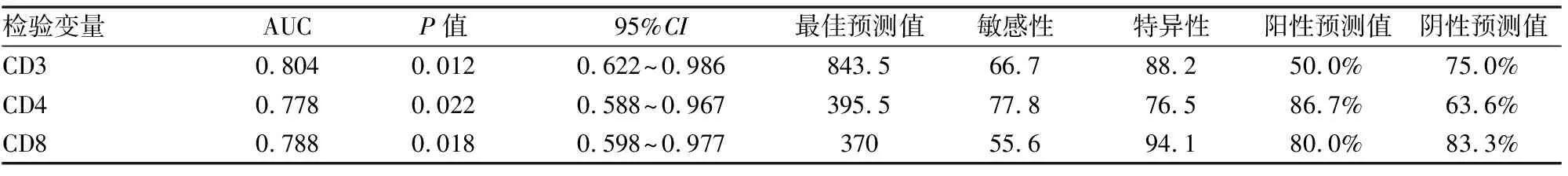
表2 ROC曲线评估免疫指标对核酸转阴时间的预测价值

图1 细胞免疫的动态变化
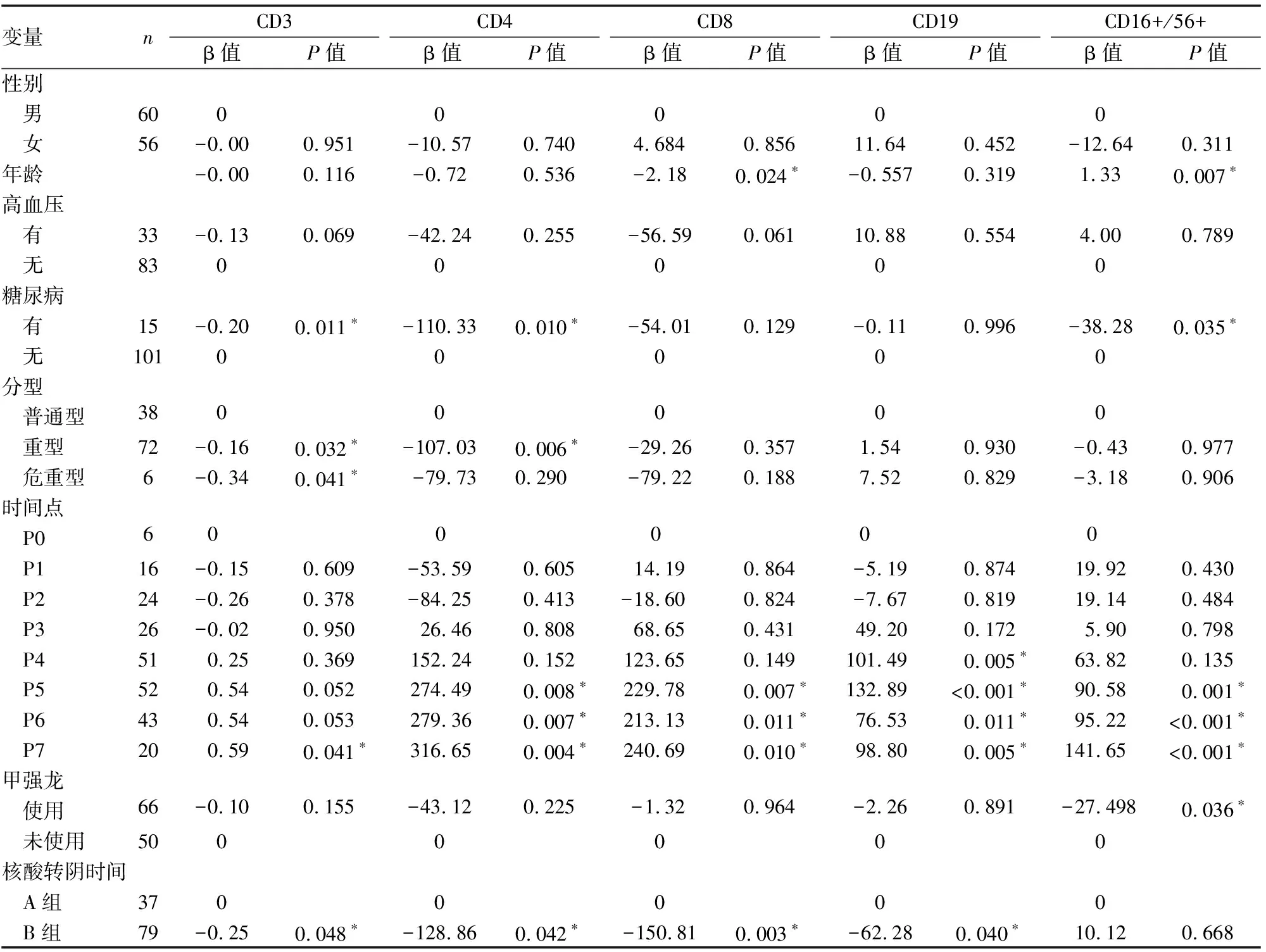
表2 细胞免疫指标动态变化的广义线性混合模型
细胞免疫指标与核酸转阴时间的关系:A组、B组分别有细胞免疫样本60份、178份,其中CD3、CD4、CD8在P3点组间有显著性差异(P<0.05),CD8在P0、P3两点 B组CD8计数分别为165.25±120.39、179.23±143.61,显著低于A组(463.50±119.50、426.68±286.47),明显低于正常范围220~1129,(P<0.05)。发病初期B组CD19较A组更低,尤其在P3点,B组和A组CD19计数分别为141.94±60.24、244.89±183.21(P=0.136),差异无统计学意义可能与病例数少有关(B组17例、A组9例)。细胞免疫在组间与组内差异(见图2)。
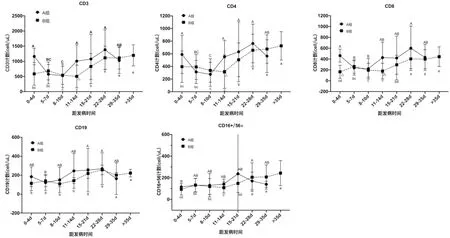
图2 AB组间细胞免疫指标的比较
甲强龙对核酸转阴时间的影响 116例患者,使用糖皮质激素治疗的有66例,未使用的有50例,所有使用糖皮质激素的病例均使用甲强龙,且每日剂量不超过160 mg,总疗程不超过20d。两组的核酸转阴时间分别为33.42±8.509d、33.36±8.268d,两组间无显著性差异(P>0.05)。A组与B组甲强龙使用病例分别为21例(56.8%)、45例(57%),两组无显著差异(P>0.05)(见表1)。
采用ROC曲线评估免疫指标对核酸转阴时间的预测价值 P3点共纳入26例病例,分别以CD3、CD4、CD8为检验变量,以核酸转阴时间分组为状态变量绘制ROC曲线,结果(见表3,图3)。结果显示P3点CD3、CD4、CD8下降可预测核酸转阴时间延长(P<0.05)。

图3 各指标预测核酸转阴时间的ROC曲线
讨 论
COVID-19正在全球范围蔓延,传染性比2003年的严重急性呼吸综合征(severe acute respiratory syndrome, SARS)和2013年的中东呼吸综合征(Middle East respiratory syndrome, MERS)更强[4],严重威胁全球各国人民的生命健康。SARS-CoV-2进入人体,与呼吸道、消化道黏膜上ACE2受体结合,不断复制增殖[5],肺泡巨噬细胞和上皮细胞会释放大量促炎细胞因子和趋化因子,启动机体免疫反应。免疫反应可有效抑制病毒的复制,也可导致细胞因子风暴,引起多脏器功能衰竭,这与机体免疫状态有关。已有研究发现,免疫功能与COVID-19的发生及疾病严重程度的有关[1-2],但之前的研究都只针对患者发病初期的一次检验结果进行分析,而本研究共纳入116例确诊COVID-19患者238份细胞免疫结果,是首次从出现症状到呼吸道分泌物病毒核酸转阴,分8个时间点探究细胞免疫功能的演变过程,为阐明整个病程中机体的免疫状态提供依据。本研究纳入患者核酸转阴时间平均值为30.79±8.48d,比同类研究更长,可能由于入组患者为2020年2月20日至2020年3月15日出院的武汉地区患者,属于武汉疫情终末阶段,大多病程较长。以平均值为截点,将核酸转阴时间分为A组(≤30d)和B组(>30d),分析影响核酸转阴时间的因素。
本研究中细胞免疫主要检测CD3计数、CD4计数、CD8计数、CD19计数及CD16+/56+计数,其中CD3是成熟T淋巴细胞表面的标志;CD4是辅助性T淋巴细胞的标志,可增强巨噬细胞介导的抗感染作用和B细胞介导的体液免疫应答,是SARS-CoV-2感染的肺泡中浸润的主要淋巴细胞[6];CD8是抑制/杀伤T淋巴细胞的标志,是特异性直接杀伤靶细胞的效应T细胞,在对SARS的研究中发现CD8T淋巴细胞可以清除被病毒感染的细胞,且CD8记忆T细胞在体内持续至少6年,远远超过病毒特异性抗体IgG的保护作用[7];CD19是B淋巴细胞表面特有的,可通过调节B细胞的增殖活化介导体液免疫;CD16和CD56代表自然杀伤细胞(NK细胞),是机体抗感染的重要免疫因素。本研究发现发病0~4d细胞免疫指标平均值均在正常范围内,随着疾病发展,CD3、CD4、CD8明显下降,至发病8~10d降至最低点,随后逐渐恢复,至发病22~28d恢复至较高水平。且CD3、CD4、CD8均与核酸转阴时间有关,A组CD3、CD4、CD8最低点均在发病8~10d,而B组在发病8~10d后CD3、CD4、CD8细胞会继续减少,直至发病11~14d后才逐渐恢复。ROC曲线结果显示11~14d CD3、CD4、CD8可预测核酸转阴时间延长,这说明T淋巴细胞的持续减少可能预示着核酸转阴时间的延长。
本研究采用广义线性混合模型分析各时间点细胞免疫指标发现,年龄、糖尿病和疾病严重程度是影响细胞免疫指标的变化的危险因素,尤其对T淋巴细胞影响显著。年龄越高,CD8计数越低。糖尿病患者CD3、CD4计数下降。这可能是老年患者及合并糖尿病患者是新冠肺炎高危人群的原因之一。本研究A组和B组患者年龄及合并糖尿病比例无显著差异,说明核酸转阴时间延长与新冠病毒感染导致T淋巴细胞减少有关。
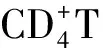
COVID-19患者治疗中糖皮质激素的使用一直存在较大分歧,本研究发现甲强龙使用仅影响CD16+/56+计数,而对CD3、CD4、CD8、CD19无显著影响,说明甲强龙的使用对T淋巴细胞影响较小。同时甲强龙的使用不会影响核酸转阴时间。有学者[11]发现COVID-19并发ARDS的患者中甲强龙的使用可以降低死亡率。把握好适应症、适量使用甲强龙可能改善COVID-19患者预后。
本研究认为SARS-CoV-2感染机体后会导致T淋巴细胞数量减少,动态监测CD3、CD4、CD8的变化可以预测核酸转阴时间,发病14d后CD3、CD4、CD8计数减少可能预示核酸转阴时间延长。但本研究各时间点纳入样本量不均衡,缺乏同一患者动态随访资料,尚需进一步研究SARS-CoV-2与T淋巴细胞的相互作用,阐明COIVD-19的免疫损伤机制,为寻找可能的干预手段,指导COVID-19的临床治疗提供思路。
