XAGE1A与PD-L1在非小细胞肺癌中的表达特点及相关性研究
2021-12-01孙晨汪硕敏夏云红
孙晨 汪硕敏 夏云红
肺癌是全球发病率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)为死亡率最高的病理分型,是威胁人们身心健康的重要肿瘤类公共健康问题[1]。随着医疗水平的提高,以程序性死亡受体/配体1 (programmed death 1/ligand 1, PD-1/L1)[2-4]等为靶点的综合治疗方式一定程度上提高了NSCLC患者的生存质量和时间,但多数患者预后仍然较差[5]。X抗原家族成员1A(X antigen family member 1a, XAGE1A)是癌症/睾丸(Cancer/testis, CT)抗原家族的成员[6-8],其介导的免疫保护作用有利于免疫疗法的实施[9-10]。伴随免疫治疗的快速发展,作用于PD-1/PD-L1的免疫检查点抑制剂成为晚期NSCLC的有效治疗方法[11-12],但国内外关于XAGE1A与PD-L1在NSCLC患者中的表达特征及相关性研究尚未有报道,因此探讨XAGE1A与PD-L1的关系,寻找NSCLC诊疗的潜在分子标志物具有重要意义。
资料与方法
一、样本来源
选择安徽医科大学第四附属医院肿瘤科2017年01月至2020年01月的NSCLC患者75例,纳入标准:①纳入研究的患者经病理切片诊断均证实为NSCLC;②患者为初诊病例,术前均未接受放化疗、靶向治疗或免疫治疗等其它治疗;③患者一般资料完整,且入组前均已签署知情同意书;④患者在手术治疗后均可配合门诊或电话随访。根据患者入院早晚随访时间为5~36月不等,中位随访时间为24个月。患者临床资料如下:患者年龄57.31±6.45岁;女性35例(46.67%),男性40例(53.33%);脉管侵犯56例(74.67%),无脉管侵犯19例(25.33%);低分化21例(28%),中高分化54例(72%);TNM分期Ⅰ~Ⅱ期52例(69.33%),Ⅲ~Ⅳ期23例(30.67%);伴有淋巴结转移者15例(20%);肿瘤直径以5 cm为界,大于5 cm共40例(53.33%),小于5 cm 共35例(46.67%);有远处转移者8例(10.37%),无远处转移者67例(89.33%);选取75例NSCLC患者病理标本中,取距肿瘤组织≥5 cm的非肿瘤组织作为癌旁组织,癌旁组织经病理组织学检查均未发现癌细胞。
二、主要试剂
DAB显色试剂盒(36303ES01)和免疫组化试剂盒(36312ES75)均购自上海翊圣生物科技有限公司,兔抗人XAGE1A多克隆抗体(PRO-1256)购自艾美捷科技公司,PCR逆转录试剂盒(RR047A)和荧光定量PCR试剂盒(RR820A)均购自大连TAKARA公司,RNA裂解液(TRIzol)购自美国Invitrogen公司等。
三、RT-qPCR
取50~100 mg组织样本加RNA裂解液1 mL,摇匀消化3~5 min后加入氯仿约200 μL在4℃ 12000 g离心15 min。上清液混入0.5 mL异丙醇, 4℃ 12000 g离心10 min,无酶水溶解后测RNA浓度。根据Takara试剂盒进行反应体系的配置,去除基因组DNA反应为42℃、2 min,反转录反应为37℃、15 min转85℃、5 s。反转录样本行qPCR反应体系配置,按预变性95℃、30 s,扩增40个循环,条件设置为95℃、5 s转 60℃、30 s。XAGE1A forward primer, 5′-CCCAGGAGCCCAGTAATGGAGAG-3′; XAGE1A reverse primer, 5′-TCTGTCTGCTGCCC AGGTGTAG-3′; PD-L1 forward primer, 5′-GCTGCAC TAATTGTCTATTGGG-3′; PD-L1 reverse primer, 5′-CA CAGTAATTCGCTTGTAGTCG-3′; GAPDH forward primer, 5′-GTATCGTGGAAGGACTCATGAC-3′; GAPDH reverse primer, 5′-ACCACCTTCTTGATGTCATCAT-3′。
四、免疫组织化学染色
取75例NSCLC患者手术切除样本,经包埋后制成石蜡块,并用切片机切成4 μm厚的薄片。采用免疫组化(SP法)测定NSCLC肿瘤组织、癌旁组织及淋巴结(距离肿瘤组织5 cm以上)标本中XAGE1A蛋白表达。简要操作如下:切片二甲苯-梯度酒精脱蜡至水,洗净和抗原修复后,加入双氧水阻断过氧化物酶,封闭15 min,再用Ultra V Block封闭背景,洗净后加入XAGE1A抗体(1 ∶100 稀释)孵育过夜,继以一抗增强剂和二抗孵育,DAB显色。显微镜下见黄褐色斑时加入ddH2O充分冲洗停止显色,苏木素复染,脱水,透明,封片,烘干后镜下观察。
五、结果判断
按照既往报道,XAGE1A为癌症/睾丸抗原家族成员,故将胞质内出现淡黄色至棕黄色染色颗粒的细胞视为阳性。XAGE1A蛋白表达水平定性分析根据细胞染色强度和染色细胞所占面积的乘积计算。染色面积:阳性范围≤10%计1分,10%~50%计2分,50%~80%计3分,80%以上计4分。染色强度:无阳性染色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。上述免疫组化评分,由2名病理科医师采取双盲方式进行,并综合结果进行评判。
六、统计学分析
使用SPSS 25.0 软件进行分析。RT-qPCR中肿瘤组织与癌旁组织的XAGE1A或PD-L1相对表达量输入SPSS 25.0软件数据库,计量资料表示为均值±标准差,均为双侧检测,数据经对数转换后,经正态性检验数据呈正态分布,采用t检验分析;XAGE1A与临床病理特点关系采用卡方检验,生存分析采用Kaplan-Meier 法并经Log-Rank 检验,肿瘤组织与癌旁组织的XAGE1A与PD-L1免疫组化评分使用Kruskal-Wallis秩和检验;XAGE1A与PD-L1表达量关系使用pearson相关性分析。P<0.05 认为差异有统计学意义。
结 果
一、XAGE1A mRNA在NSCLC肿瘤(tumor)组织和癌旁(para-tumor)组织中的表达
获取75例NSCLC患者肿瘤与癌旁组织检测XAGE1A表达水平并进行配对比较,RT-qPCR结果显示,XAGE1A mRNA在NSCLC组织中平均表达水平高于癌旁组织(见图1a)。
二、XAGE1A 与PD-L1 mRNA在NSCLC组织中的表达关系
对75例NSCLC患者的肿瘤组织进行XAGE1A 与PD-L1 mRNA检测,RT-qPCR结果显示,XAGE1A 与PD-L1mRNA表达水平存在正相关关系,相关系数R=0.2647(见图1b)。
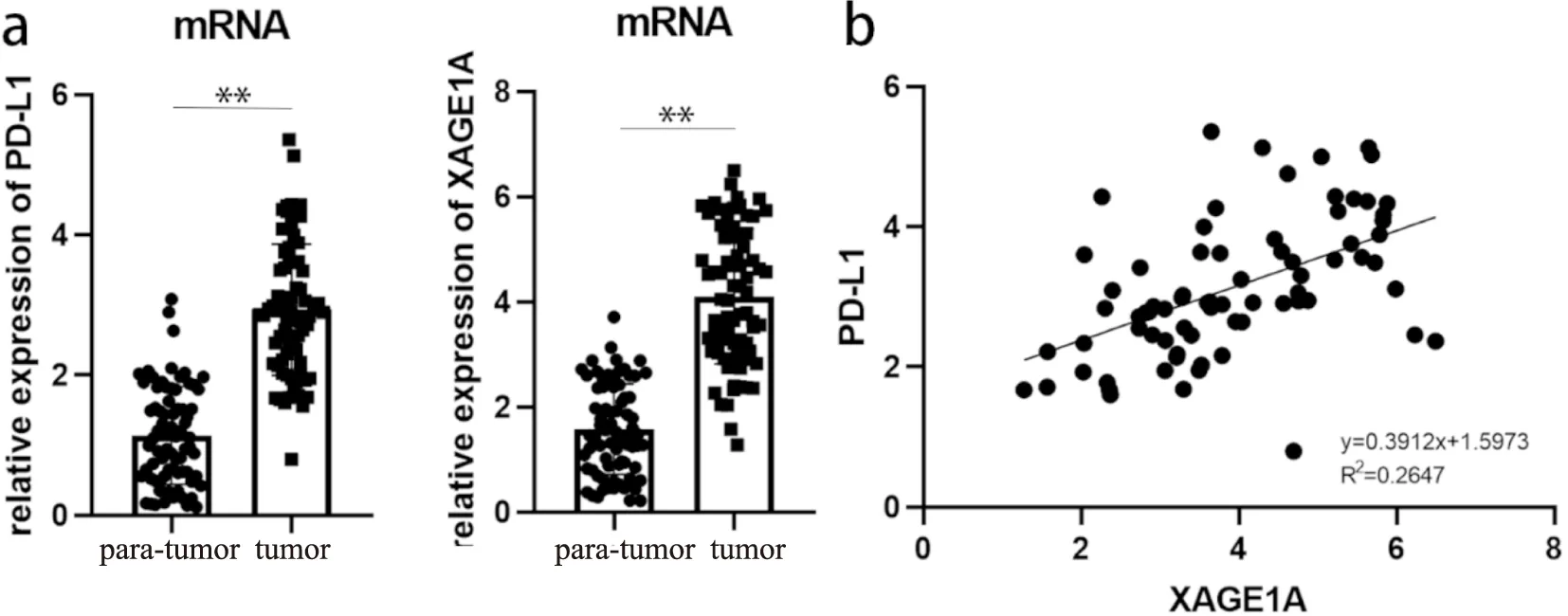
图1 XAGE1A和PD-L1在NSCLC不同类别组织中的mRNA表达及相关性。a: 分别为XAGE1A和PD-L1在癌旁组织与肿瘤组织中的mRNA表达;b: 为75例患者肿瘤组织中XAGE1A和PD-L1表达相关性。注:**P<0.01
三、NSCLC肿瘤及其癌旁组织中XAGE1A和PDL1蛋白表达情况
免疫组化结果显示,XAGE1A 蛋白在肿瘤组织、癌旁组织中均定位于细胞核,阴性表达不着色,阳性表达呈淡黄、棕黄至棕褐色(见图2a、b);此外,XAGE1A蛋白在PD-L1(-)组织中细胞核基本不着色,多为低表达,PD-L1(+~)组织中细胞核出现棕黄至棕褐色颗粒,表达为阳性(见图2c、d)。NSCLC组织中XAGE1A 蛋白总阳性数为64例(85.3%)高于癌旁组织22例(29.3%)(P<0.001);XAGE1A 蛋白在PD-L1阴性表达的NSCLC肿瘤组织中总阳性数为18例(66.7%),低于PD-L1阳性表达的NSCLC肿瘤组织的46例(95.8%)(P<0.001)(见表1,2)。

表1 XAGE1A在NSCLC不同类型组织中的蛋白表达

表2 XAGE1A与PD-L1在配对肿瘤组织中的蛋白表达
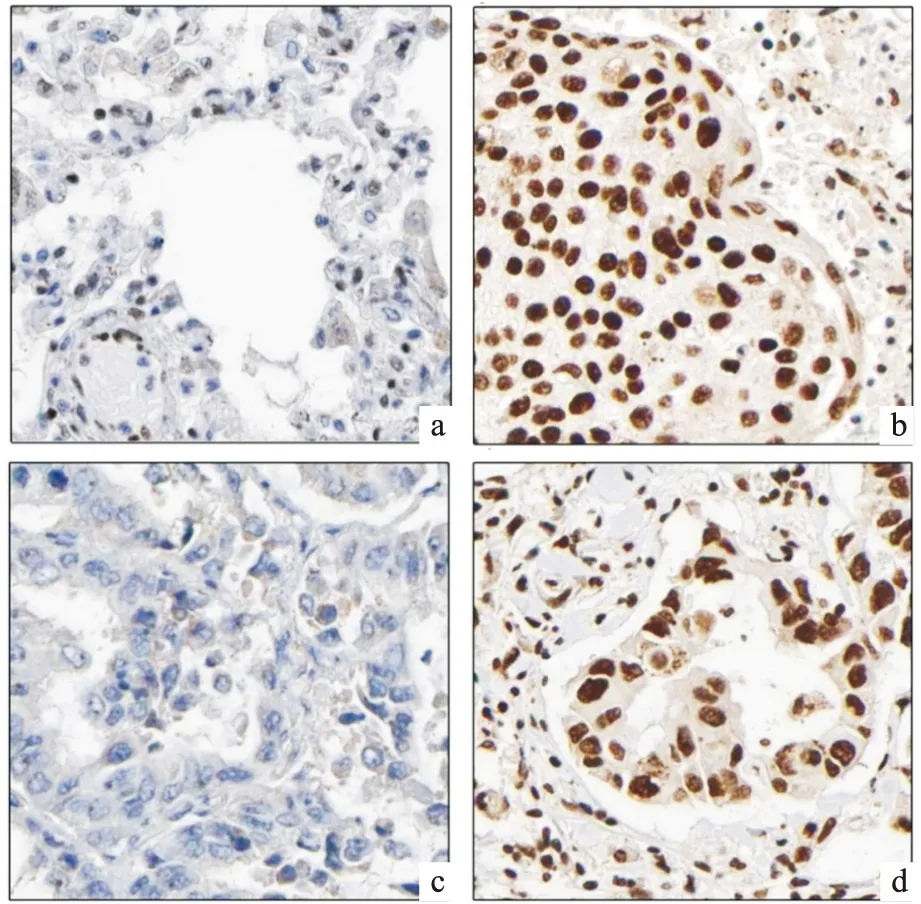
图2 XAGE1A在NSCLC不同类别组织中的蛋白表达 a为癌旁组织,XAGE1A无明显表达,b为NSCLC肿瘤组织,XAGE1A在结肠癌细胞胞核中呈强阳性表达,c为PD-L1(-)的肿瘤组织,XAGE1A无明显表达,d为PD-L1(+)的肿瘤组织,XAGE1A在部分腺体肿瘤细胞胞核中呈强阳性表达(放大倍数均为400×)。
四、XAGE1A 蛋白与NSCLC临床病理特点的关系
XAGE1A蛋白表达与患者的TNM 分期、分化程度、吸烟史和远处转移有关,其中TNM Ⅲ~Ⅳ期、低分化、有吸烟史、远处转移患者XAGE1A蛋白阳性率高于所对应项目的非上述分类阳性率(P<0.05);而XAGE1A蛋白表达与年龄、性别、淋巴结转移以及病理类型无关(P>0.05)。PD-L1蛋白表达水平与NSCLC临床病理特点的关系与XAGE1A蛋白表达情况相同,也与患者的TNM 分期、分化程度、吸烟史和远处转移有关(P<0.05)(见表3)。
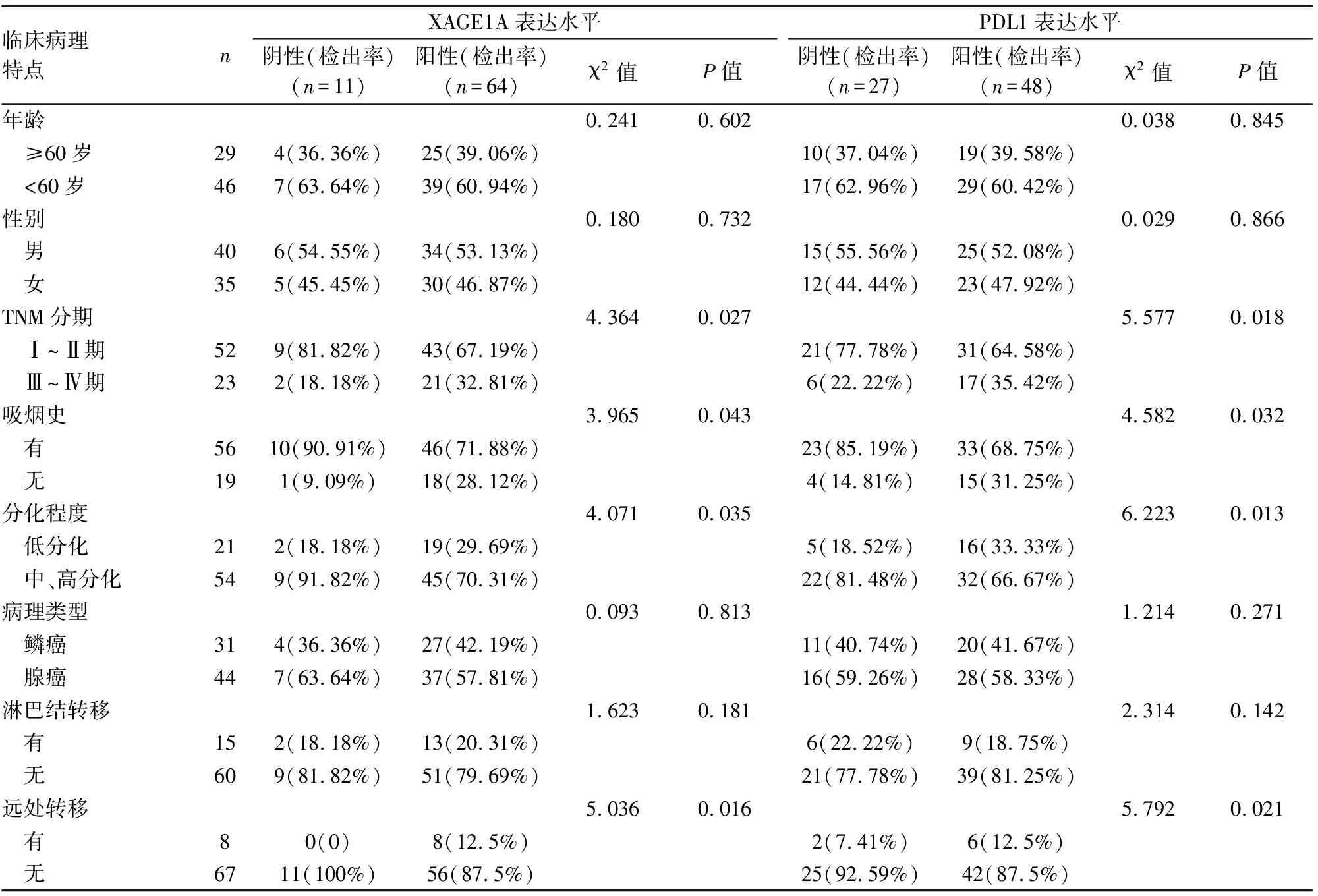
表3 XAGE1A蛋白与NSCLC临床病理特点的关系
五、NSCLC组织中XAGE1A 蛋白表达与预后的关系
纳入研究的75名NSCLC患者的3年总生存率为21.78%(95%CI: 2.12~4.25%),XAGE1A 阳性表达患者的3年生存率为26.35%(95%CI: 2.11~4.09%),XAGE1A阴性表达患者的3年生存率为8.27%(95%CI: 2.44~4.87%),XAGE1A 阴性表达患者的生存时间低于XAGE1A 阳性表达患者(P=0.0264)。随访3年中,两组患者的生存曲线(见图3),XAGE1A 阳性患者生存率明显高于阴性患者,且XAGE1A 阳性表达患者生存期明显长于阴性表达者,表明XAGE1A的表达水平可作为NSCLC患者的重要预后监测指标(见图3)。
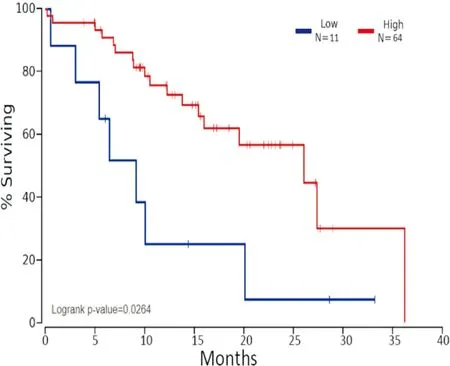
图3 XAGE1A阳性(High)和阴性(Low)表达患者的生存曲线
讨 论
肺癌是全球癌症死亡的主要原因。非小细胞肺癌是肺癌主要类型,其包括多种组织学亚型,包括腺癌、支气管肺泡癌、鳞癌、间变性和大细胞癌[13]。尽管过去几十年来在肺癌治疗方面取得了技术上的进步,但诊断后的五年总生存率仍为20%。以PD-L1为靶点的免疫治疗是近二十年来肺癌领域发展最快的治疗方法之一,其有效延长了患者OS,但不适用于少数PD-L1低表达、耐药患者,因此探索免疫治疗合适的协同诊疗靶标是提高免疫治疗疗效的重要问题。XAGE1A作为癌症/睾丸抗原(CTAs)基因家族成员,在多种肿瘤中存在表达,例如尤因氏肉瘤、黑素细胞瘤、前列腺癌、肺癌、乳腺癌、卵巢癌、胃癌、肺泡横纹肌肉瘤和某些上皮肿瘤中[9, 11, 14-15]。XAGE1A位于X染色体上,其在某些癌症患者中还观察到了针对XAGE1A的血清反应性[16],这表明XAGE1具有免疫原性。XAGE1高表达诱导的CD4和CD8 T细胞反应,促使患者产生体液免疫和细胞免疫[17],故有学者指出XAGE1有望作为靶向免疫治疗的潜在标志物和作用靶点用于NSCLC和前列腺癌的治疗当中。目前关于XAGE1相关研究国内外多集中在转录本XAGE1B上,周清等[18]发现30例肺癌组织中,XAGE1B基因表达阳性率为40%(12/30),而30例癌旁正常肺组织不表达该基因;腺癌中基因表达阳性率明显高于其他病理类型(61.1%vs 8.3%,P=0.015),可优先选择该基因作为肺腺癌免疫治疗靶点。周清等[19]发现非小细胞肺癌中VEGFR-2与XAGE1B基因表达呈正相关,XAGE1B表达阳性并且VEGFR-2高表达的患者可能是免疫疗法与抗血管生成疗法联合治疗的合适人群。但国内关于XAGE1A在NSCLC患者样本中表达水平及其与PD-L1表达关系尚未有文献报道。
本文通过对院内2017年到2020年75例NSCLC患者进行研究,发现NSCLC肿瘤组织相较癌旁组织中XAGE1A与PD-L1 mRNA与蛋白表达率均升高,且二者表达存在正相关性。XAGE1A和XAGE1D蛋白分别由81和69个氨基酸组成,它们共有相同的氨基酸末端,最高至32个氨基酸。一些报道表明[20],来自肺癌患者的血清与XAGE1A反应,提示XAGE1即含有核定位信号,也存在于细胞外空间。本研究经免疫组织化学染色法,发现NSCLC组织中XAGE1A 蛋白总阳性数为64例(85.3%)高于癌旁组织22例(29.3%);XAGE1A 蛋白在PDL1阴性表达的NSCLC肿瘤组织中总阳性数为18例(66.7%),低于PDL1阳性表达的NSCLC肿瘤组织的46例(95.8%)。通过病理特征分析,发现XAGE1A与PD-L1蛋白在TNM Ⅲ~Ⅳ期、低分化、有吸烟史、远处转移的患者中阳性表达率更高,但与年龄、性别、淋巴结转移以及病理类型无显著关系。已有研究证明,XAGE1可增强肿瘤细胞对肿瘤抗原的加工和呈递过程,增加MHC-I分子的产生水平,从而直接激活肿瘤特异性T细胞应答[21];通过构建过表达XAGE1基因的小鼠肿瘤模型,Xie等[22]发现IFN-γ分泌增加、IL-6分泌减少,树突状细胞增加且特异性T细胞免疫活性增强,上述表现可能是NSCLC中XAGE1A高表达促进患者自身免疫激活的原因之一。进一步生存分析结果则提示XAGE1A 在NSCLC肿瘤组织阳性表达患者的生存时间高于XAGE1A 阴性表达患者。鉴于XAGE1A与PD-L1存在显著相关性,本研究结果有利于指导XAGE1A作为PD-L1治疗的判断标准和协同治疗的靶标之一,有望用于NSCLC治疗。
综上所述, XAGE1A与PD-L1在NSCLC肿瘤组织表达均升高,但与NSCLC病理类型无显著关系,XAGE1A阳性率与PD-L1阳性率呈正相关。XAGE1A 呈高表达患者的生存时间越长,提示XAGE1A 对NSCLC可能存在保护作用,有望成为NSCLC的免疫治疗潜在分子靶点。
