利用 Fhb1基因分子标记辅助回交育种法改良黄淮冬小麦赤霉病抗性
2021-12-01代旭冉黄义文买春艳于立强于广军李辉利刘宏伟张宏军李洪杰
代旭冉,黄义文,李 腾,邓 云,苏 研,买春艳,于立强,于广军,李辉利,刘宏伟,杨 丽,周 阳,张宏军,李洪杰
(1.河北科技师范学院,农学与生物技术学院,河北秦皇岛 066004;2.中国农业科学院作物科学研究所/作物分子育种工程实验室,北京 100081;3.福建省南平市农业科学研究所,福建建阳 354200;4.新乡矮败小麦育种技术创新中心,河南新乡453731;5.石家庄市农林科学研究院赵县试验基地,河北赵县 051530)
赤霉病(Fusarium head blight,FHB)主要是由禾谷镰孢菌[GibberellazeaeSchw.(Petch)]引起的一种严重影响禾谷类作物产量和品质的毁灭性病害[1]。据统计,1993-2001年,赤霉病给美国小麦(TriticumaestivumL.)和大麦(HordeumvulgareL.)生产造成的直接经济损失高达76.7亿美元[2]。此外,赤霉病病菌产生脱氧雪腐镰刀菌烯醇(DON)等毒素,食用被DON污染的籽粒后会严重危害人类和牲畜的健康[3-4]。赤霉病一直以来是限制我国南方麦区小麦生产的主要病害,尤其在长江中下游地区[5]。近年来由于耕作制度和气候的变化,赤霉病已经向北方麦区扩展,目前已成为黄淮冬麦区的主要病害之一,如2012年仅河南省发病面积就超过339.69万hm2[6]。因此,快速提高小麦品种的赤霉病抗性已经成为黄淮冬麦区最重要的育种目标之一。
赤霉病抗性是受多基因控制的复杂数量性状。在小麦中已经定位到250多个与赤霉病抗性相关的QTL[7-8]。其中,Fhb1被认为是抗扩展效应最大、抗性最稳定的位点,在不同定位群体中可解释20%~50%的表型变异[7,9-10]。目前,Fhb1的候选基因TaHRC已经被克隆并已开发了功能标记,这为利用该基因的分子标记进行辅助选择提供了便利[11]。世界上很多国家利用Fhb1分子标记辅助选择技术开展小麦抗赤霉病育种,并取得了显著进展[12-15]。据报道,将Fhb1基因导入美国硬红春小麦,已经培育出一系列抗赤霉病品种并商业化推广[16-17]。Xie等[12]将来自苏麦3号的Fhb1导入到5个澳大利亚小麦品种,发现携带Fhb1的后代发病严重度降低了42%~53%。Randhawa等[13]通过把Fhb1、Fhb2、Fhb4和Fhb5基因导入加拿大感病品种,成功培育出抗病品种Waskada、Carberry和Cardale,并已投入商业化生产。
Fhb1基因主要分布在东亚地区,特别是中国南方和日本[11],推测我国长江中下游麦区小麦品种Fhb1感病等位基因发生突变是其抗病等位基因的起源[18]。抗赤霉病育种一直是长江中下游麦区的主要育种目标,这一麦区生产上大面积种植的品种对赤霉病均具有较好的抗性[19-20]。历史上赤霉病在我国黄淮冬麦区发病很轻,很少引起育种家重视,导致目前该麦区生产上种植的绝大部分品种都高感赤霉病。由于生态类型的差异,南方麦区抗赤霉病的春性品种很难直接应用于黄淮冬麦区,也很难通过单交的方式直接选育出适合该麦区种植的品种。黄淮冬麦区开展抗赤霉病育种的另一个困难是年际间赤霉病发病严重程度变化很大,在不发病或发病很轻的年份,很难进行田间抗病性选择。
目前黄淮冬麦区抗赤霉病育种在材料和技术方面缺乏必要的积累,因此,提高品种抗性由高感到中感水平是黄淮冬麦区抗赤霉病育种的重要一步。本课题组前期通过尝试有限回交的方法,利用Fhb1功能标记将来自长江中下游麦区抗赤霉病品种的Fhb1基因导入黄淮冬麦区小麦品种周麦16中,发现回交一代的赤霉病抗性比周麦16显著提高[21]。随后,利用周麦16衍生系轮选136和轮选13进行第二轮回交,发现轮选136遗传背景下BC2F2群体赤霉病抗性水平明显优于轮选13背景[22]。在此基础上,本研究对轮选136背景下6个BC2F3群体161个纯合Fhb1-R株系进行三个环境下的赤霉病抗性表型评价,进而对入选的BC2F4品系进一步评价,明确Fhb1在轮选136背景下对赤霉病抗性的影响,以期为黄淮冬麦区赤霉病抗性分子育种提供技术支撑和育种材料。
1 材料与方法
1.1 试验材料
利用周麦16矮败小麦近等基因系(简称矮败周麦16)分别与6个赤霉病抗性达到中抗以上水平且携带Fhb1基因的供体(苏麦3号、宁麦9号、宁麦13、建阳84-1、建阳84-2和建阳798-2)杂交,获得F1,F1与周麦16回交,然后将携带Fhb1基因的BC1F1植株与周麦16衍生系轮选136进行第二次回交,获得6个BC2F1群体,然后自交产生6个BC2F2回交群体,即群体1(矮败周麦16/苏麦3号//周麦16/3/轮选136)、群体2(矮败周麦16/宁麦9号//周麦16/3/轮选136)、群体3(矮败周麦16/宁麦13//周麦16/3/轮选136)、群体4(矮败周麦16/建阳84-1//周麦16/3/轮选136)、群体5(矮败周麦16/建阳84-2/周麦16/3/轮选136)和群体6(矮败周麦16/建阳798-2//周麦16/3/轮选136)。在BC2F3群体中,通过对Fhb1不同等位基因检测,将携带纯合Fhb1抗性等位基因(Fhb1-R)的BC2F3株系在三个环境(2019年福建南平、河南新乡和北京)下进行赤霉病抗性评价。2020年将入选的BC2F4品系继续在河南新乡进行赤霉病抗性接种鉴定。苏麦3号、扬麦158、淮麦20和周麦16分别作为赤霉病抗性鉴定的高抗、中抗、中感和高感对照。
1.2 基因型分析
随机剪取每个BC2F2单株的新鲜叶片,利用快捷型植物基因组DNA提取系统(北京天根生物技术有限公司)提取基因组DNA;采用相同方法,每个BC2F4品系随机剪取10个新鲜叶片,混合后提取基因组DNA。应用STS功能标记TaHRC-GSM(TaHRC-GSM-F:5′-ATTCCTAC TAGCCGCCTGGT-3′;TaHRC-GSM-R:5′-ACT GGGGCAAGCAAACATTG-3′)检测BC2F2单株Fhb1的等位基因[23]。PCR扩增体系和扩增结果检测参考Li等[22]的方法。利用KASP标记GBS20328检测轮选136和BC2F4品系中是否存在郑麦9023赤霉病抗性位点Qfhb.7D。KASP标记GBS20328引物序列、PCR反应体系和扩增程序参照Zhang等[24]的方法。
1.3 赤霉病抗性评价
2019年,在福建省南平市农业科学院试验基地(27°33′N,118°12′E)进行赤霉病田间自然发病抗性鉴定。于小麦开花后25 d调查病小穗数和总小穗数,每个材料每个重复调查10个穗子[22]。严重度计算采用下面公式:严重度(%)=病小穗数/总小穗×100%[25]。2019年和2020年在河南省中国农业科学院新乡试验基地(35°31′N,113°85′E)以及2019年在北京中国农业科学院作物科学研究所温室(39°91′N,116°27′E)采用单花滴注法进行人工接种鉴定。孢子液制备参考Bai等[26]的方法,在开花初期,用联动移液器将10 μL(约 1 000个孢子)禾谷镰孢菌分生孢子悬浮液注入中间小穗,接种麦穗套袋保湿48 h,然后去掉袋子,用弥雾装置定时喷水保湿至接种后15 d。接种21 d后,调查病小穗数并计算严重度[19]。
试验采用完全随机区组设计,设2次重复。2019年南平和2019年新乡两个环境采用田间种植,1 m行长,行距30 cm,每行播种20粒种子;2019年新乡环境采用温室花盆种植,每盆(直径25 cm)种15粒种子,出苗后保证每盆10株苗,每个材料种2盆。2020年新乡环境BC2F4品系种植方式同2019年新乡环境。
1.4 数据分析
使用Microsoft Excel 2019数据分析工具进行描述性统计。利用IBM SPSS Statistics 22软件通过LSD方法进行多重比较分析(P<0.05)。
2 结果与分析
2.1 BC2F2群体 Fhb1等位基因检测结果
利用STS功能标记TaHRC-GSM对BC2F26个群体的Fhb1等位基因进行检测,部分后代单株的检测结果如图1所示。在BC2F2群体1(158株)、群体2(161株)、群体3(152株)、群体4(43株)、群体5(181株)和群体6(177株)中,分别有29株、40株、42株、19株、60株和43株携带纯合Fhb1抗病等位基因(Fhb1-R)。淘汰农艺性状表现较差的单株后,BC2F2群体1、群体2、群体3、群体4、群体5、群体6分获得纯合Fhb1-R基因型27株、17株、24株、19株、41株和33株,衍生后代将用于赤霉病抗性评价。
2.2 BC2F3群体赤霉病抗性表现
从表1和表2可以看出,部分对照品种间的病小穗数和严重度在每个环境下均存在显著差异(表1和2)。在南平和北京环境下,苏麦3号和扬麦158的病小穗数和严重度均显著低于淮麦20和周麦16(P<0.05)。与周麦16比较,淮麦20表现出较好的赤霉病抗性,在南平、新乡和北京三个环境下病小穗数比周麦16分别少7.5个、5.4个和8.8个;平均严重度分别降低8.8%、23.3%和36.1%,差异均显著(P<0.05)。从对照品种赤霉病抗性表现看,各环境下发病充分,适合进行赤霉病抗性表型评价。
6个BC2F3群体在南平、新乡和北京三个环境的赤霉病抗性表现见表1和表2。三个环境下来自6个群体161个纯合Fhb1-R株系的总平均病小穗数比周麦16分别减少8.1个、6.1个和9.6个,比淮麦20分别减少0.6个、0.7个和0.8个,比轮选136分别减少0.2个、1.0个和1.4个;总平均严重度比周麦16分别降低15.1%、26.1%和42.1%,比淮麦20分别降低6.3%、2.8%和6.0%,比轮选136分别降低2.6%、4.8%和5.8%。轮选136与淮麦20之间的病小穗数和严重度差异均不显著。

表2 2019年三个环境6个BC2F3群体的赤霉病严重度比较Table 2 Comparison of FHB severity of the six BC2F3 populations under three environments in 2019 %
来自不同供体的部分回交群体的病小穗数和严重度存在显著差异(表1和2)。南平环境下不同群体间的病小穗数无显著差异,但南平环境下部分群体间的严重度以及新乡和北京环境下部分群体间的病小穗数和严重度均差异显著。总的来说,建阳84-2的回交后代(群体5)赤霉病抗性表现较好,抗性较为稳定。
2.3 赤霉病抗性优于淮麦20的BC2F3株系
单个环境下,每个BC2F3群体中病小穗数和严重度均低于淮麦20的株系个数不同(表3)。在南平环境下,6个群体中共有70个株系 (43.5%)的赤霉病抗性优于淮麦20,分布频率为30.3%~58.8%;新乡环境下共有121个株系(75.2%)的赤霉病抗性优于淮麦20,分布频率为51.9%~89.5%;北京环境下,同样有121个株系(75.2%)的赤霉病抗性优于淮麦20,分布频率为58.3%~90.9%。
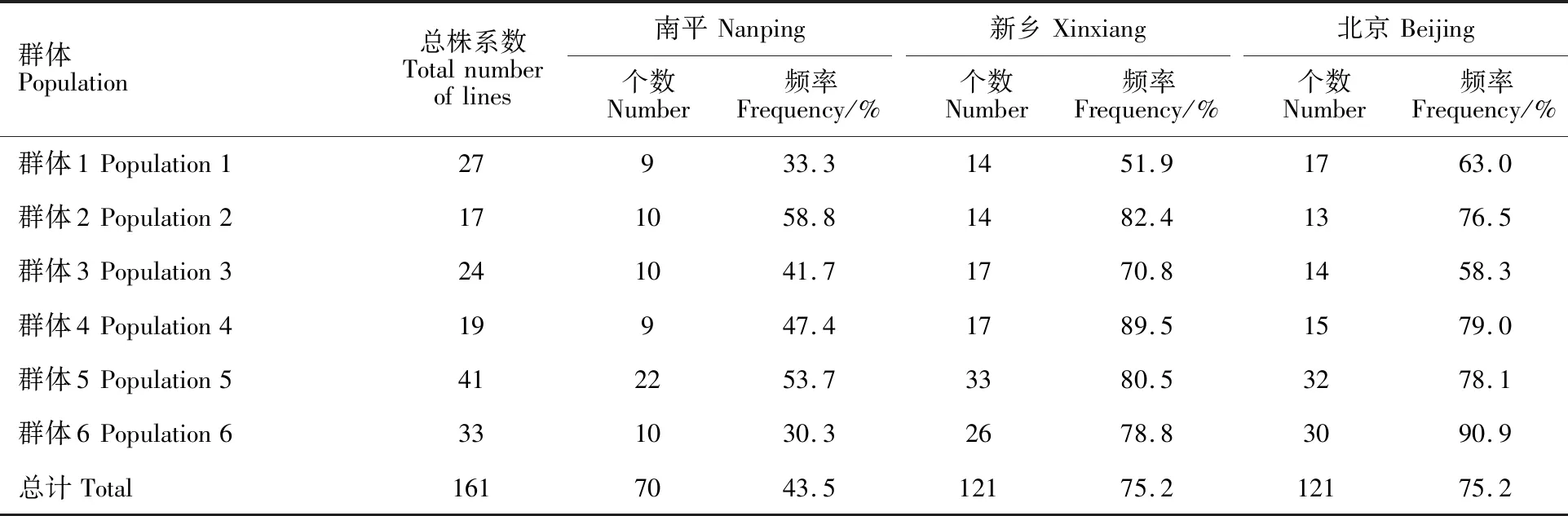
表3 2019年单个环境下赤霉病抗性优于淮麦20的BC2F3株系数和频率统计Table 3 Number and frequency of BC2F3 lines with FHB resistance superior to Huaimai 20 under single environment in 2019
有60个BC2F3株系(37.3%)在三个环境下抗性均低于淮麦20,且表现一致,因此,选择这些抗性表现稳定的株系进行进一步研究。在南平、新乡和北京三个环境下,相比淮麦20,6个BC2F3群体的总平均病小穗数分别降低 2.2、1.8和2.1个(P<0.05),平均严重度分别降低11.8%、8.1%和12.7%(P<0.05)(表4)。
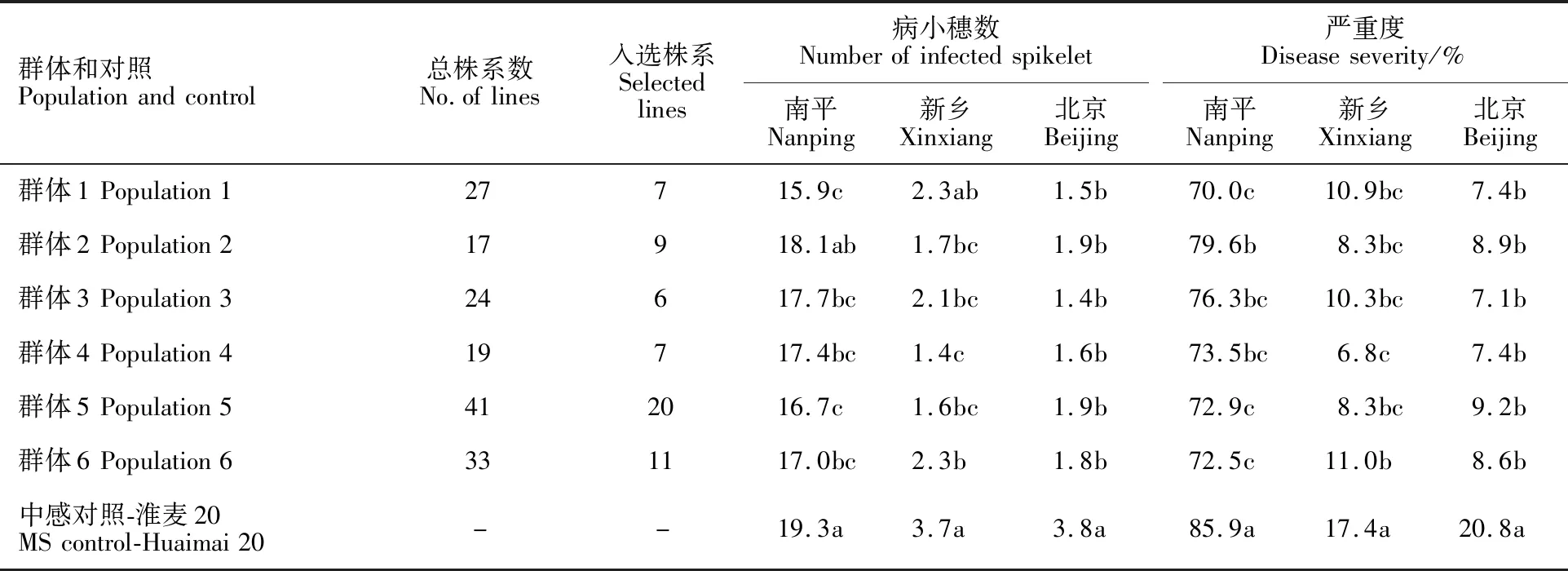
表4 三个环境下赤霉病抗性一致优于淮麦20的BC2F3株系表现Table 4 Performances of the selected BC2F3 lines with FHB resistance superior to Huaimai 20 under three environments
2.4 苗头品系筛选
2020年在新乡继续对入选的60个BC2F3株系的122个BC2F4品系进行赤霉病抗性表型评价(表5),其中93个品系(76.2%)赤霉病抗性优于淮麦20,36个品系(29.5%)赤霉病抗性达到中抗对照扬麦158的水平。
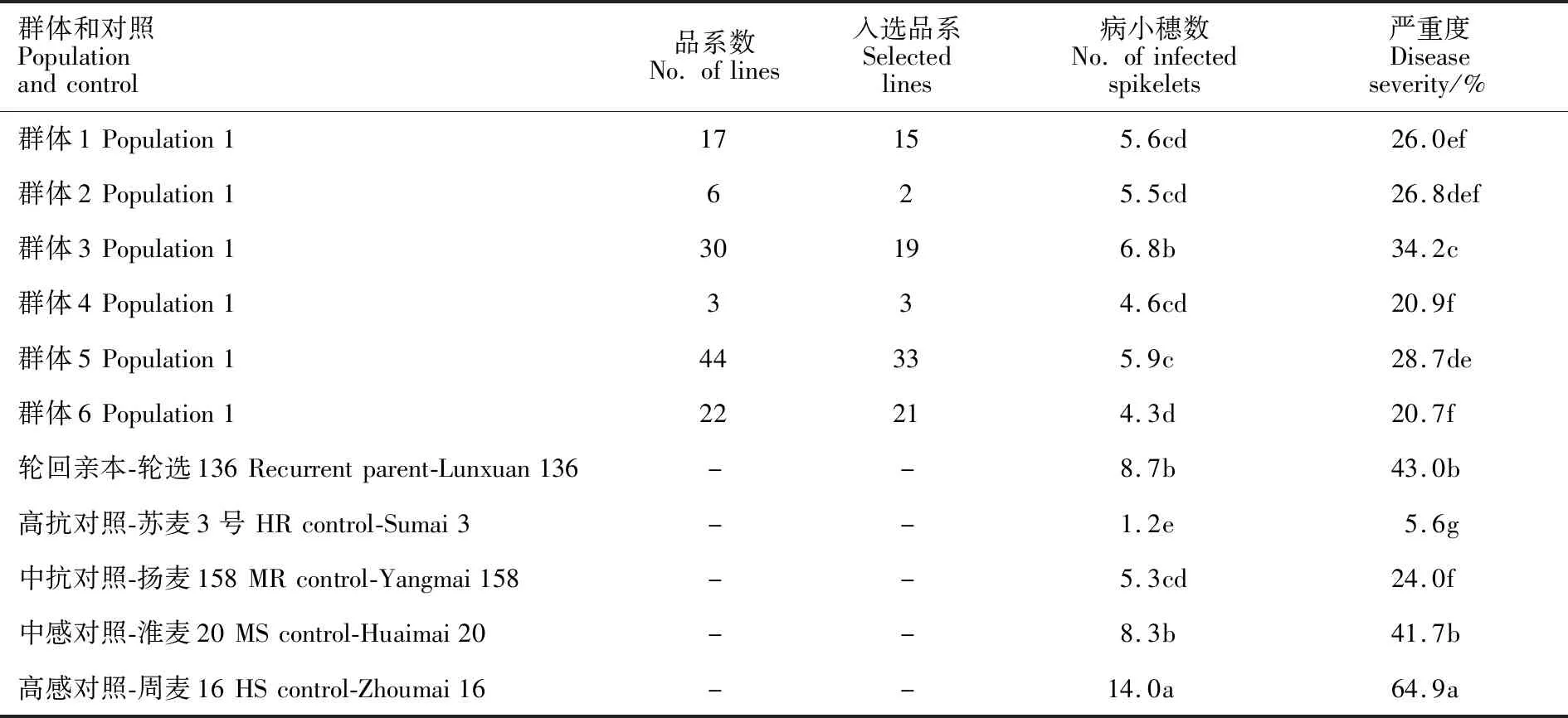
表5 赤霉病抗性优于淮麦20的BC2F4品系赤霉病抗性表现(2020,新乡)Table 5 Performances of selected BC2F4 lines with FHB resistance superior to Huaimai 20(2020,Xinxiang)
93个赤霉病抗性优于淮麦20的BC2F4品系平均病小穗数为5.5个,平均严重度为26.2%,比淮麦20分别降低2.8个和15.5%(P<0.05)。图2为部分抗赤霉病品系单花滴柱接种后的表型。利用郑麦9023抗性位点Qfhb.7D连锁KASP标记GBS20328分析发现,轮回亲本轮选136和93个BC2F4品系均携带该QTL。这些品系已经安排产量比较试验,用于培育抗赤霉病新品种。

A:苏麦3号;B:扬麦158;C:淮麦20;D:周麦16;E:抗赤霉病品系RS1612-6-8-2;F:抗赤霉病品系RS1610-26-3-4。A:Sumai 3;B:Yangmai 158;C:Huaimai 20;D:Zhoumai 16;E:Fusarium head blight-resistant line RS1612-6-8-2;F:Fusarium head blight-resistant line RS1610-26-3-4.图2 单花滴注接种抗赤霉病株系的表型Fig.2 Performance of lines with the resistance to Fusarium head blight using the floret inoculation method
3 讨 论
快速培育适合黄淮冬麦区生态类型的抗赤霉病小麦品种是小麦生产亟待解决的问题。黄淮冬麦区不同年份赤霉病发病程度差异较大,在自然发病条件下,尤其是在发病较轻的年份,很难在田间准确评价赤霉病抗性[15],这也是制约黄淮冬麦区抗赤霉病育种的一个关键问题。因此,利用分子标记辅助选择技术开展抗赤霉病育种显得尤为重要。本研究利用Fhb1功能标记辅助选择技术,结合骨干亲本矮败小麦近等基因系大群体有限回交,快速把长江中下游麦区的Fhb1抗性等位基因导入黄淮冬麦区品种,培育出多个赤霉病抗性较好、农艺性状优良的新品系。这些结果说明,利用有限回交和分子标记辅助选择技术相结合的策略,不仅能提高抗赤霉病育种效率,还可以缩短育种周期,快速培育出适合黄淮冬麦区种植的抗赤霉病品种。
过去育种上利用与Fhb1基因连锁的SSR标记(Gwm533、Gwm493)和STS标记(Umn10)将Fhb1抗性等位基因导入感病材料来提高赤霉病抗性[9,12-14,27]。但这些连锁标记具有一定的假阳性,为解决这个问题,Su等[23]根据候选基因TaHRC的缺失突变,开发了可用于育种后代大规模筛选的Fhb1基因功能标记。本研究利用这个功能标记对回交后代进行目标基因的跟踪检测,提高了抗病基因型选择的准确性。
本研究发现,Fhb1基因可以有效提高赤霉病抗性,但并不是所有Fhb1-R株系都具有和Fhb1供体一样的抗性,这与前人的研究结果一致[21-22,28]。很多供体除了携带Fhb1基因外,还携带其他抗赤霉病位点,比如苏麦3号除了携带Fhb1外,还携带Fhb2和Fhb5[29]。本研究只针对Fhb1基因进行目标选择,其他微效基因在Fhb1-R株系中随机存在,后代中赤霉病抗性好的Fhb1-R株系可能聚合了这些微效位点,有待进一步研究。本研究对三个环境中赤霉病抗性均优于淮麦20的60个BC2F3株系继续进行选择,发现122个BC2F4品系中有93个(76.2%)赤霉病抗性优于淮麦20,说明赤霉病抗性在多环境中鉴定的重要性,也表明所选BC2F3株系的赤霉病抗性可以稳定地遗传到下一代。由此可见,对于抗赤霉病这种复杂数量性状,在利用Fhb1基因进行分子标记辅助选择时,结合多环境下的表型评价,才能提高抗赤霉病育种成功的概率。
受体亲本的遗传背景对提高赤霉病抗性有很大影响[5]。刘宗镇等[30]发现,赤霉病抗性的超亲现象主要存在于赤霉病抗性为中感以上的亲本杂种后代,而在高感亲本后代中很难选出抗赤霉病品种。如被广泛利用的抗赤霉病小麦品种苏麦3号是由中感赤霉病的台湾小麦与中感赤霉病的阿夫(Funo)杂交选育而成。本研究发现,在对赤霉病有一定抗性的轮选136的遗传背景下,回交群体平均病小穗数和严重度均低于淮麦20或与之相当,但Li等[22]研究发现,在高感赤霉病的轮选13背景下,回交群体的赤霉病抗性水平明显低于轮选136遗传背景,表明遗传背景对基因的抗性有重要影响,这与前人的研究结果[31-33]一致。
轮回亲本轮选136是通过周麦16与郑麦9023杂交再与周麦16回交选育而成,其赤霉病抗性明显优于周麦16[22]。Zhang等[24]报道,郑麦9023携带赤霉病抗性位点Qfhb.7D,该位点在不同环境下可解释6.15%~9.32%的表型变异。本研究发现,轮选136的Qfhb.7D基因型与郑麦9023相同,在93个赤霉病抗性优于淮麦20的BC2F4品系中均含有Qfhb.7D,推测这些品系的赤霉病抗性可能归因于轮选136抗性位点Qfhb.7D与Fhb1基因之间的累加效应。后续有必要利用遗传群体进一步研究Fhb1基因和抗性QTLQfhb.7D的聚合效应。
综上所述,通过把来源于长江流域小麦品种的Fhb1基因导入黄淮冬麦区品种,可有效提高黄淮冬麦区品种对赤霉病的抗性。有限回交结合Fhb1分子标记辅助选择技术,配合田间自然发病和人工接种鉴定,是快速提高黄淮冬麦区品种赤霉病抗性的有效途径。在抗赤霉病育种中,应注意遗传背景的选择和多个抗病基因的累加效应。
