醋酸杆菌多酚的提取及其对糙皮侧耳黄斑病的防治研究
2021-12-01杜笑卫银郭杨昪常明昌孟俊龙刘靖宇
杜笑,卫银,郭杨昪,常明昌,2,孟俊龙,2,刘靖宇,2*
(1. 山西农业大学 食品科学与工程学院,山西 太谷 030801;2. 黄土高原食用菌提质增效协同创新中心,山西 太谷 030801)
糙皮侧耳(Pleurotus ostreatus)隶属于担子菌纲、伞菌目、侧耳科、侧耳属,是我国栽培量和消费量最大的食用菌种类之一[1]。黄斑病是糙皮侧耳生产中最为常见的一种细菌性病害[2]。糙皮侧耳生产中细菌性病害多采用化学防治,长期大量使用化学试剂造成农药残留、环境污染、生态破坏、病菌产生抗药性等问题[3]。近年来,微生物来源的生物防治,无农药残留,同时有利于生态平衡和可持续发展,已成为食用菌病害防治研究的热点内容之一[4]。
醋酸杆菌(Acetobacter)隶属于变形菌门、α-变形杆菌纲、红螺菌目、醋酸菌科、醋酸单孢菌属,是醋发酵阶段的关键菌种[5]。醋酸杆菌中含有多酚、多糖、生物碱和色素等多种活性物质,具有抑菌、免疫调节、抗氧化、抗衰老和降血糖等多种功能活性[6~9]。多酚作为其最主要的生物活性物质之一,现有研究主要集中于提取工艺优化、抗氧化作用和化学成分分离等方面[10~12],而针对多酚防治食用菌病害的研究鲜有报道。本课题组前期研究结果表明醋酸杆菌发酵液对糙皮侧耳黄斑病致病菌解淀粉芽孢杆菌有显著的抑制作用[13]。为此,本研究以醋酸杆菌液体发酵液为供试材料,通过Box-Behnk⁃en 试验设计对醋酸杆菌发酵液多酚的提取工艺进行优化,并研究醋酸杆菌发酵液多酚对该病原菌的防治作用,旨在为糙皮侧耳,乃至其它大型真菌生产中细菌性病害的防治提供一个新的思路。
1 材料与方法
1. 1 试验材料
1. 1. 1 菌株
醋酸杆菌(Acetobacter)菌株BA15、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HB-1 均由山西省食用菌工程技术研究中心提供。
1. 1. 2 培养基
LB 液体培养基:10 g 蛋白胨,5 g 酵母膏,10 g氯化钠,1 L 蒸馏水,pH 7. 4;
醋酸杆菌液体培养基:20 g 葡萄糖,10 g 酵母膏,20 mL 无水乙醇,1 L 蒸馏水。
1. 1. 3 主要试剂和仪器
福林酚显色剂、没食子酸标准品均购自北京索莱宝科技有限公司;其余基本试剂为国产分析纯。
FA1004 电子分析天平(上海越平科学仪器有限公司);RV10 旋转蒸发仪(IKA)、JY92-N 超声波(宁波生物科技股份有限公司);RGX 人工气候培养箱(北京中兴伟业仪器有限公司);HCB-1300V 垂直层流洁净工作台(青岛海尔特种电器有限公司);UV-1800PC 紫外可见光分光光度计(上海美浦达仪器有限公司)。
1. 2 试验方法
1. 2. 1 没食子酸标准曲线的绘制
精确配置1 mg·mL-1的没食子酸溶液,依次配成0、50、100、150、200、250 μg·mL-1的没食子酸标准溶液。准确吸取200 μL 标准液置于10 mL 试管中,加入800 μL 蒸馏水、200 μL 福林酚试剂,混匀后避光保存6 min,再加入2 mL 7% Na2CO3溶液和1. 6 mL 蒸馏水,在避光条件下放置90 min 后于765 nm 波长处测定吸光度[14]。
以多酚浓度为横坐标,吸光度值为纵坐标绘制标准曲线,得到回归方程为y=0. 517 3x+0. 029 2,R2=0. 996 9。
1. 2. 2 醋酸杆菌发酵液的制备
将活化的醋酸杆菌菌株BA15 接入装有100 mL 培养基的250 mL 三角瓶中,接种量1%,30 ℃、160 r·min-1,培养7 d,备用。
1. 2. 3 醋酸杆菌发酵液多酚的提取
在培养好的醋酸杆菌发酵液中加入乙醇,置于超声波中进行超声波辅助提取。提取结束后离心10 min(6 000×g),取上清。45 ℃旋转蒸干浓缩样品,蒸馏水定容至2. 5 mL。
1. 2. 4 多酚提取量的测定
精确吸取制备好的多酚溶液200 μL,按照测定没食子酸标准曲线方法依次加入福林酚试剂和Na2CO3溶液,并测定其吸光度,将所测结果代入标准曲线回归方程得出多酚的浓度(mg·mL-1),最后根据公式计算出醋酸杆菌中多酚的提取量。
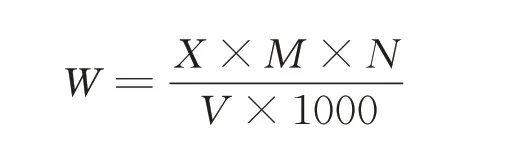
式中W 为多酚提取量,mg·mL-1;X 为从标准曲线上查得的多酚浓度,μg·mL-1;M 为浓缩后体积,mL;N为稀释倍数;V 为醋酸杆菌发酵液体积,mL。
1. 3 单因素试验设计
(1)不同料液比对多酚提取量的影响:料液比设置为1∶1、1∶2、1∶3、1∶4、1∶5、1∶6(V/V),乙醇浓度、超声波功率和超声时间分别设置为50%、250 W和20 min。其余步骤同1. 2. 3。
(2)不同乙醇浓度对多酚提取量的影响:乙醇浓度设置为20%、30%、40%、50%、60%、70%,料液比、超声波功率和超声时间分别设置为1∶3、250 W 和20 min。其余步骤同1. 2. 3。
(3)不同超声功率对多酚提取量的影响:超声功率设置为200、250、300、350、400、450 W,料液比、浓度和超声时间分别设置为1∶3、50% 和20 min,其余步骤同1. 2. 3。
(4)不同超声时间对多酚提取量的影响:超声时间设置为5、10、15、20、25、30 min,料液比、超声波功率和乙醇浓度分别设置为1∶3、250 W 和50%。其余步骤同1. 2. 3。
以上单因素试验的每个处理均设置3 个重复。
1. 4 响应面试验设计
通过对单因素试验结果进行分析,选择乙醇浓度(A)、超声时间(B)和超声功率(C)作为响应因素,以醋酸杆菌发酵液多酚提取量为响应值,采用Box-Behnken 试验设计进行3 因素3 水平的响应面优化试验(表1),以确定醋酸杆菌发酵液多酚的最佳提取工艺,每组试验重复3 次。
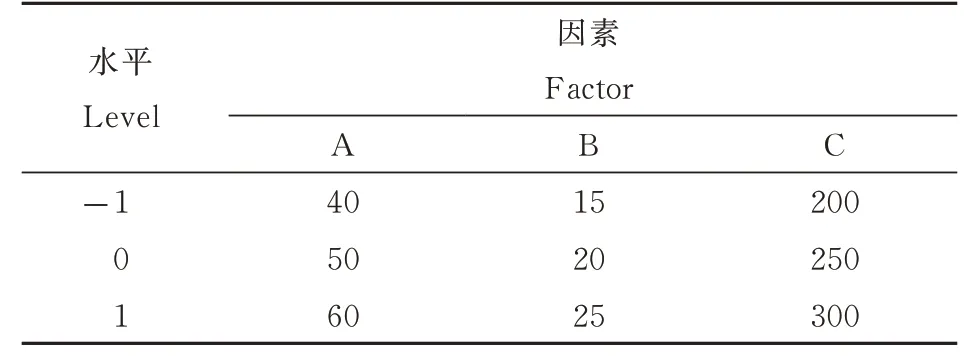
表1 Box⁃Behnken 试验的因素和水平Table 1 Factors and levels of the Box⁃Behnken design
1. 5 抑菌活性试验
1. 5. 1 菌液制备
将活化的解淀粉芽孢杆菌菌株接种到装有100 mL LB 液体培养基的250 mL 三角瓶中,接种量1%,30 ℃、160 r·min-1振荡培养24 h,并用无菌水稀释至1×106cfu·mL-1,备用。
1. 5. 2 醋酸杆菌发酵液多酚在平板上对解淀粉
芽孢杆菌的抑制作用(MIC)
吸取新培养的解淀粉芽孢杆菌悬液100 μL,均匀涂布于直径9 cm 的LB 平板中,待其凝固后在培养基中心放置一个已灭菌的牛津杯。采用二倍梯度稀释法将多酚提取液稀释为140、70、35、17. 5、8. 75 μg·mL-1共5 个不同浓度,在牛津杯中加入100 μL 不同浓度的多酚提取液,放入4 ℃冰箱平衡2 h后置于30 ℃培养箱中暗培养24 h 观察抑菌圈直径,试验重复3 次。
1. 5. 3 醋酸杆菌发酵液多酚在糙皮侧耳子实体上
对解淀粉芽孢杆菌的抑制效果
选取单片健康新鲜的平菇子实体进行试验,在距离菌盖与菌柄交接半径1. 5 cm 处选取3 个区域作为侵染点。侵染点A1:蘸取100 μL 离心菌液所得沉淀涂布均匀,涂布直径约为1 cm。侵染点A2:病原菌接种操作同侵染点A1,接种2 h 后,吸取多酚提取液20 μL 完全覆盖病原菌接种区域。侵染点A3:吸取无菌水20 μL 涂布,涂布直径约为1 cm。在室温16~18 °C、相对湿度85% 和光照400~450 lx 的环境下培养24 h 后观察糙皮侧耳染病情况。
1. 6 统计分析
所有试验均重复3 次,数据均采用Excel 2010和SPSS 16. 0 软件进行分析和作图。单因素试验中醋酸杆菌发酵液多酚提取量用平均值±标准偏差表示。P<0. 05 为差异具有统计学意义。
2 结果与分析
2. 1 单因素试验
2. 1. 1 料液比对多酚提取量的影响
如图1 所示,料液比从1∶1(V/V)增加到1∶3(V/V)时,醋酸杆菌发酵液多酚提取量随料液比的增加而增加,当料液比为1∶3 时,多酚提取量为0. 112 mg·mL-1,当料液比大于1∶3(V/V)时,提取量未出现显著增加,说明多酚提取量达到饱和状态。考虑到料液比的增大会加剧时间和能量的消耗,因此选择料液比为1∶3(V/V)。

图1 料液比对多酚提取量的影响Fig.1 Effect of material-liquid ratio on polyphenol extraction amount
2. 1. 2 乙醇浓度对多酚提取量的影响
如图2 所示,乙醇浓度在20%~50% 时,醋酸杆菌发酵液多酚提取量随乙醇浓度的增大而增大,当乙醇体积分数为50% 时,多酚提取量达到最大为0. 125 mg·mL-1,当乙醇体积分数高于50% 时,提取率反而下降,这可能是乙醇的体积分数增加到一定程度时其它一些弱极性成分溶出量增加,减缓了酚类物质向乙醇溶剂的扩散[14],因此选择乙醇体积分数为50%。
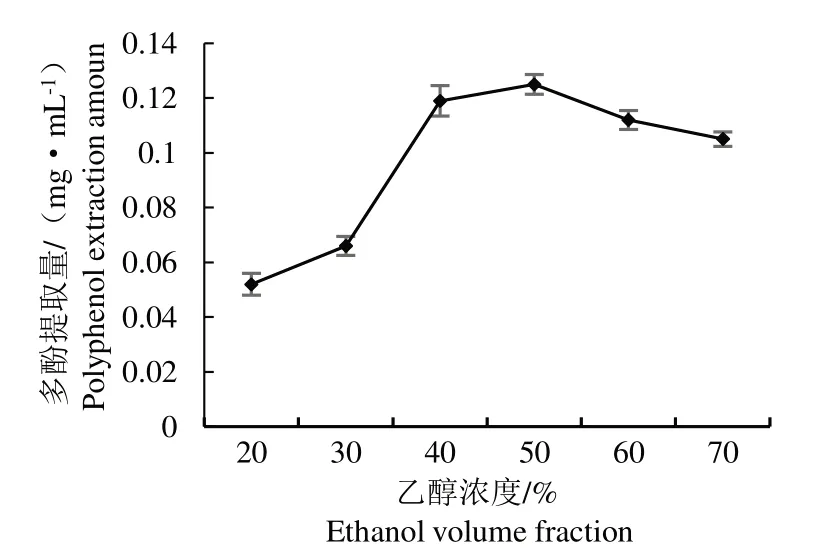
图2 乙醇浓度对多酚提取量的影响Fig.2 Influence of ethanol volume fraction on polyphenol extrac⁃tion amount
2. 1. 3 超声波功率对多酚提取量的影响
如图3 所示,超声功率从200 W 增加到250 W时,醋酸杆菌发酵液多酚提取量随料液比的增加而增加,当料液比为250 W,多酚提取量为0. 129 mg·mL-1,当料液比大于250 W,提取量下降,可能是超声功率过大产生强烈的热效应导致一些不稳定多酚被分解转化[15],因此选择超声功率为250W。
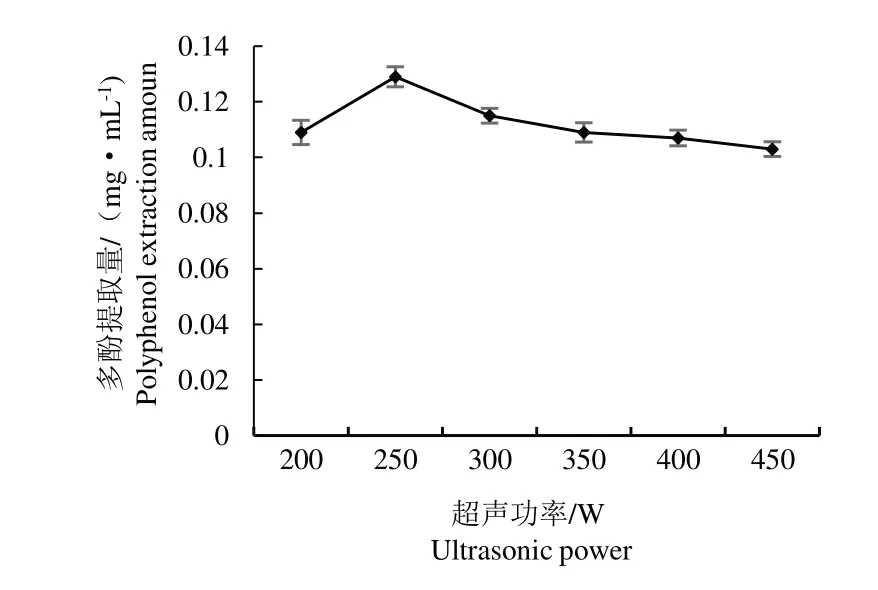
图3 超声功率对多酚提取量的影响Fig.3 Effect of ultrasonic power on extraction of polyphenols
2. 1. 4 超声波时间对多酚提取量的影响
如图4 所示,超声时间在5~20 min 之间时,醋酸杆菌发酵液多酚提取量随时间的增加而增加,当超声时间为20 min 时,多酚提取量为0. 125 mg·mL-1,在达到20 min 以后提取量的增大速率相对超声时间较低时放缓。虽然醋酸杆菌发酵液多酚提取量在大于20 min 后有一定水平的增加,但是出于经济效益考虑,超声时间应选择在20 min。

图4 超声时间对多酚提取量的影响Fig.4 Influence of ultrasonic time on polyphenol extraction quantity
2. 2 Box⁃Benhnken 试验结果
2. 2. 1 模型方程的建立和显著性分析
依据响应面设计完成3 因素3 水平条件下醋酸杆菌发酵液多酚的提取和含量的测定,设计表及结果表见表2。经过方差分析和二次多项回归拟合分析,醋酸杆菌发酵液多酚提取量用响应值Y 来表示,得到最终方程:
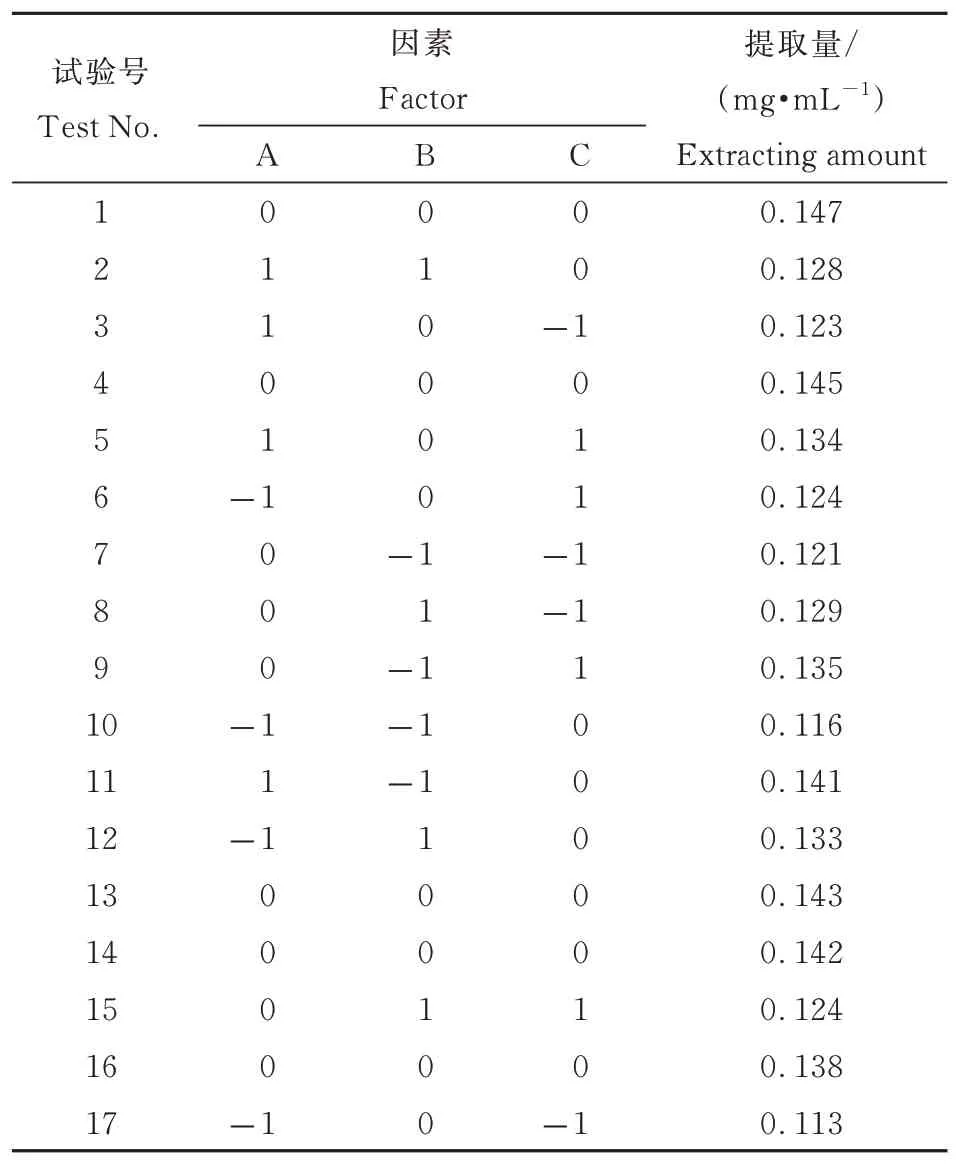
表2 响应面设计和试验结果Table 2 Response surface analysis design and data

由表3 可知,该模型的F 值为17. 42,P值为0. 000 5,说明模型高度显著,该模型建立有效。模型的决定系数和校正确定系数分别为R2=0. 957 3和Radj2=0. 902 3,说明该模型中90. 23% 的试验数据与模型相关。对回归模型进行显著性分析可知,A、AB、A2和C2的差异极显著,C、BC 和B2的差异显著,其余项均不显著。根据F 值结果分析,各因素对醋酸杆菌发酵液多酚提取量的影响顺序依次是乙醇浓度(A)>超声功率(C)>超声时间(B)。
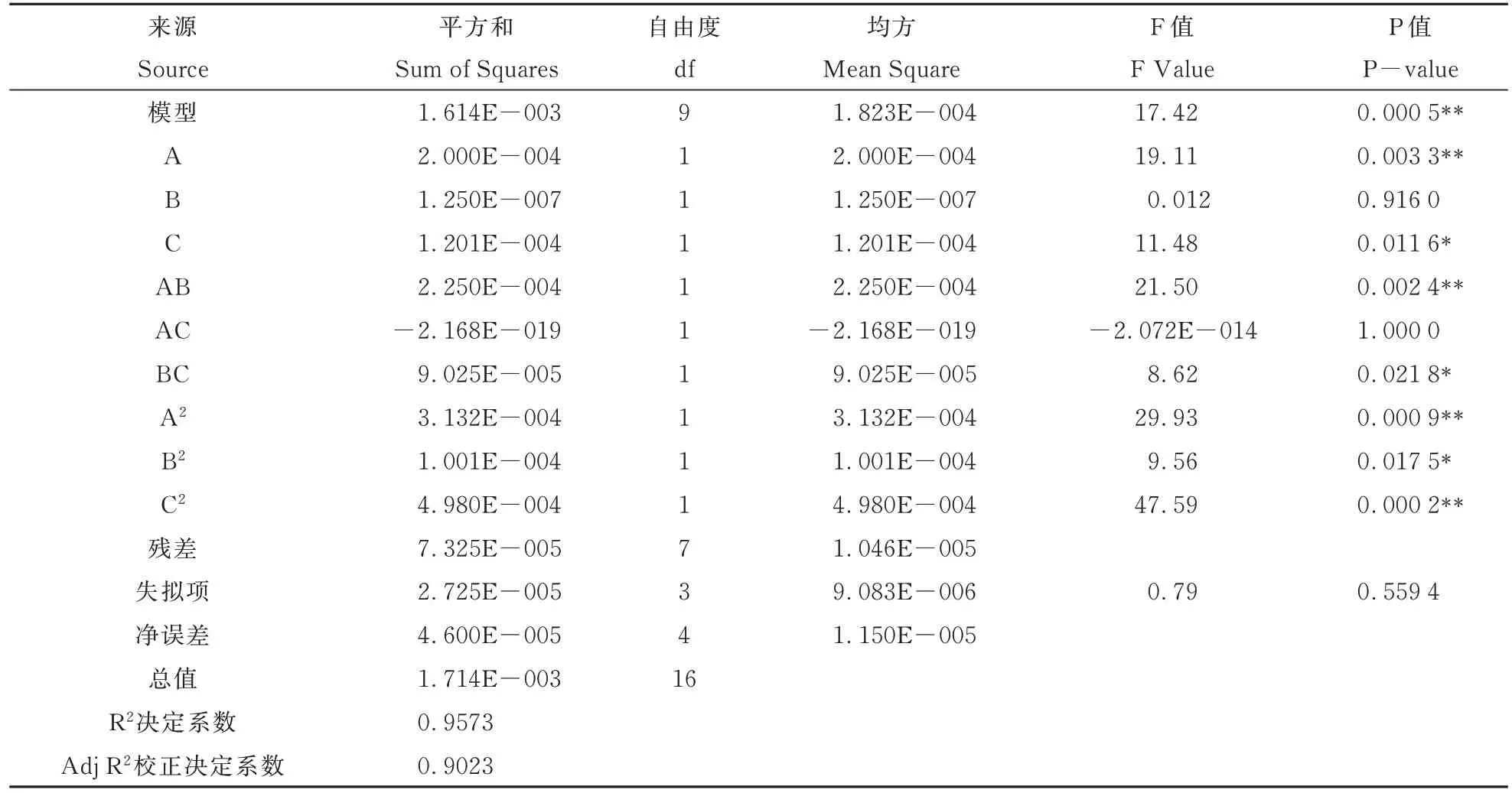
表3 回归分析结果Table 3 Regression analysis data
2. 2. 2 多因素交互作用分析
乙醇浓度、超声时间和超声功率3 个因素在醋酸杆菌发酵液多酚提取过程中的两两交互作用如图5 所示。响应曲面越陡峭,说明两个因素之间的交互作用对多酚提取量影响越显著[16]。由图5a 可知,随着超声时间和乙醇浓度的增大,醋酸杆菌发酵液多酚提取量也随之增长,但超声时间和乙醇浓度增大到一定程度后,多酚提取量有下降的趋势,且超声时间和乙醇浓度响应曲面坡度最陡,说明两因素交互作用对多酚提取量影响最显著。由图5b可知超声时间与超声功率响应面坡度较陡,说明两因素交互作用对多酚提取量影响显著;由图5c 可知乙醇浓度与超声功率交互作用对多酚提取量影响不显著。

图5 响应面的三维曲面图Fig.5 3D curved surface diagram of the response surface
2. 3 验证试验
通过分析回归拟合方程和回归模型,依据响应面分析法对醋酸杆菌发酵液多酚提取量进行优化,得到醋酸杆菌发酵液多酚最优参数为料液比1∶3、最佳超声时间22. 5 min、乙醇浓度45. 6%、超声功率为250. 43 W,发酵液中多酚提取量的理论值为0. 144 mg·mL-1。根据实际情况,设置料液比、超声时间、乙醇浓度和超声功率依次为1∶3、23 min、45%、250 W 进行验证,最终得到多酚实际提取量为0. 140 mg·mL-1,误差为2. 7%。此结果说明所建模型可靠,采用响应面法优化设计的回归方程能够较好地显示出其各个因素对多酚提取量的影响。
2. 4 醋酸杆菌发酵液多酚提取液在平板上对解淀粉芽孢杆菌的抑制作用
通过牛津杯法,考察不同浓度的醋酸杆菌发酵液多酚提取液对解淀粉芽孢杆菌的抑制效果。醋酸杆菌发酵液多酚提取液浓度为140、70、35、17. 5 μg·mL-1时,随着浓度的降低抑菌圈直径也在减小。当浓度为8. 75 μg·mL-1时,提取液对解淀粉芽孢杆菌无抑制作用(图6)。这一结果表明,醋酸杆菌发酵液多酚提取液的最小抑菌浓度为17. 5 μg·mL-1。
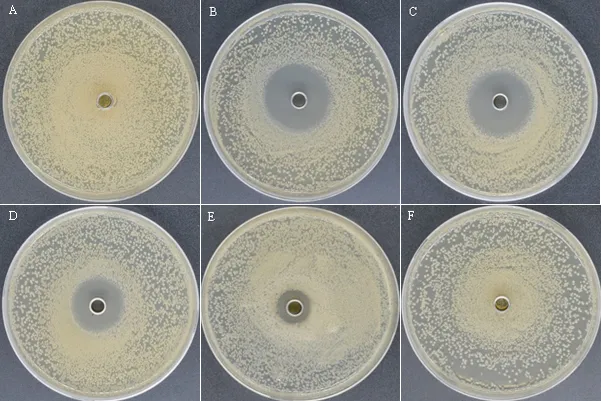
图6 不同浓度多酚提取液对解淀粉芽孢杆菌抑制图Fig.6 Inhibition of different concentrations of polyphenol extracts against Bacillus amyloliticus
2. 5 醋酸杆菌发酵液多酚提取液在糙皮侧耳子实体上对解淀粉芽孢杆菌的防治效果
选取料液比1∶3、超声功率250 W、超声时间23 min 和乙醇体积分数45% 提取的醋酸杆菌多酚提取液研究其在糙皮侧耳子实体上对解淀粉芽孢杆菌的防治效果。由图7 可知,在子实体涂布病原菌2 h 后涂布醋酸杆菌多酚提取液,可明显抑制该病原菌的生长。
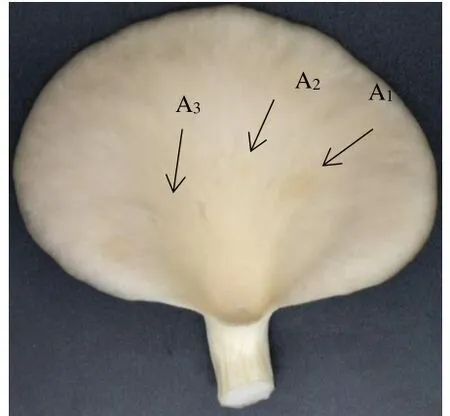
图7 醋酸杆菌多酚提取液在糙皮侧耳子实体上对解淀粉芽孢杆菌的防治效果Fig.7 Control effect of Acetobacter polyphenol extract on the fruit⁃ing body of Pleurotus pellagra against Bacillus amyloliquefa⁃ciens
3 讨论
采用Box-Behnken 方法,对醋酸杆菌发酵液多酚的超声波辅助提取工艺优化。结果表明,在料液比1∶3、超声时间23 min、乙醇浓度45%、超声功率250 W 的最优工艺条件下,醋酸杆菌发酵液多酚提取量为0. 140 mg·mL-1。其中,超声时间对醋酸杆菌发酵液多酚提取量的影响最大,这同邓勇等[17]的石榴皮多酚提取结果相一致。 超声功率在200~250 W 的范围内,醋酸杆菌多酚的提取量与超声功率呈正相关。当超声功率为250 W 时,多酚提取量达到最大值0. 129 mg·mL-1,而当超声功率为250~450 W 时多酚提取量却呈下降趋势。其原因可能是超声功率过大产生强烈的热效应导致一些不稳定多酚被分解,也可能是超声空化泡夹带的水蒸气和氧气等进入到溶剂中,造成多酚被氧化而降解[18]。
现有研究表明:在生物活性组分提取过程中,采用较大的浸提溶剂浓度梯度,可改变原料组织结构及其与溶剂之间的表面张力,从而易于有效成分的溶出,能显著提高提取效率,但也存在一定缺陷[19,20]。 本文研究显示:在提取液中含有0~50%乙醇的浓度范围内,醋酸杆菌多酚的提取量随着乙醇浓度的增加而增加,而当乙醇浓度超过50% 后,提取量则呈现明显的下降趋势。这一结果与张春颖等[21]的小米多酚提取的研究结果相似,但小米多酚提取量却是在乙醇浓度达到70% 后呈下降趋势。我们推测可能与供试材料的组织结果及理化性质均存在较大差异有关,这一研究结果将为醋酸杆菌发酵液多酚的高效提取技术研发及其应用提供参考依据。
醋酸杆菌发酵液多酚对解淀粉芽孢杆菌的抑制效果分析结果显示:采用牛津杯法,醋酸杆菌发酵液多酚对解淀粉芽孢杆菌的最小抑菌浓度为17. 5 μg·mL-1,明显优于植物来源的葡萄多酚[22]和藻类多酚[23]对于同类细菌的抑制效果。这可能与我们的提取材料有关,醋酸杆菌作为一种耐酸性细菌,其用于环境竞争分泌在胞外的次级代谢产物与偏碱性细菌解淀粉芽孢杆菌的自身需求存在较大不同[24]。子实体涂抹抑制试验结果进一步显示:醋酸杆菌发酵液多酚对黄斑病有明显抑制作用,但对平菇子实体的正常生长无明显影响,这与课题组前期的醋酸杆菌发酵液对糙皮侧耳黄斑病致病菌的抑制作用效果相一致[13]。据此,推测醋酸杆菌发酵液多酚是其发酵液中的一种重要的可抑制解淀粉芽孢杆菌生长的抑菌活性物质,其含量可作为应用于防治糙皮侧耳黄斑病的醋酸杆菌发酵液的重要检测指标,研究结果将为糙皮侧耳,乃至其他大型真菌生产中细菌性病害的防治提供一个新的思路。
4 结论
本研究以醋酸杆菌发酵液为供试材料,通过响应面分析法对多酚的提取工艺进行优化,并探究其对糙皮侧耳黄斑病病原菌解淀粉芽孢杆菌的防治作用。 研究结果表明:在料液比1∶3、乙醇浓度45%、超声功率250 W 和超声时间23 min 的条件下多酚提取效果最佳,提取量为0. 140 mg·mL-1。醋酸杆菌发酵液多酚提取液对解淀粉芽孢杆菌最小抑菌浓度为17. 5 μg·mL-1,且其能够在糙皮侧耳子实体上防治黄斑病。这也将为糙皮侧耳黄斑病的生物防治研究提供重要的参考依据。
