体外模拟消化对茯苓不同药用部位及代谢废料的抗氧化活性影响*
2021-12-01王军民刘思远
王军民,王 涛,杨 莹,刘思远
(西南林业大学西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224)
中药茯苓为伞菌纲(Agaricomycetes) 伞菌目(Agaricales) 多孔菌科(Polyporaceae) 茯苓属(Poria) 真菌茯苓 [Poria cocos(Schw.)Wolf]的干燥菌核,是我国传统常用中药材[1]。茯苓生长在松树林植物群落中,靠吸收松树根部营养而生长发育[2]。野生药材目前已不能满足市场需求,现多以人工栽培为主。人工栽培现主要有2种方式,其一是将菌丝接种于自然死亡或者被砍伐的松树树桩上并覆土,待其自然生长;其二是将菌丝接种于经脱松脂、干燥后的松树树干上并埋于地下4 cm〜6 cm[3]。茯神为茯苓块中穿有坚实细松根者,来源于自生茯苓或第一种人工方式,长宽各4 cm〜5 cm,松根直径不超过1.5 cm,边缘苓块可不成方形。茯苓中间生长的松木如为弯曲的松根,似朽木状,质松体轻,每根直径不超过2.5 cm,周围带有2/3的茯苓肉则称之为茯神木[4]。
茯苓和茯神具有较好的生物活性[5],但关于茯苓生长后剩余废料(下文统称代谢废料)的利用却未见报道,同时体外模拟消化前后茯苓各部分抗氧化活性的研究亦未见报道。茯苓皮载于《本草纲目》,味甘淡,性平,具有利水,消肿功效;茯苓(白茯苓)始载于《神农本草经》,味甘、淡,性平,具有利水渗湿、健脾安神等功效;茯神载于《名医别录》,甘淡,平,具有宁心、安神、利水功效,用于心虚惊悸、健忘、失眠、惊痫、小便不利[6]。
为评价茯苓不同药用部位茯苓皮、白茯苓以及茯苓代谢废料、茯神内松根(这4部分下文统称茯苓不同药用部位)被体外模拟消化后抗氧化活性的变化,综合评价茯苓的表观抗氧化能力,同时为研究茯苓代谢废料的利用和生物活性,将不同样品进行胃、肠消化和吸收体外模拟试验,采用DPPH自由基清除能力、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸) 二铵盐自由基(ABTS) 清除能力、抗超氧阴离子自由基(O2-) 能力和羟基自由基(OH-) 清除能力等4种常用的体外抗氧化模型,研究茯苓样品抗氧化能力在体外模拟消化后抗氧化能力的变化。从而为研究开发茯苓提供试验依据,为茯苓代谢废料开发利用提供研究基础。
1 仪器和材料
1.1 试验材料
样品采自云南省临沧市双江拉祜族佤族布朗族傣族自治县茯苓栽培基地,茯苓母种为中科院5.78原种,栽培树桩为思茅松砍伐半年后树桩。茯苓采集后剥取褐色部分得到茯苓皮;白色部分切丁干燥得到白茯苓;茯神切片后挖取内部松根得到茯神松根(下文统称茯神);茯苓采集后剩余树桩为茯苓代谢废料。上述材料粉碎后过20目筛备用。标本保存在西南林业大学林学院植物资源利用系药用植物教研室。
1.2 仪器与试剂
Evolution 300紫外分光光度计,美国Thermo Fisher公司;SQP型万分之一电子天平,赛多利斯科学仪器有限公司;XS105 DU十万分之一分析天平,Mettler Toledo;DHG-9030 A型高温干燥箱,杭州利辉环境检测设备有限公司;旋转蒸发仪(Heidolph Digital);超声波清洗器,巴克超声波科技有限公司;电热恒温水浴锅,金坛市丹瑞;移液枪、容量瓶、样品瓶,DPPH、ABTS、α-淀粉酶、胃蛋白酶3 000 U(猪胃黏膜)、胰蛋白酶250 U(猪胰)、胆酸钠,上述试剂购于上海源叶生物公司;维生素C,北京蓝博斯特生物技术有限公司;儿茶素标准品,北京酷来搏科技有限公司;HCl,汕滇药业有限公司;NaCl、KCl、Na2HPO4·12H2O、KH2PO4、CaCl2、NaHCO3、Tris 试剂、K2S2O8、FeSO4·7H2O、水杨酸、邻苯三酚、30%H2O2均为分析纯购于天津市风船化学试剂科技有限公司。
2 试验方法
2.1 原材料的提取
取样品各100 g放入圆底烧瓶中,分别以无水乙醇和蒸馏水按照料液比1∶10于90℃回流提取,样品编号详见表1。
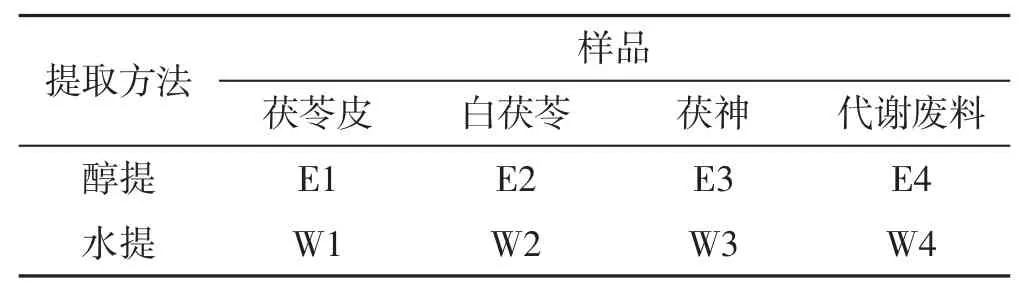
表1 茯苓样品提取方法及编号Tab.1 The sample number and extraction method of Poria cocos
2.2 体外模拟消化
2.2.1 消化液配制
1)模拟口腔消化液的配制
PBS缓冲液:精密称取NaCl 8.006 g、KCl 0.201 g、Na2HPO4·12H2O 3.581 g、KH2PO40.204 g,去离子水溶解后定容到1 L,取α-淀粉酶0.910 g溶解至220 U·mL-1[7]。
2)胃模拟消化液的配制
胃电解质溶液:精密称取NaCl 3.10 g、KCl 1.10 g、CaCl20.150 g、NaHCO30.60 g,用蒸馏水溶解定容于1 L容量瓶中。
体外模拟胃液:0.67 g胃蛋白酶中加入0.9 L胃电解质溶液,混合摇均后用1.00 mol·L-1HCl调节pH为2.0[7]。
3)肠模拟消化液的配制
肠电解质溶液:NaCl 5.4 g、KCl 0.65 g、CaCl20.33 g溶于1 L去离子水中;胰酶溶液:7 g胰酶定溶于100 mL水;4%胆酸钠溶液:4 g胆酸钠定溶于196 mL水。
体外模拟肠液:100 mL胰酶溶液中加入100 mL肠电解质溶液、200 mL胆盐溶液和13 mg胰蛋白酶,混合均匀,用1 mol·L-1NaHCO3调节pH为7.0[7]。
2.2.2 体外模拟消化流程
精密称取茯苓不同样品提取物1.0 g加蒸馏水定容至100 mL,得到浓度为10 mg·mL-1的样品溶液进行模拟消化,体外模拟消化方法参考miller[8]模拟消化方法并加改进,具体流程见图1。
相同条件以蒸馏水代替样液为空白组,以蒸馏水代替消化液为对照组。
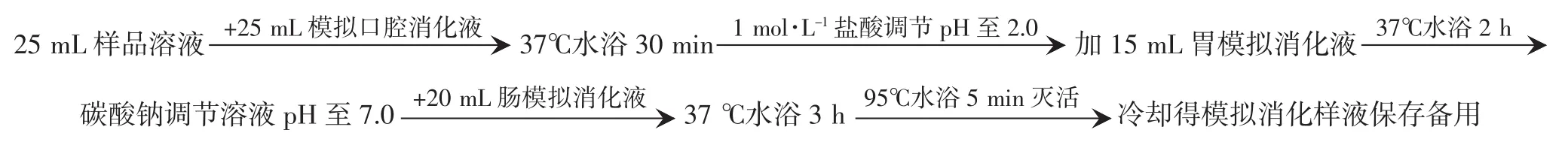
图1 体外模拟消化流程Fig.1 Process of simulated digestion in vitro
2.3 抗氧化活性测试
2.3.1 不同浓度的样品测试液的配制
分别取消化前后不同样品的醇提物和水提物溶液,加对应的提取溶剂稀释为不同浓度的待测液备用,待测液浓度详见表2。
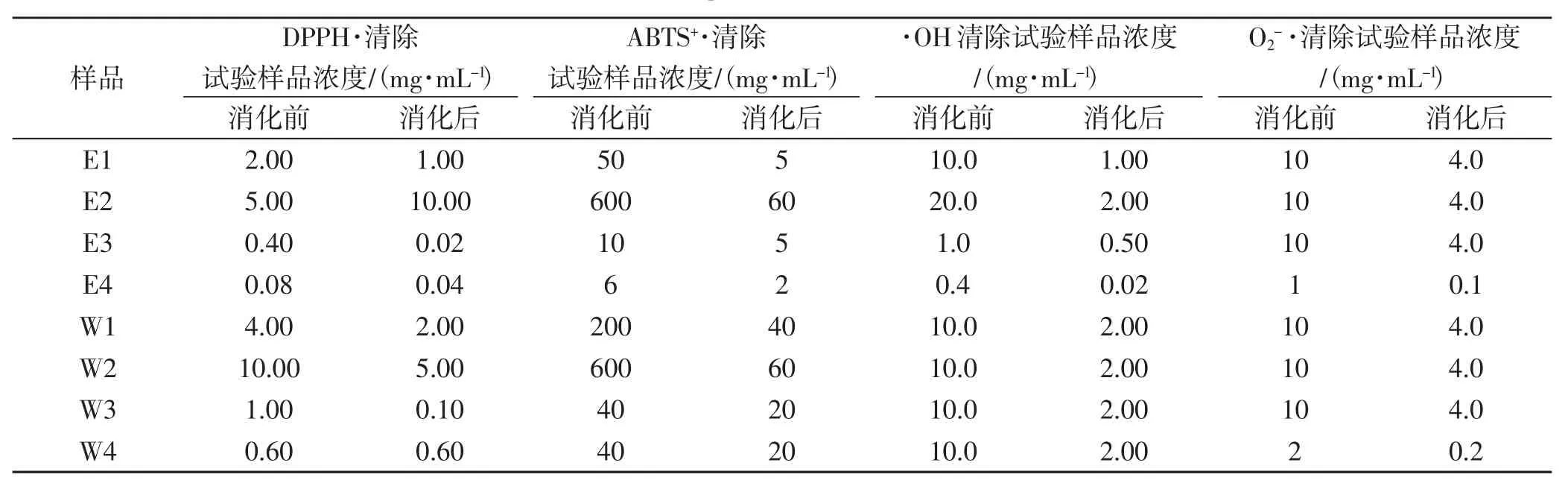
表2 样品溶液浓度Tab.2 Sample solution concentration
2.3.2 DPPH·清除能力的测定
参照Kaur[9]的方法改进而来,分别吸取消化前后的待测液各0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL及阳性对照VC加入比色管中,加乙醇定容至2 mL,后加0.2 mmol·L-1DPPH溶液2 mL,避光室温反应30 min后用紫外分光光度计测定各组分样品在517 nm处的吸光度值(A1)。对照组以2 mL无水乙醇溶液代替DPPH溶液,测吸光度值(A2)。空白组以等量无水乙醇代替各组分样品溶液,重复同上步骤,测得吸光度值(A0)。每个分析样品重复3次,取平均值。按公式(1) 计算DPPH·清除率(IDPPH,%)。以清除率(%) 为纵坐标,样品浓度(mg·mL-1) 为横坐标,得到线性回归方程,计算清除率50%时样品的半抑制浓度值(下文统称IC50值)。DPPH·清除率(IDPPH,%) 公式为:
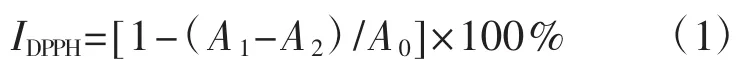
式中:A0为空白组吸光度值;A1为试验组吸光度值;A2为对照组吸光度值。
2.3.3 ABTS+·清除能力的测定
参照Sun Q[10]的方法并加以改进。测定精密配制ABTS(7 mmol·L-1) 溶液和过硫酸钾水溶液(2.45 mmol·L-1),1∶1 (V/V) 混合,在室温、避光条件下静置12 h〜16 h得到ABTS储备液。使用前用无水乙醇逐级稀释至在734 nm处的吸光度值为0.70±0.02时为标准工作液。
分别吸取消化前后的待测液各0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL及阳性对照VC加入比色管中,加乙醇定容至2 mL,后加入2 mL ABTS工作液,混合均匀,室温下反应6 min,在波长734 nm处测定各组分样品的吸光度值(B1)。空白对照用无水乙醇2 mL代替ABTS工作液,步骤同上,于波长734 nm处测得各组分样品本身吸光度值(B2)。以2 mL无水乙醇与2 mL ABTS工作液充分混合,重复同上步骤,测其在734 nm波长处的吸光度值(B0)。以VC作阳性对照,重复3次,取平均值。计算ABTS+·清除率,并计算不同样品的IC50值,ABTS清除率(IABTS,%) 公式为:
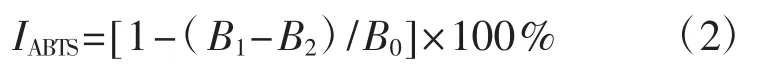
式中:B0为空白组吸光度值;B1为试验组吸光度值;B2为对照组吸光度值。
2.3.4 ·OH清除能力的测定
参照韦玉兰等[11]的方法。分别吸取消化前后的待测液各0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL及阳性对照VC加入比色管中,加乙醇定容至1 mL,依次加入 6 mmol·L-1的 FeSO4·7H2O 溶液、6 mmol·L-1的水杨酸-乙醇溶液、6 mmol·L-1H2O2溶液各200 μL并补蒸馏水至4 mL充分混匀,室温放置1 h后在波长510 nm处测定其各组分样品吸光度值(C1)。用相同体积的无水乙醇代替待测样品液,重复上述步骤,于波长510 nm处测得吸光度值(C0)。以等体积蒸馏水作为参比液调零。以VC作对照,每个分析样品重复3次,取平均值。计算羟基自由基清除率,并计算不同样品的IC50值,·OH清除率(IOH,%) 公式为:
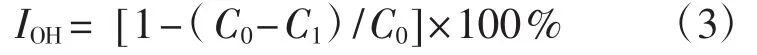
式中:C0为空白组吸光度值,C1为试验组吸光度值。
参照赵宏等[12]方法,分别吸取消化前后的待测液各0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL及阳性对照VC加入比色管中,加乙醇定容至1 mL,分别加 0.1 mol·L-1的 Tris-HCl缓冲溶液 (pH 7.8,2 mmol·L-1EDTA) 4 mL,加入25℃水浴条件下恒温20 min 的 6 mmol·L-1邻苯三酚工作液 50 μL,混匀后在波长325 nm处检测,以30 s为梯度在4 min内测得吸光度值Di(i=1……9),以吸光值Di对反应时间t作线性关系图,斜率即为ΔD1。以1 mL乙醇做空白对照重复上操作步骤,最后计算4 min内邻苯三酚每分钟吸光度值的变化率(ΔD0)。以等体积Tris-HCl缓冲溶液作为参比液调零。以VC作阳性对照,每个分析样品重复3次,取平均值。计算清除率,并根据清除率计算不同样品的IC50值,清除率(IO2,%) 公式为:
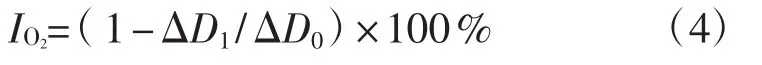
式中:ΔD0为对照组吸光度变化值;ΔD1为试验组吸光度变化值。
2.4 多酚类物质提取与检测
4个样品粉碎后各取18 g分为2份,滤纸包裹后置索氏提取器内,加石油醚进行脱脂处理,1份加入200 mL的75%乙醇回流提取2 h过滤,残渣重复提取2次。合并滤液减压浓缩,提取物预冻后放入冷冻干燥机进行干燥;另一份加入200 mL蒸馏水回流提取2 h过滤,残渣重复提取2次。合并滤液减压浓缩,提取物预冻后放入冷冻干燥机进行干燥[13]。
茯苓不同部位总可溶多酚化合物的提取参照王静等[14]的方法,并进行适当改进,提取流程如下:各部位冻干粉末平均分为3份,各取1份滤纸包裹后加入50 mL的75%丙酮避光浸泡30 min后超声提取20 min,离心后取上清液,重复3次,合并定容后即得待测液。采用福林酚法测定多酚含量[15]。
2.5 数据处理
总酚的提取重复3次,计算提取率。用SPSS version 17.0软件计算不同样品对自由基的清除率为50%时的浓度(IC50值),结果均表示为平均值±标准偏差。总酚含量与采用DPPH·、ABTS+·、、·OH自由基清除能力法测定的抗氧化活性的相互关系以及不同测定方法的关系采用Excel 2010中的Correl函数进行计算得到相关性。
3 试验结果
3.1 体外模拟消化后茯苓各部分活性变化
3.1.1 DPPH·清除能力
茯苓各部分提取物体外模拟消化前后DPPH·清除能力统计见图2。
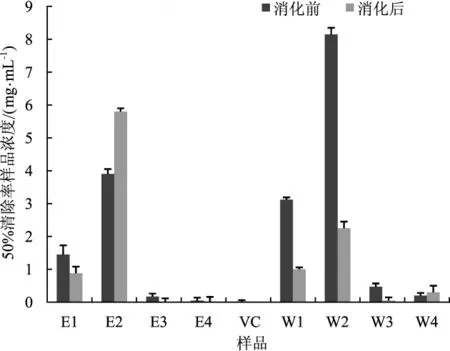
图2 体外模拟消化对茯苓各部分DPPH·清除能力的影响Fig.2 Effects of in vitro simulated digestion on the DPPH·radicals scavenging ability in each part of Poria cocos
由图2所示,消化前茯苓各部分提取物DPPH·清除能力由高到低依次为E4>E3>W4>W3>E1>W1>E2>W2,消化后自由基清除能力由高到低依次为E4>W3>E3>W4>E1>W1>W2>E2。体外模拟消化对茯苓各部分DPPH·清除能力影响较大,通过计算IC50值进行比较发现,除茯苓代谢废料水提物、白茯苓醇提物在消化后清除能力有所下降外其他样品对自由基清除能力有所增强。其中茯苓代谢废料醇提部分自由基清除能力最强,消化前IC50值为(0.047±0.001 3) mg·mL-1,消化后自由基清除能力有所提升,其浓度降低为(0.021±0.002 0) mg·mL-1,活性超过阳性对照VC。茯神醇提物在消化后自由基清除能力提高明显,消化后样品IC50值为(0.015±0.001 0)mg·mL-1亦超过阳性对照VC活性。
3.1.2 ABTS+·清除能力
茯苓各部分提取物ABTS+·清除能力统计见图3。
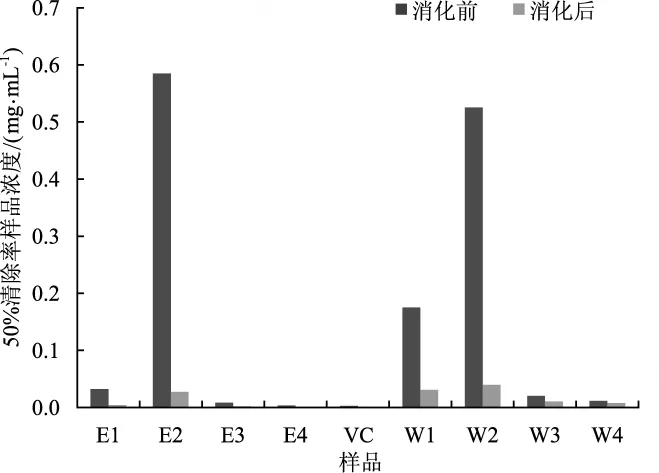
图3 体外模拟消化对茯苓各部分ABTS自由基清除能力的影响Fig.3 Effects of in vitro simulated digestion on the ABTS radicals scavenging ability in each part of Poria cocos
由图3可知,消化前茯苓各部分提取物ABTS+·清除能力由高到低依次为E4>E3>W4>W3>E1>W1>W2>E2,消化后自由基清除能力由高到低依次为E4>E3>E1>W4>W3>E2>W1>W2。通过计算IC50值进行比较发现体外模拟消化对茯苓各部分ABTS+·清除能力都有显著提高。白茯苓醇提物和水提物增长较为明显,其IC50值分别由未消化前的(0.59±0.003 1)mg·mL-1和 (0.53± 0.003 0) mg·mL-1降至 (0.027±0.000 28) mg·mL-1和 (0.039±0.000 19) mg·mL-1,消化对白茯苓ABTS+·清除能力影响较大;茯神和茯苓代谢废料醇提物分别由消化前的IC50值(0.008 4±0.000 75) mg·mL-1和 (0.003 3 ±0.000 54) mg·mL-1降至 (0.002 2±0.001 1) mg·mL-1和 (0.001 4±0.001 2) mg·mL-1,活性超过阳性对照VC(0.002 9±0.000 04) mg·mL-1。
3.1.3 ·OH清除能力测定
茯苓各部分提取物·OH清除能力统计见图4。
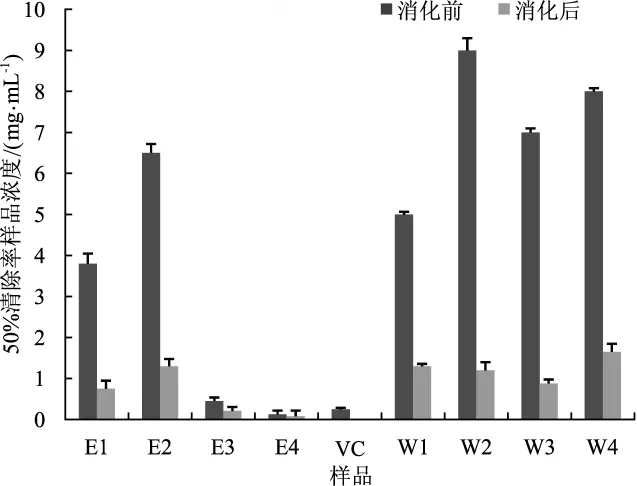
图4 体外模拟消化对茯苓各部分·OH清除能力的影响Fig.4 Effects of in vitro simulated digestion on the·OH radicals scavenging ability in each part of Poria cocos
由图4所示,消化前茯苓各部分提取物·OH清除能力由高到低依次为E4>E3>E1>W1>E2>W3>W4>W2,消化后自由基清除能力由高到低依次为E4>E3>E1>W3>W2>E2>W1>W4。体外模拟消化对茯苓各部分·OH清除能力都有一定提高。通过计算IC50值进行比较发现,茯苓各部分提取物在消化后IC50值降低明显。其中茯苓代谢废弃物醇提部分消化前后活性强于阳性对照VC,而茯神醇提物在消化后活性强于阳性对照VC。
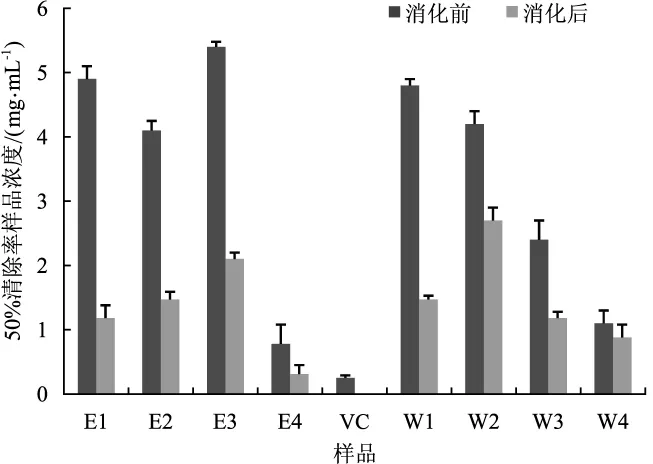
图5 体外模拟消化对茯苓各部分抗能力的影响Fig.5 Effect of in vitro simulated digestion on the resistance of of each part of Poria cocos
3.2 体外模拟消化后多酚含量变化
试验采用福林酚显色法检测体外模拟消化前后茯苓不同部位的总酚含量变化,以儿茶素为标准品,于725 nm处测定吸光度,绘制标准曲线,得到线性方程为:
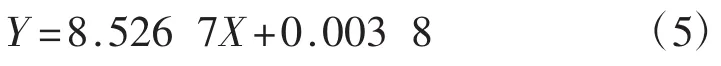
线性方程中R2=0.998 6,浓度X与吸光度Y在0.01 mg·mL-1〜0.1 mg·mL-1具有良好的线性关系。根据线性方程计算体外模拟消化前后茯苓各部分的总酚含量,结果见图6。
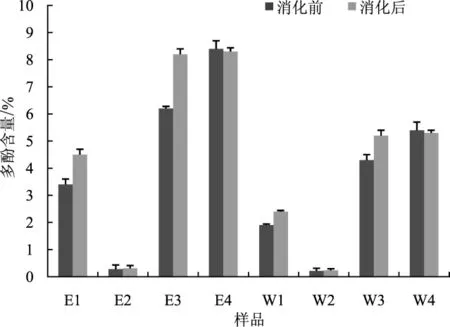
图6 体外模拟消化对多酚含量的影响Fig.6 The effect of in vitro simulated digestion on the content of polyphenols
由图6可知,体外模拟消化前茯苓各部分总多酚含量依次为E4>E3>W4>W3>E1>W1>E2>W2,消化前茯苓代谢废料多酚含量最高为8.4%,最低为白茯苓约为0.28%,多酚含量变化的差异来源于各部分材料组成的不同,茯苓代谢废料与茯神主要含有松木及少量茯苓菌丝,而松树本身多酚类物质含量较高,这与文献报道一致[16]。
经体外模拟消化后总酚含量整体呈增加趋势,与文献[17]报道的“消化酶可以降低多酚类物质分子之间的相互作用力,从而促进多酚的释放”的结论一致。但是茯苓代谢废料水提和醇提部分经体外模拟消化后总酚含量降低,这可能与原材料经过茯苓代谢,多酚类成分可以自由释放导致模拟消化不能促进其进一步的释放,而消化酶会破坏和转化一定的多酚。而抗氧化试验结果表明经消化后二者抗氧化活性增加,其原因可能是在模拟消化过程中促进了其他抗氧化活性物质的释放,与文献[17]报道的体外模拟消化可以显著的促进黄酮等抗氧化活性成分的释放结论一致。
3.3 茯苓不同部位抗氧化活性与多酚的相关性研究
为研究茯苓不同部位多酚含量与抗氧化活性间的关系,利用Correl函数进行计算并得到体外模拟消化前后茯苓不同部位多酚含量与抗氧化活性的相互关系见表3。多酚含量与抗氧化活性相关性研究中抗氧化活性数据采用样品IC50值进行相关性分析,分析表明多酚含量越高样品IC50值越低,其绝对值越接近于1则其相关性越高,绝对值越接近于0说明相关性越小乃至不相关[18]。

表3 总酚含量及抗氧化活性之间的相关性分析Tab.3 Correlation analysis between total phenol content and antioxidant activities
由表3可知,茯苓不同部位多酚含量与以ABTS+·、DPPH·、·OH法测定的抗氧化活性具有很高的负相关性,相关系数分别达到-0.869 3、-0.834 5以及-0.693 5,表明多酚含量越高样品IC50值越低;多酚含量与抗能力具有一定的相关性,其相关系数为-0.550 7。体外模拟消化后,茯苓不同部位多酚含量与以ABTS+·、·OH法测定的抗氧化活性相关性提高,其中多酚含量与以ABTS+·法测定的抗氧化活性相关性达到-0.911 9。而与以DPPH·、的抗氧化活性相关性降低。ABTS+·法测定的抗氧化活性与DPPH·、、·OH法测定的抗氧化活性的相关性均高于0.6,表明该法测定茯苓不同部位多酚的抗氧化活性较为稳定;但是测定的抗氧化活性与DPPH·、ABTS+·、·OH法测定的抗氧化活性的相关性除与ABTS+·法高于0.6外,其他方法相关性均较低。由此可以看出多酚类化合物含量与抗氧化活性之间的相关性与抗氧化活性测定的方法有关,与文献报道一致[19]。
4 结论
为研究茯苓不同部位不同溶剂提取物的抗氧化活性以及体外模拟消化对其抗氧化活性的影响,进一步开发和利用茯苓代谢废料。以体外模拟消化模型为处理方法研究体外模拟消化前后茯苓各部分总多酚含量的变化,研究各部分消化前后ABTS+·、DPPH·、、·OH拮抗能力。结果表明,总体抗氧化活性以茯苓代谢废料最高,活性接近或强于阳性对照VC;与水提法作比较,茯苓各部分醇提物抗氧化活性更好,总多酚含量相对较高;体外模拟消化可以显著提高茯苓各部分抗氧化活性,以白茯苓醇提物活性提高最为明显,体外模拟消化增强了茯苓各部分多酚的提取效率,增加了茯苓各部分提取物对ABTS+·、DPPH·、、·OH拮抗能力;Correl函数相关性分析表明,茯苓不同部位多酚含量与以DPPH·、ABTS+·、·OH法测定的抗氧化活性高度相关,与法测定的抗氧化活性相关性一般。ABTS+·法测定的抗氧化活性与其他方法测定的活性相关性较高,该法在茯苓各部分的抗氧化活性研究中具有一定稳定性。
茯苓不同部位具有不同的化学成分和疗效,茯苓皮、白茯苓、茯神在医学典籍中均有药用记载,但茯苓生长后的代谢废料均被认为无利用价值而被丢弃,造成资源浪费和环境的污染;且松树皮含有大量的多酚,药用价值广泛[16],因此从抗氧化活性研究出发初步做了茯苓代谢废料的应用研究,研究结果为茯苓代谢废料的进一步利用提供研究基础。废物的利用是一个综合且系统的工程,故其生物活性和利用开发有待进一步探讨。
