盐酸小檗碱联合二甲双胍对2型糖尿病合并NAFLD患者体脂成分和肝脏脂肪含量的影响
2021-11-30胡金华胡婷婷王静华俞璟雯王婧张秋玲
胡金华 胡婷婷 王静华 俞璟雯 王婧 张秋玲
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(insulin resistance,IR)和遗传易感性密切相关的代谢应激性肝损伤,已成为目前最常见的慢性肝病。据估计,全球范围内NAFLD的患病率约为24%[1],在2型糖尿病(type 2 diabetes mellitus,T2DM)患者中NAFLD发病率更是高达70%[2]。越来越多的研究表明,T2DM是NAFLD患病的危险因素之一,合并T2DM的NAFLD患者更易且更快发展为肝硬化、肝癌[3]。在生活方式干预的基础上,联合二甲双胍(metformin,Met)治疗NAFLD是科学和值得推广的治疗方案,但目前尚无Met改善NAFLD的病理学循证证据。近年来研究发现,盐酸小檗碱(berberine hydrochloride,BBR)除传统的抗菌、抗炎、镇痛等药理作用以外,还能够抗氧化、调节肠道菌群、改善IR及脂质代谢等[4-5]。药代动力学研究表明,肝脏是BBR的主要靶器官[6],因此,BBR有望成为改善T2DM、NAFLD及其相关糖脂代谢紊乱的共同治疗药物。目前已有小部分研究证实BBR联合Met能改善T2DM合并NAFLD患者血糖、血脂情况[7],但对于内脏脂肪特别是肝脏脂肪含量情况的研究甚少。以此为出发点,本研究将探讨BBR联合Met对T2DM合并NAFLD患者体脂成分和肝脏脂肪含量的影响,为今后的临床工作提供有价值的参考依据。
1 对象和方法
1.1 对象 选取2018年1月至2019年6月杭州师范大学附属医院内分泌科收治的T2DM合并NAFLD患者128例,采用随机数字表法分为观察组和对照组两组。观察组入组66例,退出2例,脱落4例,最终完成试验60例,其中男34例,女26例,年龄30~56(43.21±8.14)岁,BMI(25.47±1.28) kg/m2;对照组入组62例,退出1例,脱落3例,最终完成试验58例,其中男 30 例,女 28 例,年龄 31~54(42.85±6.23)岁,BMI(25.28±1.51) kg/m2。两组患者性别、年龄、BMI等比较差异均无统计学意义(均P<0.05)。本研究经本院医学伦理委员会批准,所有患者及家属均知情同意。
1.2 纳入标准及排除标准
1.2.1 纳入标准 (1)T2DM参照2017版中国2型糖尿病防治指南的诊断标准[8];(2)NAFLD参照2010年1月修订的中华医学会肝病学会脂肪肝和酒精型肝病学组《非酒精性脂肪肝病诊疗指南》(2010年修订版)的诊断标准[9];(3)明确诊断 T2DM 合并 NAFLD,且经过1 000~2 000 mg/d稳定剂量的Met单药稳定治疗 3 个月以上;(4)年龄 18~65 岁,性别不限;(5)糖化血红蛋白(HbA1C)7.0%~10.0%。
1.2.2 排除标准 (1)1型糖尿病、糖尿病急性并发症、合并严重糖尿病慢性并发症者;(2)不能耐受BBR或 Met、出现过敏或其他禁忌证者;(3)合并严重心脑血管、消化系统、呼吸系统疾病等,血肌酐>176.8 μmol/L,肝酶>正常 3 倍者;(4)饮酒过量者,即男性饮酒折合乙醇溶液含量>40 g/d,女性>20 g/d;(5)患有其他引起肝酶异常的疾病者,如病毒性肝炎、肝硬化、药物性肝病、自身免疫性肝病等;(6)存在明确胃肠道疾病者;(7)妊娠及哺乳期女性;(8)患有精神疾病,不能坚持服药、不能配合完成随访者。
1.2.3 退出和脱落标准 (1)受试者服药依从性差(<80%),影响有效性及安全性评价;(2)纳入后患者发生不良反应事件或并发症不宜继续接受试验者;(3)FPG(经过复查)≥13.9 mmol/L者;(4)受试者失联、主要指标缺少、资料明显不全者。
1.3 治疗方法 入选前连续记录3 d的饮食日记,根据每日摄入热卡总数计算每日热卡,在此基础上每日减去500 kcal饮食作为干预期间每日热卡摄入量,每周运动≥4次,总运动时间尽可能在150 min以上。观察组患者口服BBR片(东北制药集团沈阳第一制药有限公司,批号:2200101,0.1 g/片)0.5 g/次,3 次/d,联合原计量Met治疗;对照组患者口服安慰剂模拟片0.5 g/次,3次/d,联合原剂量Met治疗,随访治疗24周。
1.4 观察指标 (1)物理测量:受试患者进行身高、体重测量,计算BMI。(2)实验室指标检测:过夜空腹10 h以上静脉采血,检测FPG、HbA1C、空腹胰岛素(FINS)、血脂(TG、TC、LDL-C、HDL-C),计算胰岛素抵抗指数(HOMA-IR),HOMA-IR(mIU·mmol/L2)=FINS(mIU/L)×FPG(mmol/L)/22.5;肝功能相关指标ALT、AST、γ-谷氨酰基转移酶(GGT)。(3)瞬时弹性成像技术:采用法国Echosens touch502测定肝脏受控衰减参数(CAP)值,并根据数值将脂肪肝分为4级,正常肝脏:CAP<238 db/m;轻度脂肪肝:238 db/m≤CAP<259 db/m;中度脂肪肝:259 db/m≤CAP<292 db/m;重度脂肪肝:CAP≥292 db/m[10]。(4)人体成分分析:采用韩国Biospace Inbody 720人体成分分析仪检测体脂百分比(PBF)、腰臀比(WHR)、内脏脂肪面积(VFA)。
1.5 脂肪肝治疗效果评价 参照《非酒精性脂肪性肝病的中西医结合诊疗共识意见》[11],治疗效果分为痊愈、显效、有效和无效。(1)痊愈:肝脏CAP<238 db/m,ALT及血脂各项指标恢复正常;(2)显效:脂肪肝CAP分级减少2个级别,ALT下降>50%以上,血脂改善达到以下任何一项:TC下降≥20%,TG 下降≥40%,HDL-C上升≥0.26 mmol/L;(3)有效:脂肪肝CAP分级减少1个级别,ALT下降30%~50%,血脂改善达到以下任何一项:TC下降10%~20%,TG下降 20%~40%,HDL-C上升 0.104~0.260 mmol/L;(4)无效:肝脏CAP值显示较前无变化或加重,ALT下降<30%,血脂无明显改善;(5)总有效率=(痊愈+显效+有效人数)/总人数×100%。
1.6 统计学处理 采用SPSS 22.0统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;非正态分布的计量资料以 M(P25,P75)表示,组间比较采用 Mann-Whitney U检验,组内比较采用Wilcoxon秩和检验。有序等级资料采用秩和检验。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者糖脂代谢指标比较 治疗24周后,两组患者 FPG、HbA1C、FINS、TG、TC、LDL-C、HOMA-IR较治疗前均明显下降,观察组HDL-C较治疗前明显升高,差异均有统计学意义(均P<0.05),而观察组FPG、HbA1C、TG、TC、LDL-C、HOMA-IR 较对照组均明显下降,HDL-C明显上升,差异均有统计学意义(均 P<0.05)。见表1。
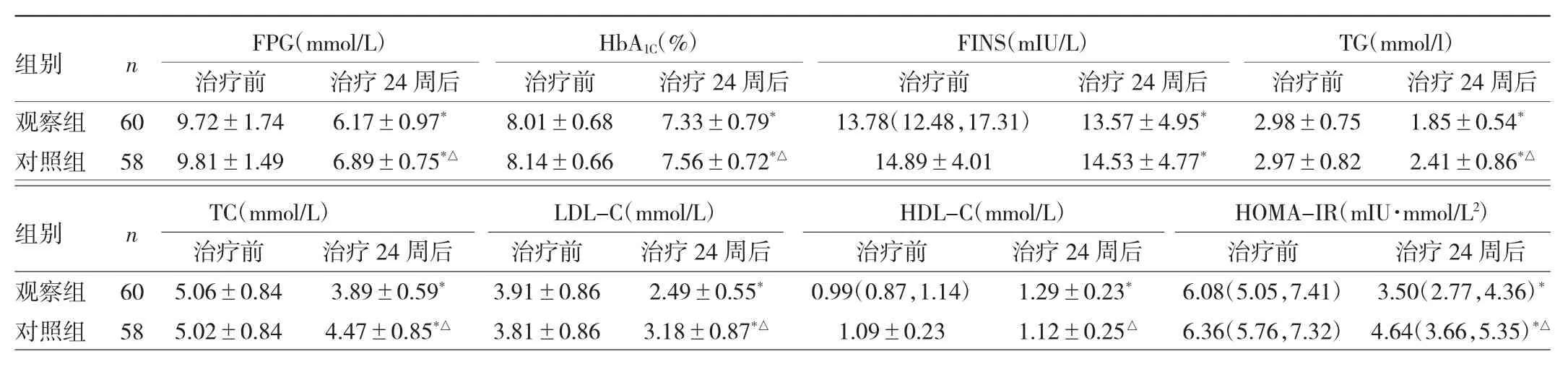
表1 两组患者糖脂代谢指标比较
2.2 两组患者ALT、AST、GGT比较 治疗24周后,观察组ALT、AST、GGT均较治疗前明显下降,差异均有统计学意义(均 P<0.05),而观察组 ALT、AST、GGT均明显低于对照组,差异均有统计学意义(均P<0.05)。见表2。
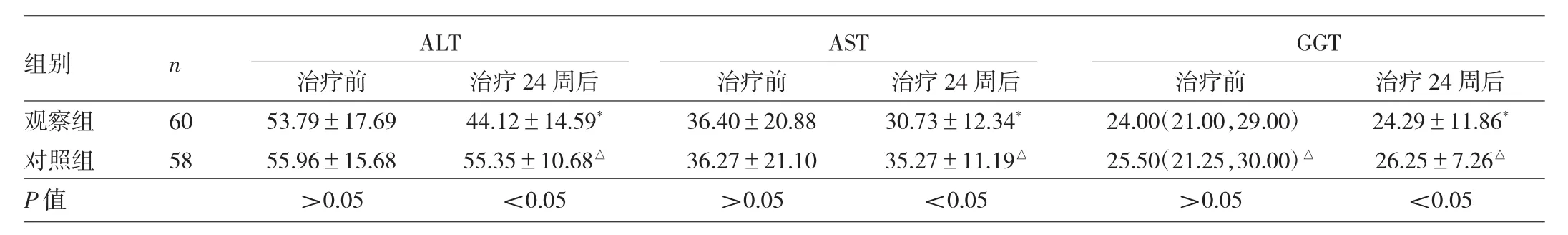
表2 两组患者ALT、AST、GGT比较(U/L)
2.3 两组患者CAP值比较 治疗24周后,两组患者CAP值均较治疗前明显降低,差异均有统计学意义(均P<0.05);观察组CAP值明显低于对照组,差异有统计学意义(P<0.05)。见表3。
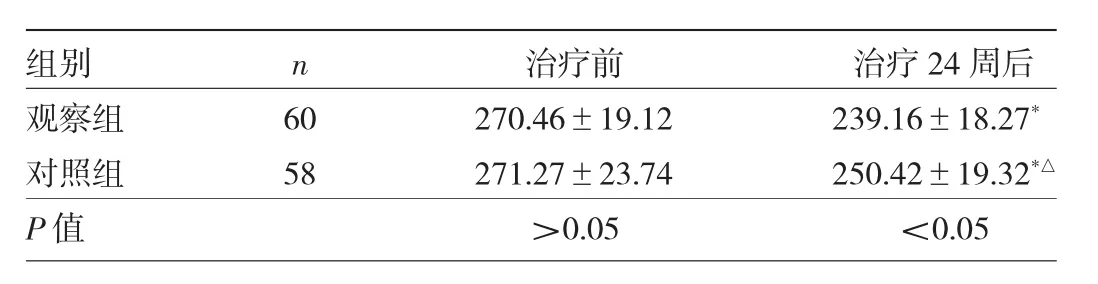
表3 两组患者CAP值比较(db/m)
2.4 两组患者 BMI、PBF、WHR、VFA比较 治疗 24周后,观察组患者BMI、PBF、WHR、VFA较治疗前均明显下降,差异均有统计学意义(均P<0.05),对照组BMI、PBF较治疗前均明显下降,差异均有统计学意义(P<0.05),两组患者 BMI、PBF、WHR、VFA 比较差异均有统计学意义(均P<0.05)。见表4。
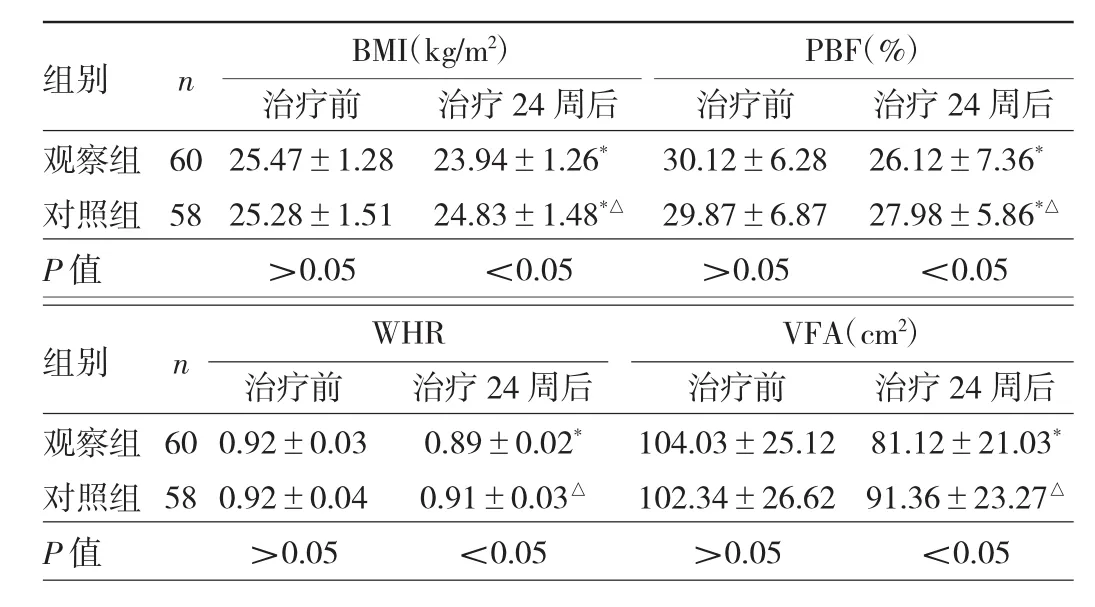
表4 两组患者BMI、PBF、WHR、VFA比较
2.5 两组患者治疗总有效率比较 观察组治疗总有效率明显高于对照组,差异有统计学意义(P<0.05),见表5。
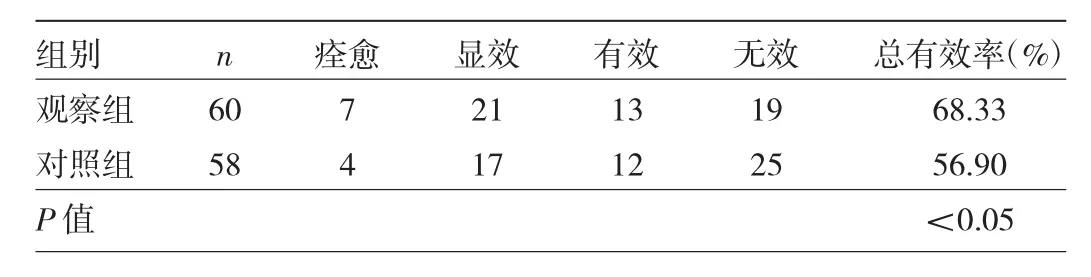
表5 两组患者治疗总有效率比较(例)
3 讨论
随着当今社会人们习惯于高热量饮食和静坐少动的生活方式,T2DM、NAFLD和肥胖等代谢性疾病发病率越来越高。有数据显示,NAFLD可使T2DM的发病概率增加0.33~5.5倍[12],而在已确诊的T2DM患者中,NAFLD的发病率高达57%~80%[2]。T2DM合并NAFLD的患者肝脏脂质沉积伴随脂代谢紊乱,刺激肝脏的IR加重,肝脏糖原分解受到抑制,糖异生代谢发生紊乱,肝脏酶谱异常,脂肪代谢的调节作用在胰岛素的作用下减弱,脂肪酶活性降低,大量游离脂肪酸入血,从而引起内皮功能障碍和全身慢性炎症,加重血糖波动并增加心脑血管和肾脏并发症的发生风险。NAFLD起病隐匿且肝病进展缓慢,临床干预率低下。且目前针对NAFLD的诊治还没有被临床广泛接受,现有的抗炎保肝、胰岛素增敏剂、维生素E等干预药物也还没有取得改善NAFLD的病理学循证证据。
肥胖在T2DM和NAFLD的发生、发展过程中起重要作用,也是引起肝脏IR的重要因素。在针对T2DM合并NAFLD的治疗手段中,减重和改善IR是最重要的首选目标。本研究发现,单用Met或BBR联合Met治疗24周后,患者的BMI都有下降,而观察组减重更加明显,这可能为BBR联合Met对改善IR、降糖、改善肝内脂肪含量和体脂分布打下了基础。众所周知,Met能通过减少肝脏葡萄糖的输出,抑制葡萄糖异生,增加骨骼肌对葡萄糖的利用,提高胰岛素敏感性,从而达到降低血糖和减重的目的。本研究发现,BBR联合Met治疗24周后,患者的HOMA-IR降低比单用Met更明显,提示BBR也具有改善IR的作用。
国内外研究表明,肥胖和体脂分布异常的患者更易发生糖尿病等代谢性疾病[13-14],内脏脂肪蓄积和内脏脂肪组织面积是NAFLD患者肝酶升高的独立危险因素[15],与IR、氧化应激、炎症、糖脂代谢等关系密切。本研究显示BBR联合Met治疗24周后,患者全身体脂分布情况改善,WHR下降,肝脏内脂肪沉积明显减少,脂肪肝病变分级程度也明显改善。结合国内外文献,BBR联合Met减少内脏脂肪可能的机制:(1)BBR能阻断一部分内脏脂肪细胞分化[16],从而使脂肪细胞数目减少,达到减少内脏脂肪沉积、减少肝脏内脂肪含量的作用;(2)BBR和Met调控单磷酸腺苷活化蛋白激酶通路,进一步激活下游参与脂质代谢的相关酶,从而增加脂肪酸氧化[17],且该过程的发生依赖于BBR达到足够高血药浓度。本研究中,BBR剂量0.5 g口服3次/d,多于治疗消化道疾病的剂量,也是取得良好疗效的保证。在调节内脏脂肪方面,BBR与Met的药理作用协同,是联合用药疗效更佳的保证。
本研究通过观察BBR联合Met治疗T2DM合并NAFLD,发现两药联合治疗的减重、降糖、调脂、改善内脏脂肪含量等效果显著。但因研究样本量小,观察时间短,结果有局限性,需进一步探究其最佳药物联合剂量、治疗周期等,复方制剂也是今后的研究方向。
