慢性阻塞性肺疾病与阻塞型睡眠呼吸暂停综合征重叠综合征的临床特征及危险因素
2021-11-30汪亚亚王小军杜延玲栾强强钱小顺
汪亚亚,王小军,杜延玲*,栾强强,钱小顺
(1延安大学附属医院呼吸内科,陕西 延安716000,2中国人民解放军总医院第二医学中心呼吸内科,北京 100853)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种常见的气道阻塞性疾病,其发病率、致残率、病死率均很高[1]。20岁及以上成人COPD患病率为8.6%,40岁以上达13.7%,60岁以上人群患病率已超过27.0%[2]。阻塞型睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)是最常见的一种睡眠呼吸障碍性疾病[3],据Ram等[4]调查,OSAHS的患病率为4.2%。COPD与OSAHS具有相似的影响因素及临床特点,2种疾病可同时或先后发生,1958年Flenley[5]首次将COPD合并OSAHS称为重叠综合征(overlap syndrome,OS)。多年来,由于人们对此病认识不足,各研究纳入的研究对象和诊断方法不同,因此OS的流行病学统计结果不尽相同。研究表明,普通人群中,OS的发病率仅为1%~3.6%,但COPD患者中OS的发病率高达7.6%~55.7%[6]。2种疾病不是简单的重叠,而是一种疾病会加重或恶化另一种疾病,因此2种疾病的重叠具有与单一疾病不同的临床表现与治疗策略。本研究比较单纯COPD与OS患者的临床特征,探究二者的不同之处,以提高临床医师对COPD合并OSAHS的认识,为改善患者预后提供依据。
1 对象与方法
1.1 研究对象
选择2018年10月至2019年12月延安大学附属医院呼吸科就诊的123例COPD患者为研究对象。根据OSAHS的诊断标准,将患者分为2组,单纯COPD组(n=64)和OS组(n=59)。
纳入标准:(1)符合2018年慢性阻塞性肺疾病全球倡议(Global Initiative for Chronic Obstructive Lung Disease,GOLD)指南中COPD诊断标准[7];(2)OS组患者需同时符合2011年OSAHS指南中OSAHS的诊断标准[3];(3)年龄≥40周岁;(4)可配合肺功能检查及整夜多导睡眠监测(polysomno-graphy,PSG);(5)第一秒用力呼气容积占预计值百分比(forced expiratory volume in one second as percentage of predicted volume,FEV1%pred)在30%~80%之间。
排除标准:(1)合并气胸、胸腔积液等胸部疾病;(2)严重肝、肾功能不全;(3)各种恶性肿瘤、血液系统疾病;(4)有肺功能检查及多导睡眠监测禁忌证;(5)长期口服或注射镇静、镇痛类药物。
1.2 观察指标
(1)患者年龄、性别、体质量指数(body mass index,BMI)、颈围、吸烟史、打鼾史等一般资料。(2)动脉血气:pH值、氧分压(partial pressure of oxygen,PaO2)、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)、血氧饱和度(blood oxygen saturation,SaO2)。(3)肺功能:用力肺活量(forced vital capacity,FVC)、第一秒用力呼气容积(forced expiratory volume in one second,FEV1)、第一秒用力呼气容积/用力肺活量(forced expiratory volume in the first second to forced vital capacity,FEV1/FVC)、FEV1%pred。(4)多导睡眠监测:呼吸暂停低通气指数(apnea hypopnea index,AHI)、夜间最低氧饱和度(lowest oxygen saturation,LSaO2)、夜间平均氧饱和度(mean oxygen saturation,MSaO2)、血氧饱和度<90%占检测总时间的百分比(percentage of sleep time with SpO2<90%,Ts90%)。
1.3 统计学处理

2 结 果
2.1 2组患者一般资料比较
单纯COPD组,男性44例,女性20例;年龄(60.67±8.71)岁。OS组,男性45例,女性14例;年龄(59.07±7.97)岁。2组患者年龄、性别比较,差异无统计学意义(P>0.05);OS组BMI、颈围、吸烟史与打鼾史构成比均明显高于单纯COPD组(P<0.05;表1)。
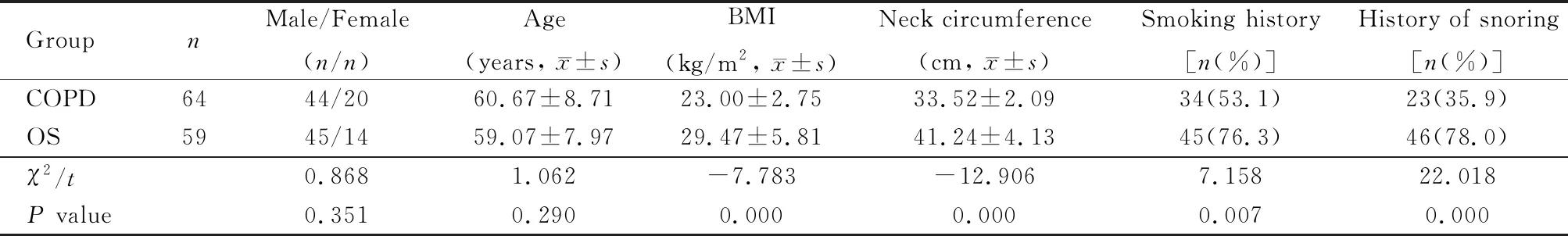
表1 2组患者一般资料比较
2.2 2组患者动脉血气指标比较
2组患者PaO2、PaCO2、SaO2比较,差异有统计学意义(P<0.01);pH值比较,差异无统计学意义(P>0.05;表2)。
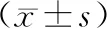
表2 2组患者动脉血气指标比较
2.3 2组患者肺功能指标比较
OS组FEV1/FVC低于单纯COPD组,差异有统计学意义(P<0.05);FEV1、 FEV1%pred及FVC比较,差异无统计学意义(P>0.05;表3)。
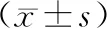
表3 2组患者肺功能指标比较
2.4 2组患者睡眠呼吸障碍相关指标比较
OS组AHI、Ts90%显著高于单纯COPD组;LSaO2、MSaO2显著低于单纯COPD组,差异均有统计学意义(P<0.05;表4)。
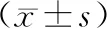
表4 2组患者睡眠呼吸障碍指标比较
2.5 OS组AHI与临床指标的相关性分析
AHI与颈围、BMI、PaCO2呈正相关(r=0.774、0.905、0.761,P<0.05);与FEV1/FVC、PaO2呈负相关(r=-0.597、-0.856,P<0.05;表5)。
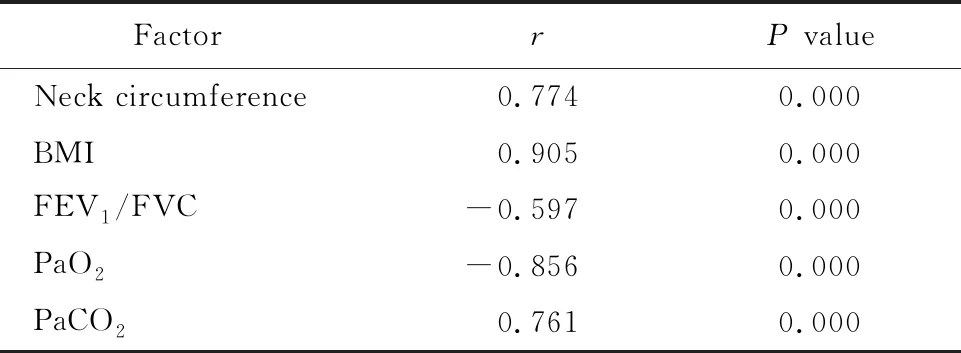
表5 OS组AHI与临床指标的相关性分析
2.6 COPD患者合并OSAHS的危险因素分析
以OS为应变量,对COPD患者合并OSAHS的危险因素进行logistic回归分析,结果显示,颈围(OR=3.453,95%CI2.004~5.948;P=0.000)、BMI(OR=3.467,95%CI2.268~6.696;P=0.000)、打鼾(OR=5.925,95%CI2.622~13.386;P=0.000)、吸烟(OR=2.503,95%CI1.076~5.822;P=0.033)均是COPD并发OSAHS的独立危险因素(表6)。
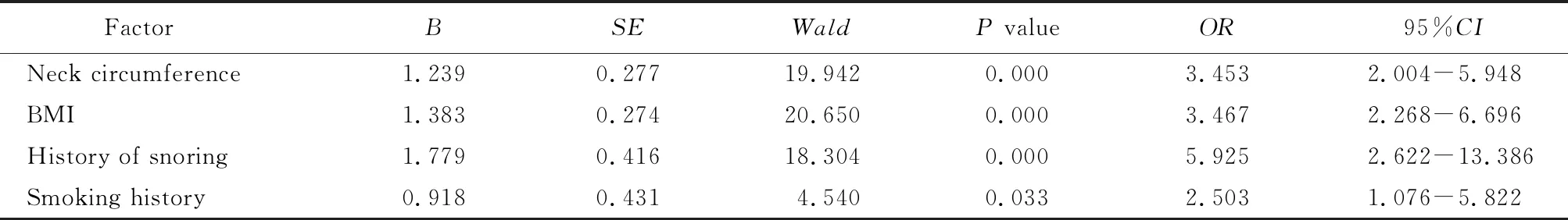
表6 logistic回归分析COPD患者合并OSAHS的危险因素
3 讨 论
COPD和OSAHS的主要病理变化分别发生于上呼吸道和下呼吸道,而上、下呼吸道之间有直接联系,称为气道牵引,故两者存在于同一患者的概率较高。2000年有学者指出30%~40%的COPD患者合并存在OSAHS[8]。Greenberg-Dotan等[9]研究OSAHS、COPD等疾病的发病率发现,OS的发病率存在性别差异,女性多于男性,约占4.3%,OSAHS与COPD发病率均与年龄相关,随着年龄增加,2种疾病的发病率也增加。而本研究结果显示,2组患者年龄、性别分布无显著差异。众所周知,COPD患者男性居多,而OSAHS患者绝经后女性发病率增加,故研究结果不同可能与所研究对象年龄差异及样本量小有关。
BMI和颈围是反映营养状况的指标,本研究结果显示OS患者的BMI、颈围均明显高于单纯COPD患者,国外一些研究结果与本研究结果一致,并发现颈围粗细与OSAHS的病情严重程度呈正相关[10-12],进一步表明了向心性肥胖是引起OS的重要因素。COPD根据病理生理的不同,可分为3种临床表型,即肺气肿表型、慢性支气管炎表型及混合型。临床上发现肺气肿表型的患者往往偏瘦、营养状况差,其合并OSAHS的概率明显降低。Biselli等[13]关于COPD患者肺容积增加对睡眠中上呼吸道阻塞的影响的一项研究结果表明,肺容积增加导致肺过度膨胀,可通过降低睡眠期间的上气道临界闭合压,防止气道塌陷,从而减少OSAHS的发生。慢性支气管炎表型的患者则相反,其往往肥胖,睡眠期间容易引起上气道的阻塞,故更易合并OSAHS。Celli等[14]一项研究显示BMI>24 kg/m2的COPD患者存活率较高,肥胖对于COPD患者来说具有一定的保护性。Vestbo等[15]学者也提出,COPD患者中肥胖患者较体质量正常的患者死亡风险明显降低。但对于OSAHS,肥胖是重要的危险因素,几乎所有OSAHS患者BMI处于超重或肥胖阶段,那么对于单纯的OSAHS患者来说减肥不失为一种有效的治疗办法,所以高BMI对于OS来说可能是一把双刃剑。
本研究结果显示,OS患者中78.0%的患者具有打鼾症状,而单纯COPD患者仅占35.9%,表明打鼾是OSAHS患者的临床特点,故当COPD患者具有打鼾病史时,要注意是否合并OSAHS。OS组的PaO2、SaO2明显低于单纯COPD组,其PaCO2也高于单纯COPD组,说明OS患者存在更严重的低氧血症及高碳酸血症,其机制为OS患者具有更严重的长期睡眠紊乱,导致呼吸中枢驱动力下降,即对低氧及高二氧化碳的敏感性下降,从而形成恶性循环。2种疾病不是简单的重叠,而是一种疾病会加重另一种疾病,OS表现为在持续性缺氧基础上出现间断性缺氧加重,使机体出现一系列病理生理改变,导致多系统损害,显著影响患者的生存质量。
肺功能是评价气道功能的一项重要检查。COPD引起的气道长期慢性炎症导致气道重塑,各种炎症因子破坏支气管黏膜,支气管壁支撑作用减弱,增加了气道阻力及肺泡腔的残气量,最终气流受限致肺功能降低。Onal 等[16]在研究肺功能与睡眠引起的呼吸系统异常的关系中发现,AHI与肺功能之间存在相关性,并指出OSAHS的发生是引起小气道阻塞的危险因素,OSAHS主要是上气道长期阻塞,其牵引作用使下气道逐渐出现异常,从而导致肺功能下降,故COPD患者合并OSAHS时可进一步损害肺功能。在关于OS患者肺功能指标的研究中,多数研究结果认为OS患者较单纯COPD患者存在更严重的气流阻塞,也有部分研究结果显示2组患者肺功能指标无显著差异。本研究中OS组与单纯COPD组FEV1/FVC差异有统计学意义(P<0.05),而FVC、FEV1、FEV1%pred差异均无统计学意义(P>0.05),研究结果的差异可能与研究对象不同有关,但本研究发现,随着患者病情严重程度的加重,其肺功能的下降逐渐加重,可见2种疾病相互影响且彼此加重。
本研究结果显示,OS组AHI、Ts90%显著高于单纯COPD组,LSaO2、MSaO2显著低于单纯COPD组。单纯COPD患者与OS患者均存在睡眠结构紊乱,但本质不同。COPD对睡眠影响较小,患者一般白天缺氧明显,且多由急性加重期感染引起的咳嗽、气短所致,患者由于上气道舒张肌力减弱、对缺氧的反应性减弱等原因,夜间可发生间断性缺氧,但一般程度较轻。而OSAHS患者常发生夜间间断性缺氧,白天无明显缺氧表现,其日间血氧饱和度一般正常。OS患者同时存在COPD及OSAHS,故其表现出两者综合的特点,持续缺氧间断加重,导致睡眠质量明显下降、头痛、白天嗜睡等。
AHI为诊断OSAHS的金标准。线性相关分析结果显示,OS组患者临床各指标与AHI之间具有一定的相关性,AHI与颈围、BMI、PaCO2呈正相关,与FEV1/FVC、PaO2呈负相关,提示颈围宽、肥胖、低氧血症、高碳酸血症均可加重患者病情。将有差异的临床特征进行logistic回归分析后发现,颈围、BMI、打鼾、吸烟是COPD合并OSAHS的独立危险因素。COPD患者颈围越宽、BMI越高,越容易合并OSAHS,这可能是因为肥胖患者咽腔相对狭窄,上气道软组织脂肪堆积、肥厚,气道受到挤压,故而发生更严重的气道阻塞。Steveling等[17]研究表明,BMI与吸烟被证实为COPD合并OSAHS的预测因子,吸烟可增加上呼吸道炎症和水肿,增加上呼吸道阻力。故在上述方面采取措施可更好地治疗疾病、改善预后。
总之,OS患者与单纯COPD患者相比,更易导致缺氧程度加重,发生更严重的低氧血症、高碳酸血症和肺功能下降,进而导致全身多器官损害。本研究结果再次证实,肥胖、吸烟、打鼾是COPD合并OSAHS的独立危险因素,临床上需要及早识别和诊断OS,并予以临床干预,以改善患者临床症状,提高生活质量。
