不同酿酒葡萄品种对小新壳梭孢(N. parvum)的抗性评价及抗性相关酶研究
2021-11-29宋双姜彩鸽王国珍张怡
宋双,姜彩鸽,王国珍,张怡
(宁夏农林科学院植物保护研究所/宁夏植物病虫害防治重点实验室,银川 750002)
宁夏贺兰山东麓以酿酒葡萄种植与加工为主导产业,截止2020年底,酿酒葡萄种植面积达3.28万 hm2,约占葡萄总面积的87%。主栽品种为‘赤霞珠’‘蛇龙珠’‘品丽珠’‘美乐’‘西拉’‘黑比诺’‘霞多丽’‘贵人香’,其中红色酿酒品种占酿酒葡萄面积的90%以上[1]。
葡萄溃疡病(Grape canker)主要由葡萄座腔菌属的真菌(Botryosphaeriasp.)引起,在世界范围内造成重大经济损失[2-4]。病原菌可以在病枝条、病果等组织上越冬,病菌主要通过伤口进行侵染,包括修剪枝条产生的伤口等;新鲜的伤口更容易被病菌侵入,树势弱、负载量大的葡萄树易感[5]。其中小新壳梭孢(N. parvum)是引起葡萄溃疡病的最具攻击性的病原菌之一[6-7],潜伏在葡萄树的细胞和组织中,导致木质部溃疡的形成,造成叶片的黄化和坏死,严重时出现 “死树”,表现枝干溃疡,果梗干枯和掉粒[8-9]。贺兰山东麓葡萄园中溃疡病的发生比例不高,在疏于管理、水肥条件差的葡萄园发生较重。但由于病株呈散点式分布在葡萄园中,极易造成溃疡病流行蔓延的风险。
试验以贺兰山东麓主要酿酒葡萄品种为材料,通过室内刺伤法接种绿枝条,对其进行抗性评价,同时测定接种后各品种叶片内抗性相关酶的活性,以期了解当地主要酿酒葡萄品种的抗病性,为开展酿酒葡萄抗病品种选育提供理论基础。
1 材料与方法
1.1 供试材料
1.1.1 供试品种
13个酿酒葡萄品种:赤霞珠、蛇龙珠、品丽珠、美乐、霞多丽、西拉、马瑟兰、黑比诺、长相思、威代尔、贵人香、小味儿多、维欧尼。
1.1.2 供试菌株
小新壳梭孢(N. parvum)菌株:由北京市农林科学院植物保护环境保护研究所提供。将供试菌株活化后,转入直径90 mm培养皿中的PDA培养基中,在25 ℃的培养箱中培养72 h,距离菌落边缘10 mm处用5 mm消毒打孔器取菌饼,备用。
1.1.3 供试葡萄盆栽苗
‘黑比诺’‘赤霞珠’‘小味儿多’‘霞多丽’4个品种苗盆栽,均来自宁夏欣欣向荣苗木有限公司望洪基地。盆栽苗置于温度不低于20 ℃的温室内,保持湿度,待长势一致,在地上部分有9~10片叶时进行试验。
1.1.4 菌悬液制备
供试菌株活化培养48 h后,挑取单菌落接种于LB液体培养基中,温度25 ℃,振荡频率为200 r/min,摇床过夜培养。将培养好的菌悬液用无菌水调至3×108cfu/mL备用。
1.2 试验方法
1.2.1 离体枝条接种
13个品种的绿枝均采自贺兰金山葡萄种植区。步骤如下:选取1年生健康绿枝,摘除叶片,修剪至30~35 cm并含4~5个节。在距离枝顶15 cm处用5 mm消毒打孔器打孔去除韧皮部,取1.1.2制备好的菌饼接种于伤口处,用保鲜膜包扎保湿,每品种处理10个枝条,重复3次。以同样大小的无菌PDA菌饼作对照。接种后的绿枝下端做马蹄形修剪,顶端平行修剪,插入装有灭菌蛭石的营养钵中,置于温室(光照25 ℃/12 h,黑暗18 ℃/12 h,相对湿度80%)培养,蛭石保持湿润,每天观察枝条发病情况[10-11]。
1.2.2 盆栽苗接种
接种‘黑比诺’‘赤霞珠’‘小味儿多’‘霞多丽’盆栽苗各6株,每株选取大小均匀长势良好的3片叶,将制备好的菌悬液均匀喷在叶上,并套上保鲜袋。在每株葡萄主茎的地上部用解剖刀切1个2 cm2的方形伤口,用沾有菌悬液的脱脂棉裹在伤口处,包上保鲜膜[12-13]。同样用各品种的6株健康苗作对照处理。
1.2.3 盆栽苗抗性相关酶活性测定
于接种10 d后取样。摘取去除病斑和叶脉的叶片,对照取健康植株的相同部位,准确称取鲜样0.5 g用于制备酶粗提液。过氧化氢酶(CAT)活性的测定用紫外分光光度法;超氧化物歧化酶(SOD)活性测定用NBT光还原法;过氧化物酶(POD)活性测定用愈创木酚法[14]。
1.2.4 调查方法与统计分析
抗病性调查:每天观测病害潜育期,在接种后第10天测量病斑长度,观察是否在枝条上产生子实体。试验数据使用Excel 2016和DPS 18.10分析软件进行统计和相关分析。
2 结果与分析
2.1 不同酿酒葡萄品种对N. parvum抗性评价
2.1.1 不同酿酒葡萄品种对N. parvum的抗性分析
根据N. parvum的侵染斑大小和子实体产生有无以及潜育期对13个品种进行抗性分析,其结果如表1。
由表1看出,13个品种对N. parvum的致病性存在显著差异。‘霞多丽’对N. parvum表现为高感,潜育期1 d,病斑大小21.61 cm,接种后不但菌斑扩增很大,而且产生子实体;‘小味儿多’对N. parvum表现为感病,接种潜育期2 d,病斑大小15.21 cm;‘贵人香’‘蛇龙珠’‘赤霞珠’‘马瑟兰’‘西拉’‘美乐’6个品种对N. parvum表现属于中间型;‘维欧尼’‘长相思’‘黑比诺’‘威代尔’‘品丽珠’对N. parvum表现为抗病,接种后菌斑没有扩增或者扩增很小,潜育期长。

表1 N. parvum在13个酿酒葡萄品种上的致病性Table 1 Pathogenicity of N. parvum on 13 wine grape varieties
2.1.2N. parvum在13个品种上侵害的聚类分析
根据聚类分析结果,取阈值为10.75时,13个品种被聚为4类,Ⅰ类:维欧尼、长相思、黑比诺、威代尔、品丽珠;Ⅱ类:贵人香、蛇龙珠、赤霞珠、马瑟兰、西拉、美乐;Ⅲ类:小味儿多;Ⅳ类:霞多丽。由表2可以看出,4大类型品种对N. parvum的抗性存在显著性差异,各类型总体平均值的差异达到极显著水平,抗性大小依次为:Ⅰ类型>Ⅱ类型>Ⅲ类型>Ⅳ类型。

表2 13个酿酒葡萄品种抗性类型Table 2 The types of 13 wine grape cultivars
2.2 各品种接种N. parvum后抗性相关酶活性
2.2.1 CAT活性变化
CAT能催化H2O2分解为H2O和O2,从而减轻过量的H2O2对植物细胞造成的氧化损伤。因此,在抗病性反应过程中H2O2的消耗量可以用来判断CAT在植物抗病性中的作用。由图2可知,接种N. parvum后,各品种叶片中CAT活性都呈上升趋势,且高抗品种‘黑比诺’和抗病品种‘赤霞珠’的CAT活性上升幅度明显高于低抗品种‘霞多丽’和中抗品种‘小味儿多’。接种10 d后,‘黑比诺’‘霞多丽’和中抗品种‘小味儿多’叶片中CAT活性分别上升29.52%、5.06%、19.50%。前人的大量研究表明,CAT活性越强则植物的抗病性也越强。高抗品种‘黑比诺’接种N. parvum后CAT活性与对照相比显著增加;但低抗品种‘霞多丽’增加不显著,且对过氧化氢的亲和力较弱,因此催化H2O2分解成H2O和O2能力较弱,N. parvum抗性较弱。
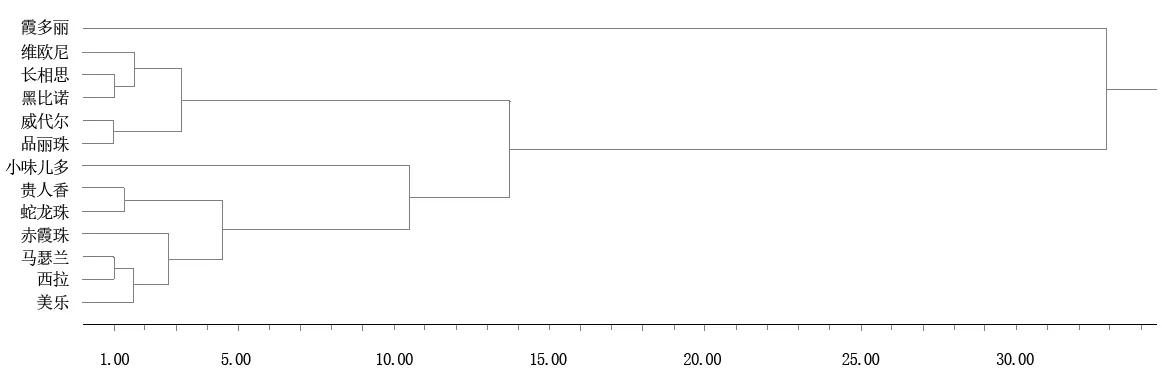
图1 13个酿酒葡萄品种抗N. parvum的聚类分析图Figure 1 Clust pedigree figure for N. parvum resistance in 13 wine grape cultivars according to resistant indexes
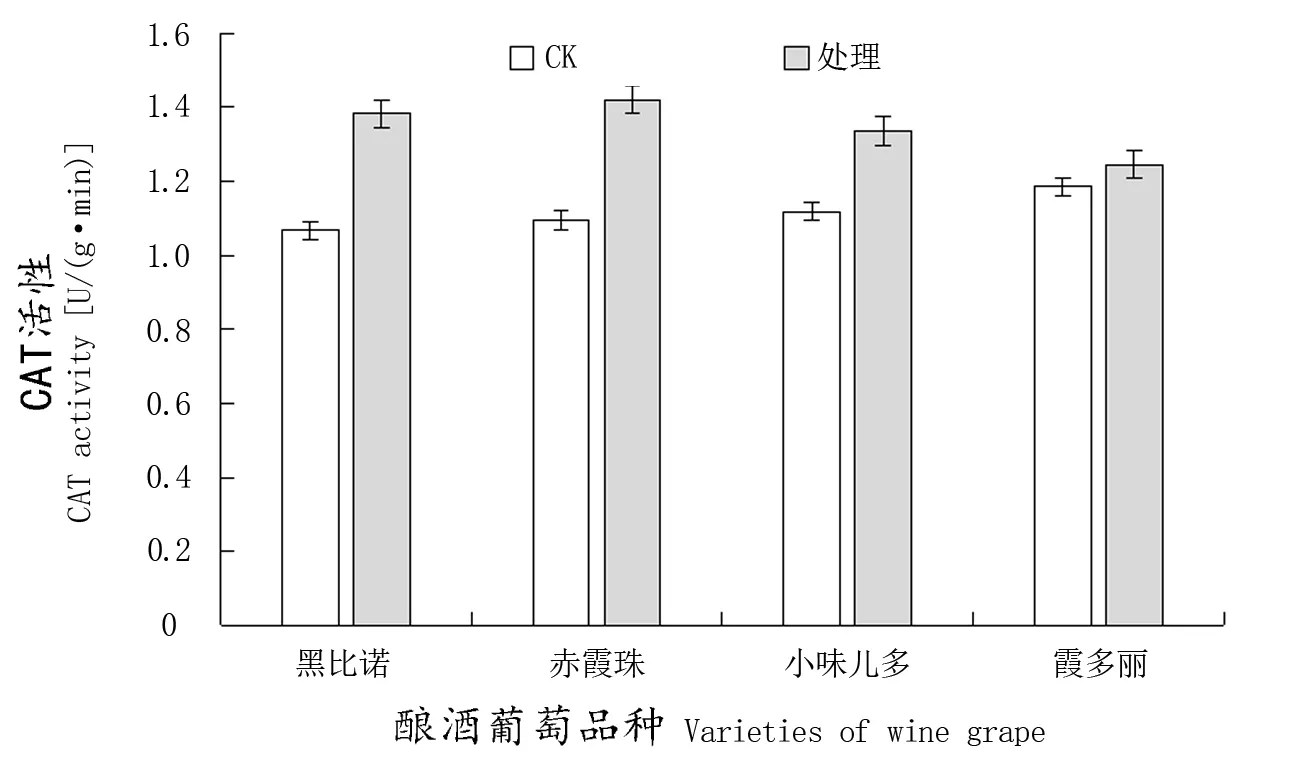
图2 感染N. parvum后葡萄叶片CAT活性的变化Figure 2 Change of CAT activity in leaves of different varieties inoculated with N. parvum
2.2.2 SOD活性变化
植物体内存在的SOD是一种典型的诱导酶,逆境条件是植物体内SOD活性变化的重要诱因。由图3可知,接种N. parvum后,各品种叶片中SOD活性都升高,SOD活性上升幅度最大为高抗品种‘黑比诺’(92.79%),其次是抗病品种‘赤霞珠’(85.58%),上升幅度最小的为低抗品种‘霞多丽’(45.61%)。多数研究认为,SOD活性与抗病性存在正相关。本试验结果表明,枝条接种N. parvum后,各品种的SOD活性均有升高的趋势,这是因为加速了病原菌胁迫植物产生的超氧阴离子自由基歧化分解为分子氧和过氧化氢的过程,因此高抗品种‘黑比诺’比低抗品种‘霞多丽’升高幅度更大。
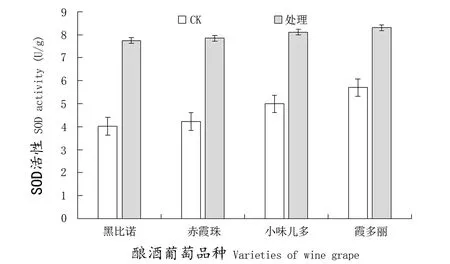
图3 感染N. parvum后葡萄叶片SOD活性的变化Figure 3 Change of SOD activity in leaves of different varieties inoculated with N. parvum
2.2.3 POD活性变化
一般认为,在植物被病原菌感染后,POD活性明显增强。高活性的POD能催化杀菌物质的合成,提高木质素和木栓质的生物合成,形成物理屏障,并参与乳突期。POD活性的大小与果实抗病性的形成和颗粒状沉积物的积累,以及寄主抗病性的增强有关。因此,POD经常被用作植物抗性强弱的重要指标。由图4可知,感染N. parvum后,各酿酒葡萄品种叶片中POD活性都升高,高抗品种‘黑比诺’上升幅度较大,POD活性比接种前上升74.34%;中抗品种‘小味儿多’叶片中POD活性上升较缓慢,POD 活性比接种前上升59.59%;低抗品种‘霞多丽’POD活性上升幅度较小,POD 活性分别比接种前上升30.81%。本试验表明:4个酿酒葡萄品种接种N. parvum后POD活性水平显著高于对照。高抗品种‘黑比诺’比低抗品种‘霞多丽’上升的幅度更大。
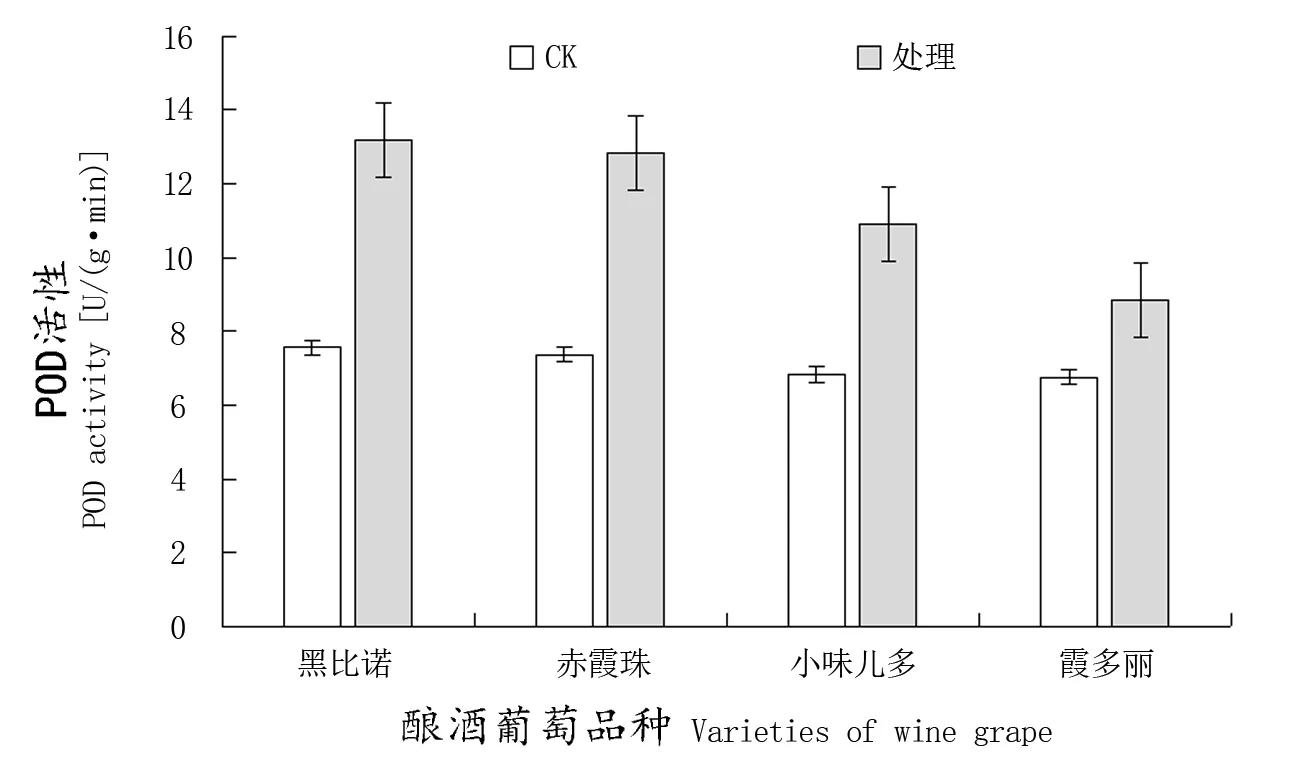
图4 感染N. parvum后葡萄叶片POD活性的变化Figure 4 Change of POD activity in leaves of different varieties inoculated with N. parvum
3 讨论与结论
不同酿酒葡萄品种对N. parvum的抗性差异显著。然而,关于酿酒葡萄品种的抗病性等级标准尚未见报道,该标准的确定对与酿酒葡萄抗病性研究尤为重要。本研究通过对13个酿酒葡萄品种的抗性评价发现,接种N. parvum后,抗病品种‘黑比诺’病斑扩展速度慢,显症时间晚,于接种后4 d出现轻微病斑,10 d后达到最大且不再扩展;而‘霞多丽’显症时间早(1 d),病斑扩展速度快。‘黑比诺’的病斑长度最小平均为9.00 cm,而‘霞多丽’病斑长度最大平均为21.61 cm,说明‘黑比诺’表现出的抗性强于‘霞多丽’,这与我们在田间观察到的结果相一致。对溃疡病N. parvum的聚类分析结果进行综合分析,筛选出对N. parvum抗性较好的品种,对酿酒葡萄品种的推广具有指导意义。根据不同地区的葡萄溃疡病病原菌种类和发生程度,选用使用抗性强的品种。
植物体内存在自由基清除系统,该系统包括酶保护系统和非酶保护系统。CAT、SOD和POD作为酶保护系统的一部分,在抵御病原侵染和作用胁迫方面发挥着重要作用[15]。植物抗病性是在寄主与病原体相互作用过程中产生的一系列生理和生化效应,而高抗品种的反应常常比低抗品种的反应更为强烈。本试验中‘黑比诺’叶片内CAT、SOD和POD活性明显高于‘霞多丽’,就证实了这一点。
本研究中高抗品种在感病后CAT、SOD和POD的活性均显著提高,且高于低抗品种,与抗病性成正相关。大量研究表明,CAT活性越强则植物的抗病性也越强[16-19]。本研究中,抗病性较强的‘黑比诺’和‘赤霞珠’接种后CAT活性比对照显著增加,但‘小味儿多’和‘霞多丽’增加不显著。POD参与木质素的合成,细胞壁木质化程度高对病原菌的侵染和扩展有一定的限制作用。抗病品种叶片受病原菌侵染后POD活性升高,可能有利于木质素的合成,从而增强其抗侵染或扩展的能力[17]。虽然感病品种发病后叶片的酶活性也有所上升,但上升幅度不大,可能不利于木质素的合成。本试验表明,不同酿酒葡萄品种接种N. parvum后POD活性水平均高于对照,在‘黑比诺’中远高于‘霞多丽’。SOD是对抗活性氧的“第一道防线”,当病原菌感染时,SOD活性升高,消除病原菌刺激产生的自由基,使细胞内维持一个有利于生长的稳定环境[18]。试验表明,枝条接种N. parvum后,不同酿酒葡萄品种的SOD酶活性均有明显的升高趋势,高抗品种上升的幅度比低抗品种上升幅度更大。
