五个欧亚种酿酒葡萄果实类黄酮及香气物质差异分析
2021-11-29赵一凡彭文婷李惠清郭玉婷王军
赵一凡,彭文婷,李惠清,郭玉婷,王军
(中国农业大学食品科学与营养工程学院葡萄与葡萄酒研究中心/农业农村部葡萄酒加工重点实验室,北京 100083)
关键字:酿酒葡萄;花色苷;黄酮醇;黄烷-3-醇;挥发性香气化合物
类黄酮类化合物是葡萄中重要的酚类物质,主要存在于葡萄的外果皮和种子中,包括花色苷、黄酮醇和黄烷醇等,对葡萄和葡萄酒的风味具有重要作用。花色苷是红葡萄和红葡萄酒颜色的主要来源,以C6-C3-C6为骨架,C环上C3位羟基经过糖苷化反应形成[1],花色苷可进一步被酰基化修饰,生成乙酰化、香豆酰化和咖啡酰化的花色苷[2],极大地丰富了花色苷的种类。黄酮醇主要以糖苷形式存在于葡萄的果皮中,能够抵御紫外线对葡萄果实的伤害,清除氧自由基[3],也可以与花色苷结合形成复合物,对葡萄酒起到辅色作用[4]。黄烷醇包括黄烷-3-醇单体和聚合黄烷-3-醇(原花色素),主要存在于葡萄的果皮和种子中,是葡萄中含量最丰富的类黄酮类物质,赋予葡萄酒以收敛性[5]。
香气物质主要包括萜烯类、吡嗪类、降异戊二烯、醇类、醛酮类和酯类等,是评判葡萄果实和葡萄酒品质的重要指标之一。在葡萄果实中通常以游离态和结合态两种形式存在,其中游离态组分对香气有直接贡献,结合态香气没有挥发性,但可以在葡萄酒酿造过程中被糖苷酶水解而释放出游离态的苷元,通过累加、协同、抑制等相互作用对葡萄酒的风味质量和典型性起作用[6]。
类黄酮和香气物质作为评价葡萄和葡萄酒质量的重要参数,其种类和含量受到基因型的影响。山葡萄总花色苷含量远高于欧亚杂种,主要为花色苷双糖苷[7],不同颜色的葡萄品种中花色苷含量和比例存在差异[8],不同欧亚种酿酒葡萄酚类物质含量也存在差异,各有特点[9-12],种、品种和营养系之间的差异还导致香气组成上的不同[13]。我国山葡萄‘双红’‘双优’‘双丰’中C6/C9类挥发性香气物质含量显著高于欧亚种葡萄[7],‘黑比诺’4个营养系的果实香气中,2,6-二叔丁基对苯醌和n-十六酸的含量有很大差异[14]。除上述内因外,类黄酮和香气物质的种类和含量还受到光照[15-16]、水分[17-18]、温度等[19-21]环境因素和疏穗[22-23]、摘叶[24-26]、避雨棚[27]等栽培措施的影响。虽然类黄酮及香气物质的组成和含量因受外部环境因素的影响差别很大,但是不同品种的基因型是造成类黄酮及香气物质存在差异的关键因素。例如,部分葡萄品种的花色苷组成较为稳定,不易受年份的影响[28],而且果皮所含花色苷的种类及比例在一定程度上表现出葡萄的品种特性,因此可在某种条件下利用不同品种花色苷含量和组成的差异来区分葡萄品种甚至株系[7,29-30]。具有特殊的“黑胡椒”气味的莎草奥酮是澳洲‘西拉’葡萄所酿造葡萄酒的特征香气物,莎草奥酮的形成是因为萜烯合成酶基因VvTPS24的等位基因——倍半萜烯合成酶基因VvGuaS在葡萄果实中的不同表达,从而引起不同品种间萜烯物质含量差异[31]。
本研究利用高效液相色谱-质谱联用(HPLC-MS)和气相色谱-质谱联用(GC-MS)技术对‘马贝克’‘马瑟兰’‘美乐’‘小味儿多’和‘西拉’5个欧亚种红色酿酒葡萄的类黄酮和香气物质进行了检测,分析其类黄酮及香气物质组成和含量差异,为酿酒葡萄品种鉴定和利用提供参考。
1 材料与方法
1.1 材料和试剂
1.1.1 试材
本试验所用‘马贝克’‘马瑟兰’‘美乐’‘小味儿多’和‘西拉’葡萄果实采自中国农业大学上庄实验站智能玻璃温室(40°08′12″N,116°10′45″E),除‘西拉’为2014年定植外,其余品种均定植于2013年。南北行向,栽培密度为4 m×1 m,主干高度为2.2 m,水平叶幕,每株留梢量为20~40个。
在葡萄果实成熟期(E-L38)进行采样,每个品种随机采取300粒发育良好且无病害的浆果,重复3次,放于冰盒中迅速运回实验室。每个样品一部分用于果实基本理化指标的检测,另一部分液氮速冻后保存于-40 ℃冰箱中,用于果实类黄酮和香气物质的分析。
1.1.2 试剂
色谱级甲醇、甲酸和乙腈,Fisher公司;D-(+)-葡萄糖酸δ-内酯、二甲花翠素-3-O-葡萄糖苷、槲皮素-3-O-葡萄糖苷、(+)-儿茶素、(−)-表儿茶素、(−)-表棓儿茶素、(−)-表儿茶素没食子酸酯和1-己醇、月桂烯、柠檬烯、里那醇、α-萜品醇、β-香茅醇、柠檬醛、香叶基丙酮、4-甲基-2-戊醇等香气标准品,Sigma-Aldrich公司;固相萃取柱Cleanert PEP-SPE,Bonna-Agela公司。
1.2 仪器与设备
手持糖度计:Atago公司;pH计:赛多利斯有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;冷冻干燥机:北京博医康实验仪器有限公司;Micro 17R离心机:赛默飞世尔公司;Agilent 1100系列配有二极管阵列检测器(DAD)的LC/MSD Trap-VL高效液相色谱-离子阱质谱联用仪、Agilent 1200系列LC/MSD Trap-VL高效液相色谱-三重四级杆质谱联用仪、Agilent 1200系列配有可变波长检测器(VWD)的高效液相色谱串联Bruker系列离子阱质谱联用仪、Agilent 6890 GC和Agilent 5975 MS气相色谱与质谱联用仪(GC-MS):美国Agilent公司。
1.3 试验方法
1.3.1 理化指标检测
每个品种每个生物学重复随机取100粒浆果,称量粒质量;然后取果汁用于可溶性固形物、pH和可滴定酸等理化指标的检测。可溶性固形物和pH值分别用手持糖度仪和pH计检测,可滴定酸用酸碱滴定法测定,以酒石酸当量表示,单位g/L。
1.3.2 花色苷和黄酮醇提取与检测
(1)花色苷和黄酮醇提取。每个品种每个生物学重复各取100粒浆果,液氮速冻后,手工剥皮。将剥下的果皮和种子低温研磨成粉,再放于-40 ℃的真空冷冻干燥机中冷冻干燥至恒重,并将冻干粉保存于-40 ℃的冰箱待用。
花色苷和黄酮醇的提取参照Downey等[32]。准确称取0.100 g果皮干粉放入2 mL离心管中,加入1 mL50%甲醇水溶液,低温避光超声萃取20 min后,在4 ℃的条件下8000 r/min离心5 min。然后将上清液转移于新的离心管中,重复上述操作,将两次提取的上清液充分混匀并保存在-40 ℃冰箱。
(2)花色苷检测。采用Agilent 1100系列液相色谱-离子阱质谱联用仪,色谱柱为Kromasil C18色谱柱,柱温50 ℃,进样量30 μL,检测波长525 nm,流速1 mL/min。洗脱流动相A和流动相B分别为水∶甲酸∶乙腈=92∶2∶6(Vol)和水∶甲酸∶乙腈=44∶2∶54(Vol)。洗脱程序为:0 min,0% B;1 min,10% B;18 min,25% B;20 min,25% B;30 min,40% B;35 min,70% B;40 min,100% B。
质谱采用电喷雾离子源(ESI),正离子模式,离子扫描范围为100~1500 m/z,雾化器压力为30 psi,干燥气流速为10 L/min,温度为325 ℃,每个样品重复进样2次。花色苷定量采用外标法,外标物为二甲花翠素-3-O-葡萄糖苷,花色苷含量均以二甲花翠素-3-O-葡萄糖苷的含量计,单位为mg/kg FW。花色苷定量标准曲线为Y=59.221X+16.1128(R2=0.9989)。
(3)黄酮醇检测。采用Agilent 1200系列高效液相色谱仪串联Bruker系列离子阱质谱仪,色谱柱为Zorbax SBC18。柱温为40 ℃,进样量为50 µL,检测波长为360 nm。流动相A为乙腈∶甲酸∶水=50∶85∶865,流动相B为乙腈:甲醇∶甲酸∶水=250∶450∶85∶215,流动相的流速为0.63 mL/min。洗脱程序如下:0 min,0% B;24.2 min,14.2% B;27 min,15.7% B;33.4 min,18.8% B;39 min,23.5% B;45 min,26% B;47 min,27.4% B;51.6 min,32% B;61.8 min,40% B;67.8 min,100% B;78.4 min,0% B。
质谱采用电喷雾离子源(ESI),负离子模式,离子扫描范围为0~1000 m/z,雾化气压力为30 psi,干燥气流速为10 L/min,温度为325 ℃。黄酮醇定量采用外标法,外标物为槲皮素-3-O-葡萄糖苷,黄酮醇以槲皮素-3-O-葡萄糖苷的含量计,单位为mg/kg FW。黄酮醇定量标准曲线为Y=59.029X-42.801(R2=0.9970)。
1.3.3 黄烷醇提取与检测
(1)黄烷醇提取。游离黄烷醇提取参照梁娜娜[33]。准确称取0.100 g果皮或种子的冻干粉于2 mL离心管中,加入1 mL含0.5%抗坏血酸的70%丙酮水溶液,充分震荡5 min后在4 ℃的温度下以8000 r/min离心10 min,后将上清液转移至新的5 mL离心管中。重复两次上述步骤,将3次提取的上清液合并,取400 µL加入新的2 mL离心管中,在常温避光条件下进行氮吹直至完全吹干,然后先后加入200 μL含1%盐酸的甲醇和200 μL的0.2 mol/L乙酸钠水溶液进行溶解、中和,最后将提取液保存于-40 ℃冰箱中待用。
裂解黄烷醇的提取方法参照梁娜娜等[33]。准确称取0.050 g果皮或种子的冻干粉于2 mL离心管中,加入500 μL间苯三酚缓冲液(0.5%抗坏血酸,0.3 mol/L盐酸,50 g/L间苯三酚甲醇),在50 ℃的条件下避光水浴20 min后,加入500 μL的0.2 mol/L乙酸钠终止反应,充分混匀后在4 ℃条件下8000 r/min离心15 min,将上清液转移至新的5 mL离心管中,重复两次上述步骤,合并3次提取的上清液,并保存于-40°C的冰箱中待用。
(2)黄烷醇检测。黄烷醇采用Agilent 1200系列高效液相色谱-三重四级杆质谱联用仪进行定量检测。色谱柱为Poroshell 120 EC-C18column。柱温为55 ℃,进样量为1 µL,检测波长为280 nm,流速为0.4 mL/min。流动相A为0.1%甲酸水溶液,流动相B为含0.1%甲酸的50%甲醇乙腈溶液。洗脱程序如下:0~28 min,10%~46% B;28~29 min,46%~10% B。
质谱采用电喷雾离子源,负离子模式,雾化气压力为35 psi,干燥气流速12 L/h,温度350 ℃,喷雾电压4 kV,采用多反应监测模式(MRM)对目标化合物进行分析。黄烷醇定量时,4种黄烷醇的含量分别以儿茶素(C)、表儿茶素(EC)、表棓儿茶素(EGC)和表儿茶素没食子酸酯(ECG)为外标物进行计算,单位为mg/kg FW。
定量标准曲线,儿茶素:Y=965.16X+558.87(Y<20 000,R2=0.9997),Y=526.93X+17 110(Y≥20000,R2=0.9972);表儿茶素:Y=1407.6X+929.52(Y<30 000,R2=0.9992),Y=444.48X+28 086(Y≥30 000,R2=0.9991);表儿茶素没食子酸酯:Y=2850.6X+3503.3(Y<50 000,R2=0.9981),Y=710.51X+137 514(Y≥50 000,R2=0.9979);表棓儿茶素:Y=19.42X-28.647(R2=0.9981)。
1.3.4 香气物质提取与检测
(1)香气物质提取。游离态香气物质提取:从-40 ℃的冰箱中取出样品,每个品种取果实50 g,液氮速冻后,除去果柄和种子,加入0.5 g D-(+)-葡萄糖酸内酯和2 g聚乙烯聚吡咯烷酮(PVPP)后将果皮和果肉研磨成粉末,并置于4 ℃冰箱中静置浸提4 h。后在4 ℃下以8000 r/min的转速离心15 min得到澄清葡萄汁,一部分直接用于检测游离态香气,另一部分用于提取糖苷结合态香气物质。
结合态香气物质的提取:葡萄果实糖苷结合态香气物质的提取参照兰义宾等[34]。在活化后的固相萃取柱中加入1 mL上述澄清葡萄汁,然后依次加入5 mL的蒸馏水和5 mL的二氯甲烷,最后用20 mL甲醇将结合态的香气物质洗脱下来并收集洗脱液至50 mL的圆底烧瓶内。用真空旋转蒸发仪蒸干上述洗脱液,然后用5 mL 0.2 mol/L柠檬酸/磷酸氢二钠缓冲液(pH=5)重新溶解,转移至新离心管中,加入100 μL 100 mg/L的糖苷酶(AR 2000),置于40 ℃培养箱中16 h。
(2)香气物质检测。利用本实验室已优化的顶空固相微萃取-气相质谱(HS-SPME-GC/MS)联用方法分析葡萄果实中的香气物质[35-36]。
将5.0 mL上述提取的澄清葡萄汁加入到20 mL香气进样瓶中,加入1.00 g NaCl和10 μL 1.0018 mg/mL的内标溶液(4-甲基-2-戊醇),并迅速用带有聚四氟乙烯隔垫的盖子拧紧,置于CTC-PAL自动进样装置上加热搅拌30 min。然后将已活化的SPME萃取头插入进样小瓶的顶空部分,在40 ℃下继续加热搅拌30 min,待挥发性成分在液体、顶空和SPME三相中达到平衡时,取出SPME萃取头,立即插入GC/MS进样口,在250 ℃条件下解析8 min。每个样品萃取两次。
所用毛细管柱为HP-INNOWAX(60 m×0.25 mm ×0.25 μm),载气为高纯氦气,流速为1 mL/min。升温程序如下:50 ℃保持1 min,以3 ℃/min升温至220 ℃保持5 min。其他条件如下:进样口温度250 ℃,采取不分流模式,电离方式为电子轰击离子源,电离能70 ev,离子源温度230 ℃,质谱接口温度280 ℃,质量扫描范围30~350 u。
挥发性香气物质定性分析根据NIST08标准谱库中的保留指数和质谱信息进行,采用内标法进行定量分析。对于有标准品的香气物质根据其标准曲线进行定量,对于没有标准品的香气物质利用具有相同化学结构或相近碳原子数的标准品进行相对定量,葡萄果实中香气物质的含量表示为μg/kg FW。
1.4 数据处理
采用Microsoft Office Excel 2019软件进行数据的整理,平均值、标准差和单因素方差分析均采用SPSS 23.0软件处理。采用Origin 9.0软件对果皮中的花色苷和黄酮醇的数据进行作图分析。采用SIMCA 14.0进行正交偏最小二乘法判别分析(OPLS-DA)。
2 结果与分析
2.1 果实理化指标
表1为供试酿酒葡萄品种成熟期果实的可溶性固形物、pH、可滴定酸和百粒浆果质量等基本理化指标的检测结果。5个酿酒葡萄品种的可溶性固形物含量介于18.35%~21.60%,其中‘西拉’的可溶性固形物最高,‘马贝克’的可溶性固形物最低,比‘西拉’低3.25%。供试品种果汁pH在3.22~3.69,可滴定酸含量在6.74~9.0 g/L,其中‘美乐’葡萄果实的酸度较高,可滴定酸含量最大,pH较低,为3.32。比较5个品种的浆果质量可以看出,‘马贝克’的百粒浆果质量最大(162.39 g),其次是‘西拉’和‘美乐’,而‘马瑟兰’和‘小味儿多’的浆果质量较小。
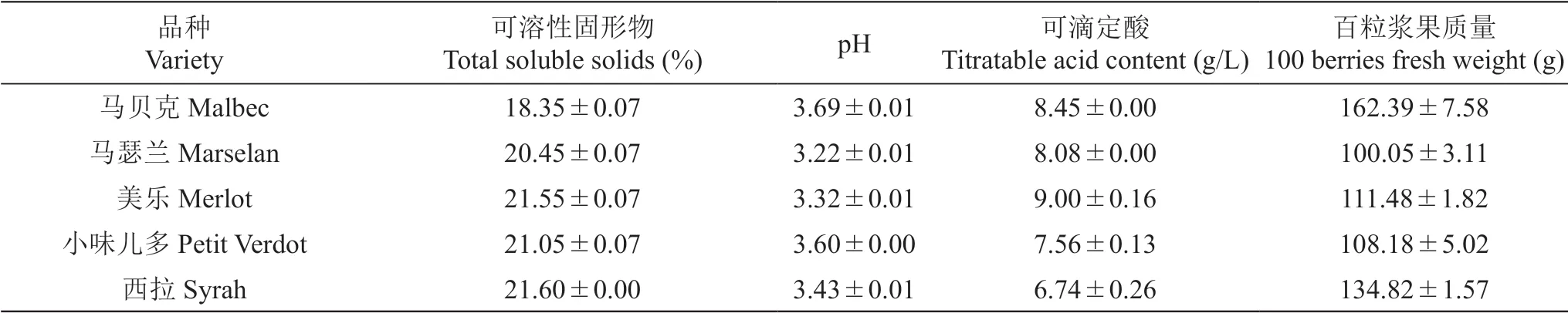
表1 五个酿酒葡萄品种果实理化指标Table 1 Physiochemical parameters of five winegrape varieties
2.2 花色苷
对5个供试酿酒葡萄品种果皮中不同花色素类花色苷的含量进行分析(表2),其中,‘马瑟兰’的总花色苷含量最大,为1379.98 mg/kg FW;‘美乐’的总花色苷含量最小,约为‘马瑟兰’总花色苷含量的24%,显著低于其余4个品种。所有供试品种均含有丰富的二甲花翠素-3-O-葡萄糖苷、二甲花翠素-3-O-乙酰葡萄糖苷和二甲花翠素-3-O-反式香豆酰葡萄糖苷等花色苷,其中‘马瑟兰’的二甲花翠素-3-O-葡萄糖苷的含量最大,为478.53 mg/kg FW。
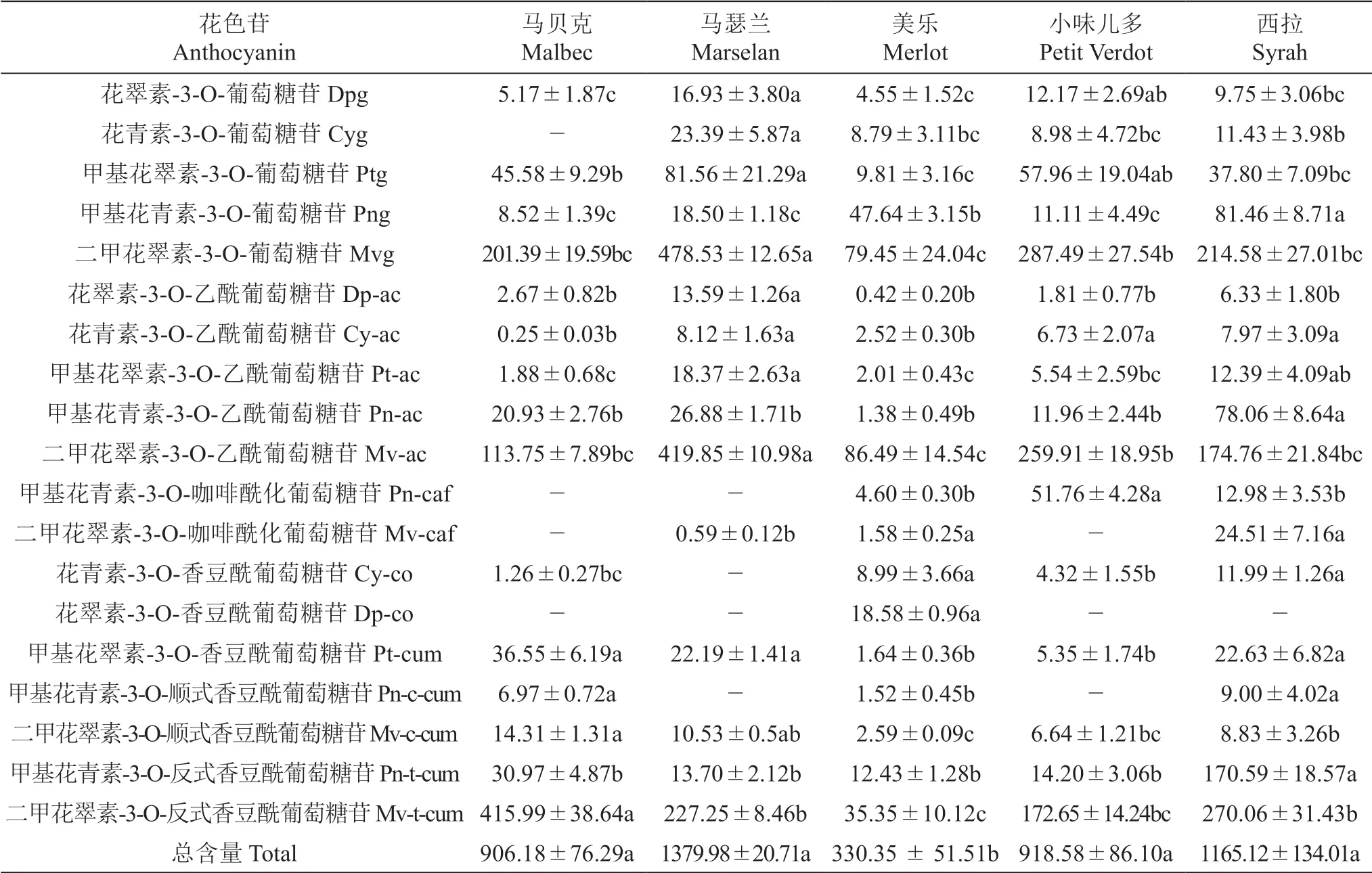
表2 五个酿酒葡萄品种果皮中花色苷含量Table 2 The anthocyanin content in the skin of five winegrape varieties mg/kg FW
对供试品种果皮花色苷的种类进行分析(图1 A),发现在检测到的花青素类、花翠素类、甲基花青素类、甲基花翠素类和二甲基花翠素类等5种类型的花色苷中,所有品种中均以二甲花翠素类花色苷为主,其次为甲基花青素类花色苷或甲基花翠素类花色苷,而花翠素类花色苷和花青素类花色苷的积累量较少。二甲花翠素类花色苷在‘马贝克’‘马瑟兰’和‘小味儿多’中的相对含量较高,而‘美乐’和‘西拉’中二甲花翠素类花色苷的相对含量较低。甲基花青素类的花色苷在‘美乐’和‘西拉’的总花色苷中占较高比例,如‘西拉’中的甲基花青素-3-葡萄糖苷的含量为352.09 mg/kg FW,显著高于其他品种,是它们的4~6倍,占到总花色苷含量30%以上,而大多数品种中的花青素类花色苷或花翠素类花色苷的含量低于30 mg/kg FW,且不足总花色苷含量的3%,品种间差异明显。
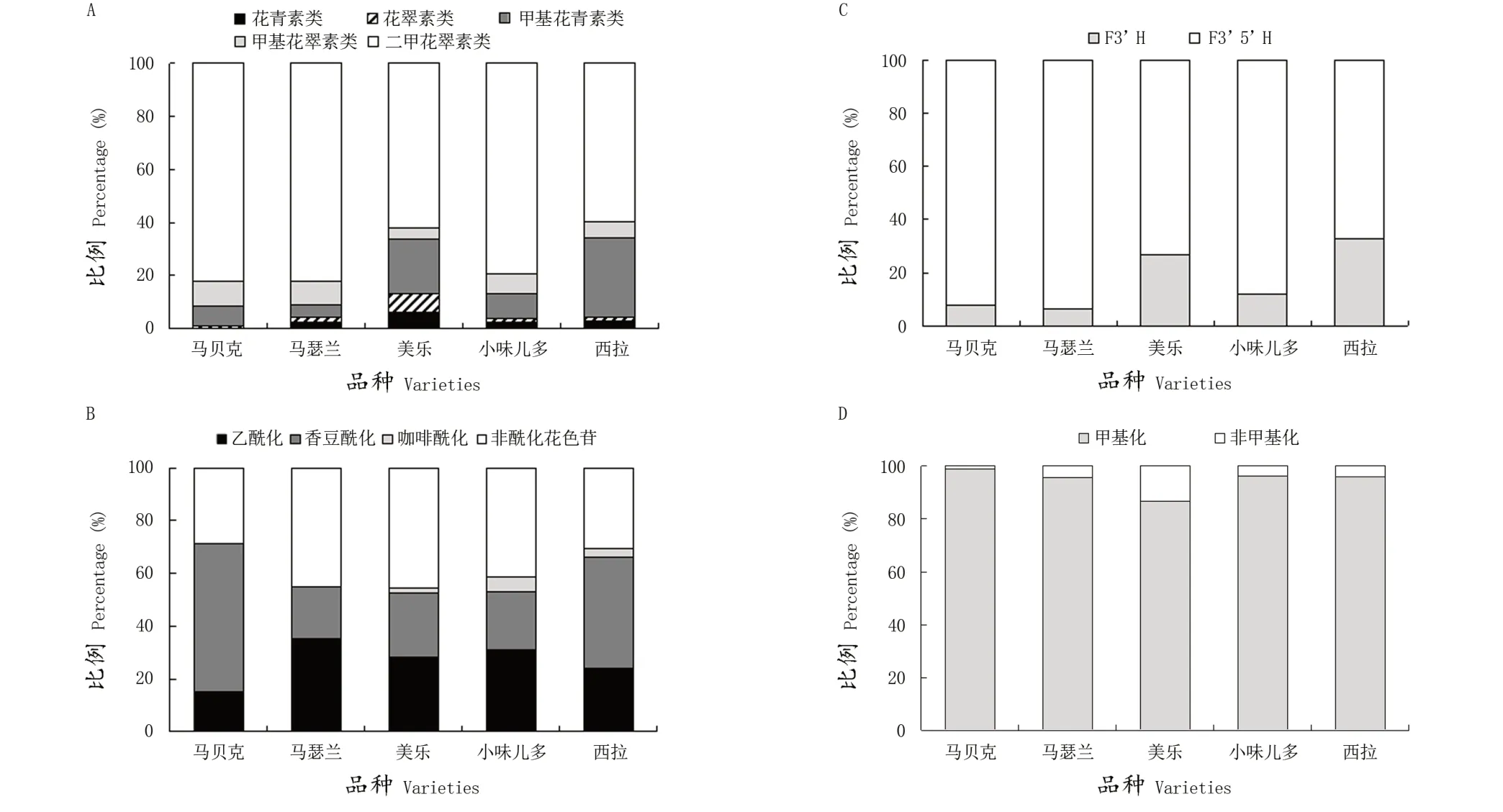
图1 五个酿酒葡萄品种果皮花色苷种类(A)、酰化类型(B)、产生路径(C)和甲基化类型(D)占比Figure 1 Composition of anthocyanins in the skin of five wine grape varieties
由图1 B可知,不同种类酰化花色苷含量存在较大差异,所有供试品种中的酰化花色苷含量均占到总花色苷含量的一半以上,其中‘马贝克’和‘西拉’的酰化花色苷占比较大,其次为‘小味儿多’,而‘马瑟兰’和‘美乐’的酰化花色苷的占比较小。在花色苷酰化类型上,咖啡酰化的花色苷相对于乙酰化和香豆酰化的花色苷占比最小,‘马贝克’和‘马瑟兰’中几乎未检测到咖啡酰化的花色苷,‘马贝克’和‘西拉’中香豆酰化花色苷所占的比例高于乙酰化,分别是乙酰化花色苷的4倍和2倍,而‘马瑟兰’‘美乐’和‘小味儿多’的乙酰化花色苷所占的比例高于香豆酰化花色苷,占到总花色苷含量的30%左右。
根据花色素B环上取代基的位置和数量,可将花色苷分为两类:由花青素、甲基花青素及其酰基化花色苷组成的3'-OH取代的花色苷衍生物和由花翠素、甲基花翠素、二甲基花翠素及其酰化花色苷组成的3'5'-OH取代的花色苷衍生物。如图1 C所示,‘马贝克’和‘马瑟兰’F3'5'H路径的花色苷占比较大,即花翠素衍生物的积累大于花青素衍生物的积累,果实颜色更偏向蓝色色调,而‘美乐’和‘西拉’中F3'H路径的花色苷占比较大,花青素衍生物的积累量较为丰富。
如图1 D所示,不同品种花色苷的甲基化程度也存在较大差异,‘马贝克’花色苷的甲基化程度显著高于其他品种。
2.3 果皮黄酮醇
由表3可知,‘马瑟兰’的总黄酮醇含量最高,为132.32 mg/kg FW;‘美乐’的总黄酮醇含量显著低于其他品种,仅为其他品种的34%~59%。在所有种类的黄酮醇中,‘马贝克’‘美乐’‘小味儿多’和‘西拉’的槲皮素-3-O-半乳糖苷含量较高,为10.63~36.56 mg/kg FW,而山奈酚-3-O-葡萄糖半乳糖苷的含量较低,在6 mg/kg FW以下。
在检测出的山奈酚类、槲皮素类、异鼠李素、杨梅酮类、西伯利亚落叶松黄酮和丁香亭等6类黄酮醇中(图2 A)均以槲皮素类为主,为23.21~81.23 mg/kg FW,占到其黄酮醇总量的48%~62%,其次为山奈酚类或杨梅酮类,而异鼠李素、西伯利亚落叶松黄酮和丁香亭的含量较低,大多在10 mg/kg FW以下。此外,‘马贝克’中积累了较为丰富的山奈酚类黄酮醇,是除‘小味儿多’外其余3个品种的5~6倍,约占黄酮醇总量的24%,表明其F3'H路径的黄酮醇较为丰富。
结合表3和图2 B可知,‘小味儿多’的丁香亭和杨梅酮类黄酮醇的含量显著低于其他品种,均低于5 mg/kg FW,且其F3'5'H路径的产物积累较少,仅约为总黄酮醇含量的13%,而其他品种该路径所产生的黄酮醇均占到总黄酮醇含量的25%以上。5个供试品种F3'H路径黄酮醇约占总黄酮醇的50%~72%,F3'H路径的黄酮醇在‘马瑟兰’和‘小味儿多’中积累较为丰富,而在‘马贝克’中的积累量显著较低。
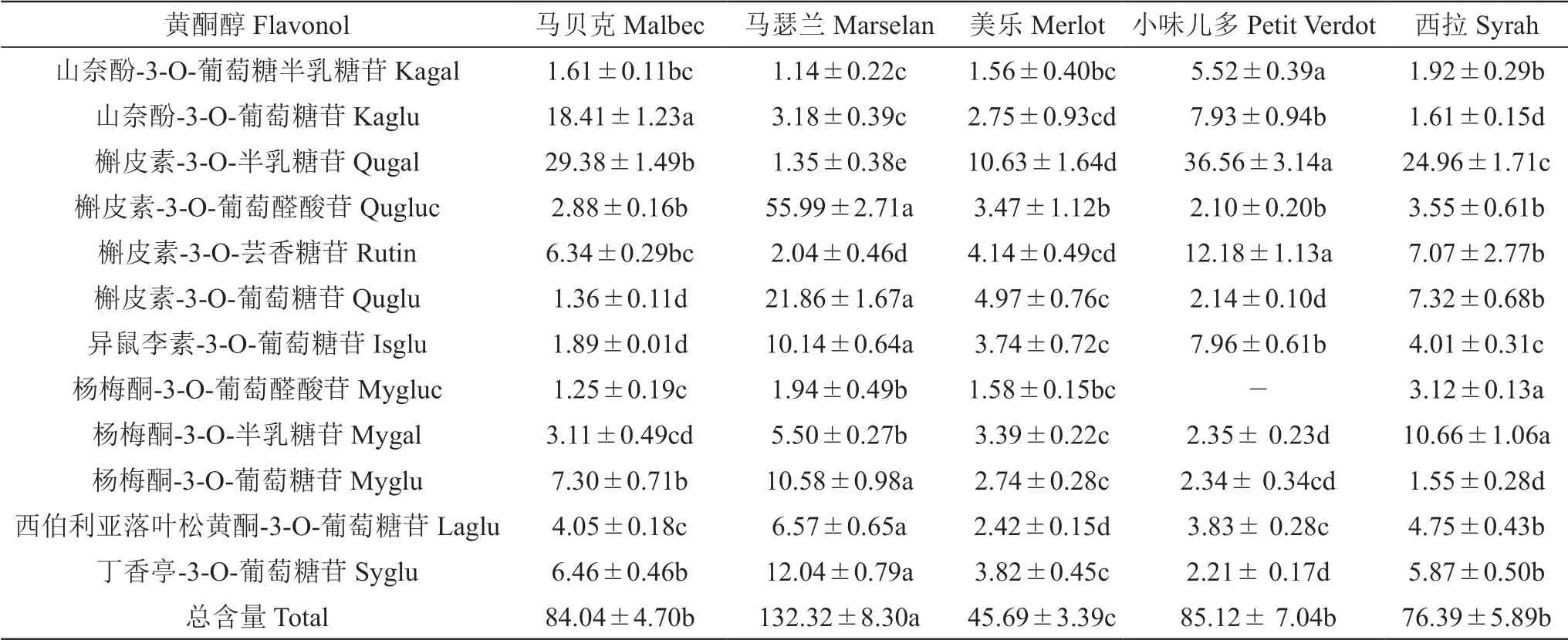
表3 五个酿酒葡萄品种果皮黄酮醇含量Table 3 The flavonol content in the skin of five wine grape varieties mg/kg FW
图2 C中‘马贝克’黄酮醇的甲基化修饰程度较低,其甲基化的黄酮醇只占到黄酮醇总量的15%左右。与之相比,‘马瑟兰’和‘美乐’黄酮醇的甲基化程度较高,其甲基化黄酮醇的占比均大于20%。
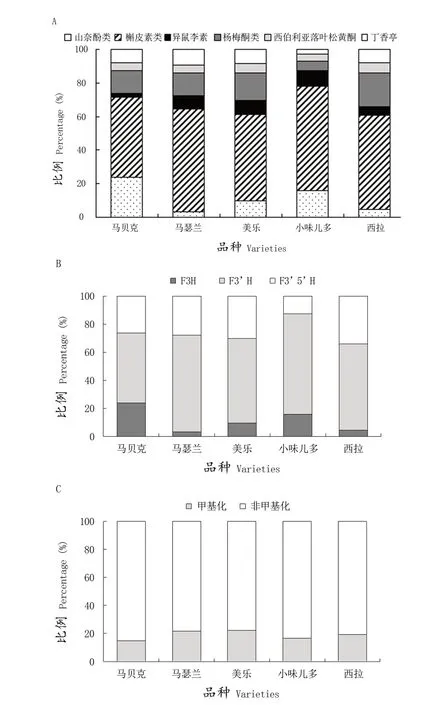
图2 五个葡萄品种果皮中黄酮醇种类(A)、产生路径(B)和甲基化类型(C)占比Figure 2 Composition of flavonols in the skin of five winegrape varieties
2.4 果皮和种子中黄烷-3-醇分析
对5个供试品种果皮和种子中黄烷-3-醇进行定性定量分析,结果如表4和表5所示。果皮和种子中的黄烷-3-醇分为游离单元、起始单元和延伸单元,其中延伸单元占比最大,其占到果皮中总黄烷-3-醇含量的90%以上,在种子中也得到类似的结果。游离单元在果皮总黄烷-3-醇含量中的占比最小,不足1%,且含量仅为9~22 mg/kg FW。
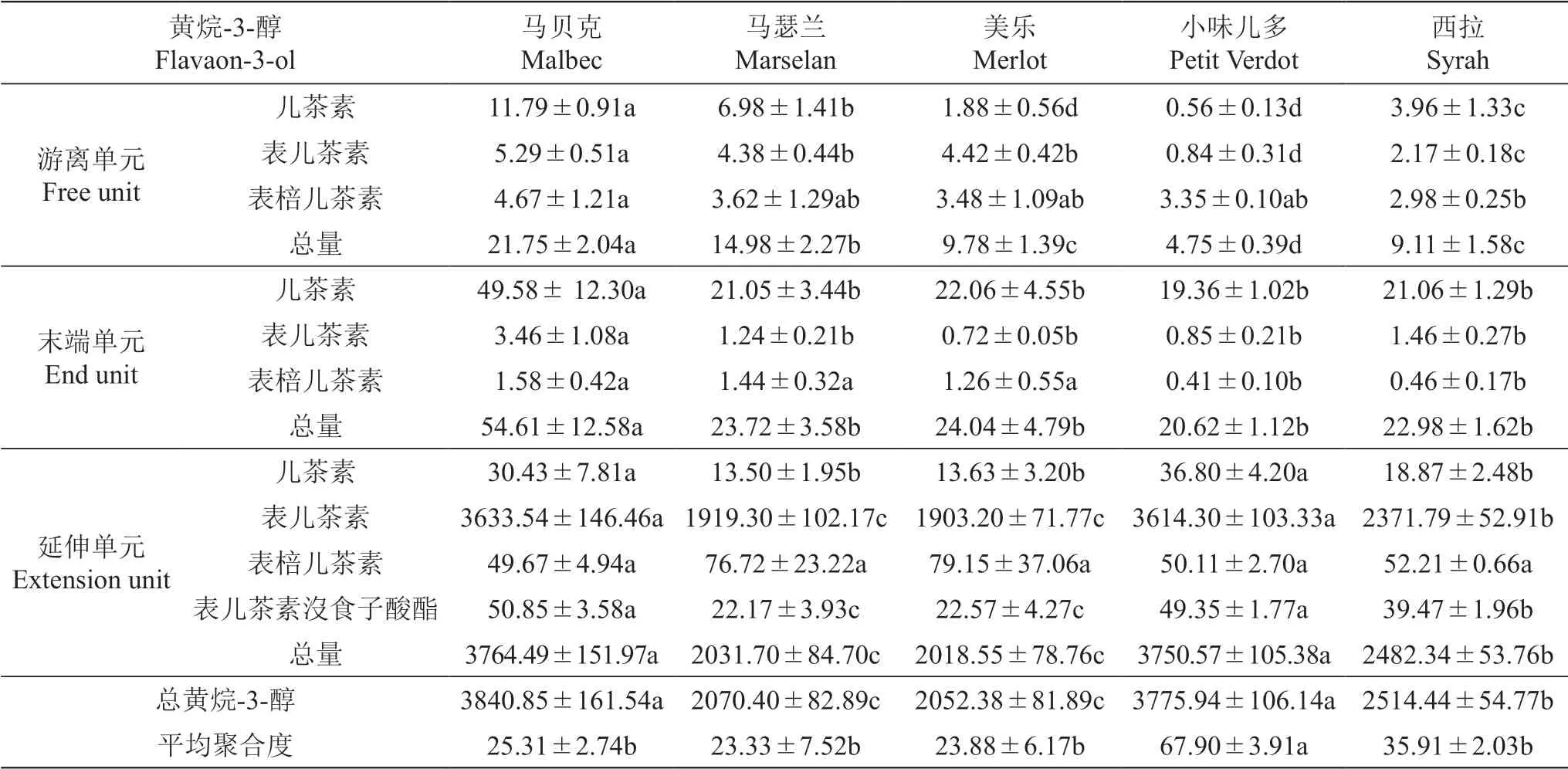
表4 五个酿酒葡萄品种果皮黄烷-3-醇含量Table 4 The flavanol-3-ol content in the skin of five wine grape varieties mg/kg FW
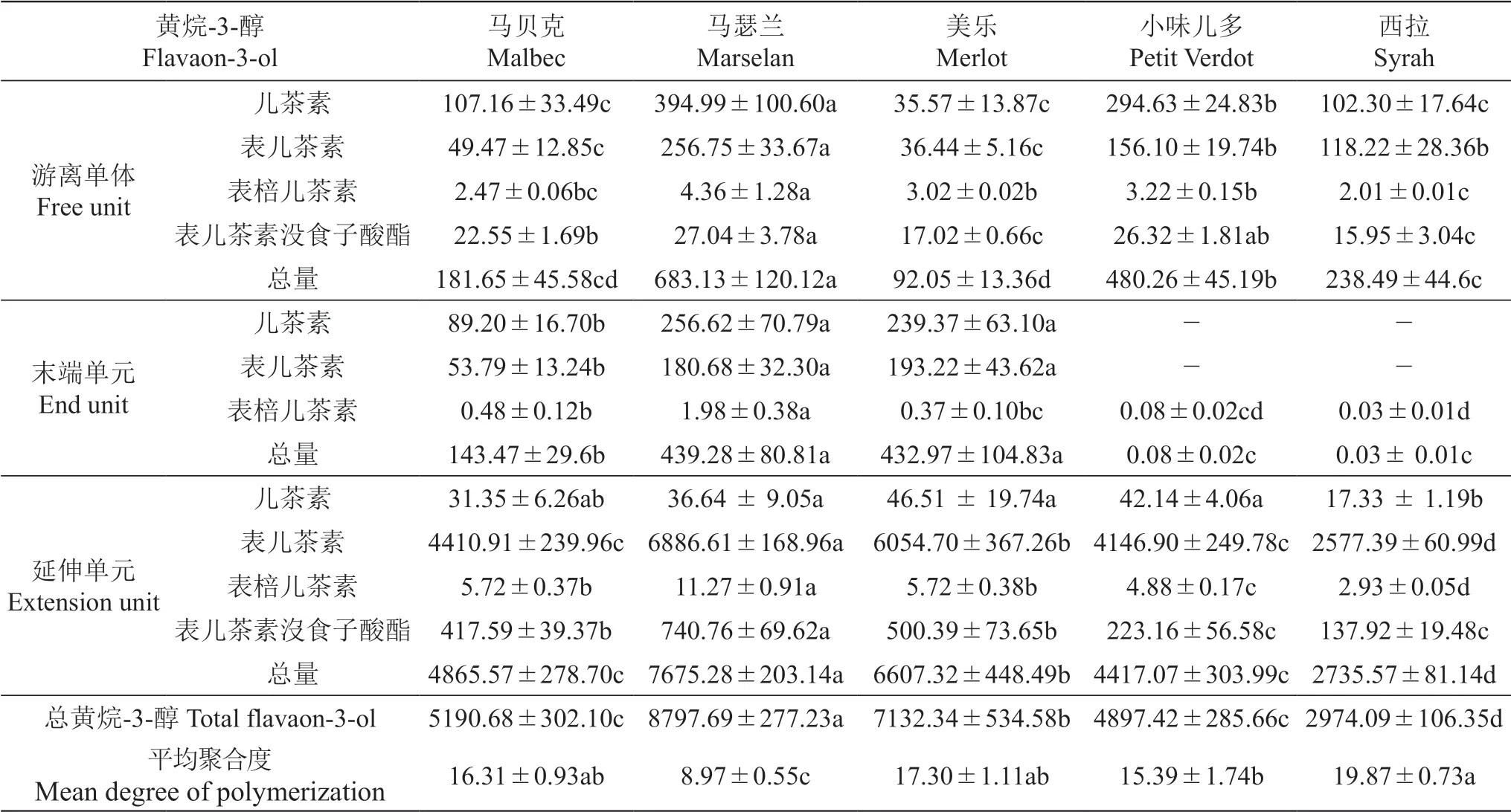
表5 五个酿酒葡萄品种种子黄烷-3-醇含量Table 5 The flavanol-3-ol content in the seed of five wine grape varieties mg/kg FW
果实中的总黄烷-3-醇主要以表儿茶素为主,含量最为丰富,而儿茶素、表棓儿茶素和表儿茶素没食子酸酯的含量相对较少。分析果皮和种子中的总黄烷-3-醇含量,‘马贝克’‘西拉’和‘小味儿多’果皮中的总黄烷-3-醇含量较为丰富,而种子中的总黄烷-3-醇含量较少。与之相反,‘马瑟兰’和‘美乐’果皮中的总黄烷-3-醇含量显著低于其他品种,而种子中却含有相对较多的黄烷-3-醇。
平均聚合度为起始单元和延伸单元的总摩尔数与起始单元摩尔数的比值。不同品种果皮中黄烷-3-醇的平均聚合度存在显著差异,其中‘小味儿多’果皮中的黄烷-3-醇的平均聚合度最高(67.9),约为其余品种的2~3倍,而‘马瑟兰’果皮中黄烷-3-醇的平均聚合度仅为23.33,平均聚合度最低。由此可见,5个供试品种果皮黄烷-3-醇的平均聚合度均高于种子,而种子中黄烷-3-醇的平均聚合度均未达到20。
2.5 香气物质含量和组成
游离态香气物质具有挥发性,其对葡萄的香气有直接的贡献,而非挥发性的结合态香气,在葡萄酒酿造过程中经酶解或酸解可以释放出具有挥发性的物质,对香气有潜在的贡献。如表6所示,5个供试品种中检测到的香气物质均以游离态香气为主,其中‘马贝克’的游离态香气积累最为丰富,达到10 991.38 μg/kg FW,而‘美乐’的游离态香气含量显著低于‘马贝克’,为5475.03 μg/kg FW。
游离态香气物质中,C6/C9类的醛、醇和酯来源于酶促脂质氧化路径,可赋予葡萄和葡萄酒典型的草本植物味和青草味,也被称为绿叶气味物质[37]。从表6可以看出,在游离态香气物质中,C6/C9类含量最为丰富,除‘马瑟兰’外,所有供试品种的C6/C9类游离态香气物质均占到总游离态香气的85%以上,而C6/C9类的结合态类香气仅占到总结合态香气的12%~25%。‘马瑟兰’‘美乐’和‘西拉’均含有较多的游离态和结合态萜烯物质,显著高于‘马贝克’和‘小味儿多’。降异戊二烯类包括β-大马士酮、β-紫罗兰酮、茶螺烷和香叶基丙酮等物质,其感官阈值极低,是葡萄品种香的重要贡献者[4,36],游离态和结合态降异戊二烯类香气在所有品种中的含量均低于50 μg/kg FW,积累量很少。醇类对于葡萄的香气也有贡献,在5个欧亚种葡萄品种中,‘美乐’中游离态醇类含量仅5.18 μg/kg FW,其它品种均在280 μg/kg FW左右;对结合态醇类物质来说,‘马贝克’‘小味儿多’和‘西拉’中该类物质的含量显著高于‘马瑟兰’和‘美乐’,均在1400 μg/kg FW以上。酯类物质可赋予葡萄和葡萄酒花香和成熟的果香[38]。就酯类而言,大部分品种的游离态和结合态酯类香气的含量均>500 μg/kg FW,而且游离态酯类的含量均高于结合态酯类,其中‘马贝克’游离态酯类的含量最高,达到1017.08 μg/kg FW。
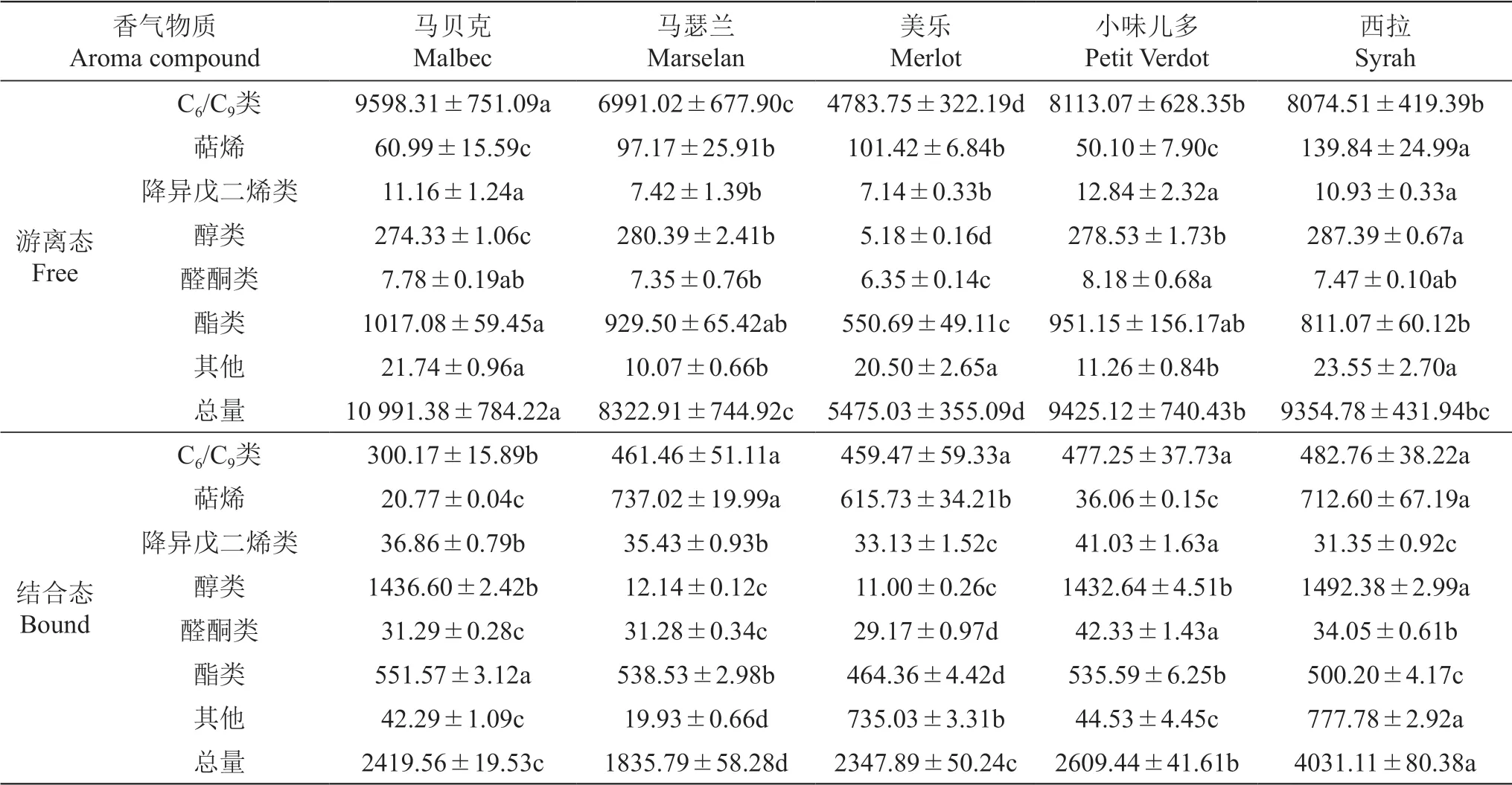
表6 五个酿酒葡萄品种果实游离态和结合态香气物质含量Table 6 Free and bound aroma compounds content in the berries of five wine grape varieties μg/kg FW
综上所述,不论是游离态香气还是结合态香气,不同种类的香气在不同酿酒葡萄品种的含量和组成均存在较大差异,是区分葡萄品种的重要指标。
2.6 类黄酮和香气物质OPLS-DA分析
利用OPLS-DA分别对5个供试品种成熟期葡萄果实类黄酮和香气物质进行分析,所得OPLS-DA模型显示不同供试品种之间存在区别,通过S-plot图进行品种间差异物质筛选,得到VIP值>1.5的类黄酮和香气物质如表7所示,这些物质对于区分供试品种起到重要作用。
由表7可知,‘马贝克’VIP值>1.5的特征物质有4-甲基愈创木酚、结合态异胡薄荷醇、结合态萜烯类、游离态己烯醛、游离态C6/C9类等香气物质和果皮黄烷醇和果皮表儿茶素等类黄酮物质,其中果皮中黄烷醇和游离态(E)-2-己烯醛、游离态C6/C9类在‘马贝克’中更高;‘马瑟兰’VIP值>1.5的特征物质有果皮和种子中黄烷醇、种子中表儿茶素和表棓儿茶素没食子酸酯的延伸单元、二甲花翠素-3-O-葡萄糖苷、二甲花翠素-3-O-乙酰葡萄糖苷、总花色苷以及结合态醇类等,其中果皮和种子中黄烷醇、二甲花翠素-3-O-葡萄糖苷、二甲花翠素-3-O-乙酰葡萄糖苷、总花色苷等类黄酮物质在‘马瑟兰’中含量更高;‘美乐’VIP值>1.5的特征物质有总花色苷、种子中黄烷醇和表儿茶素延伸单元、果皮中黄烷醇、游离态己烯醛、游离态C6/C9类、游离态酯类、游离态醇类、结合态苯乙醇和结合态醇类。除种子中黄烷醇外,其他特征物质含量均较低;‘小味儿多’VIP值>1.5的特征物质有果皮中黄烷醇总量、果皮中表儿茶素延伸单元、游离态C6/C9类、结合态醇类、酯类、萜烯和其他香气等; ‘西拉’VIP值>1.5的特征物质有种子中黄烷醇、表儿茶素延伸单元、4-甲基愈创木酚、结合态苯乙醇、结合态醇类和结合态其他类香气等。4-甲基愈创木酚、结合态苯乙醇、结合态醇类和结合态其他类香气物质含量,4-甲基愈创木酚和结合态苯乙醇可以作为‘西拉’区别于其他品种的特征香气物质。

表7 五个酿酒葡萄特征类黄酮和香气物质VIP值Table 7 VIP value of characteristic flavonoids and aroma substances of five wine grapes
综上可知,OPLS-DA可以筛选出各酿酒葡萄果实的特征物质,将不同品种区分开来。
3 讨论与结论
不同酿酒葡萄品种的类黄酮及香气物质的含量和组成存在较大差异,可作为区分葡萄品种的依据。邢婷婷等[12]研究结果表明,14个欧亚种酿酒葡萄的花色苷组成和含量存在明显差异,可作为化学指纹区分不同品种,例如,‘西拉’和‘马瑟兰’总花色苷含量最高,‘马贝克’花青素类花色苷含量较低,‘黑比诺’二甲花翠素-3-O-葡萄糖苷的含量最大,但不含酰化花色苷,而‘马贝克’和‘西拉’的酰化花色苷积累量较丰富。李琪等[9]利用HPLC法检测甘肃地区9个酿酒葡萄的组成和含量,其结果中‘美乐’总花色苷含量最高。在本试验中,‘马瑟兰’的总花色苷含量最高,‘美乐’的总花色苷含量最低,可能是因为不同地区环境因素和栽培措施的影响,‘马贝克’花色苷的甲基化和酰基化程度较高,与前人研究结果一致。姜文广等[39]结合气相色谱-质谱联用和气相色谱-闻香技术对‘蛇龙珠’‘赤霞珠’‘品丽珠’和‘美乐’等葡萄果实中的挥发性香气进行检测,发现不同葡萄品种香气的种类相似,但香气的强度存在较大差异。本试验中,不同品种不同类别香气物质含量和组成存在差异,其中,‘马贝克’游离态香气含量最高,C6/C9类香气物质丰富,‘马瑟兰’C6/C9类游离态香气物质含量较少,‘马瑟兰’‘美乐’和‘西拉’均含有较多的游离态和结合态萜烯物质,‘美乐’游离态醇类物质的积累量显著低于其他品种,‘小味儿多’和‘西拉’结合态醇类的含量显著高于‘马瑟兰’和‘美乐’。利用OPLS-DA模型能够将所有品种完全区分。
本研究以中国农业大学上庄实验站玻璃温室种植的‘马贝克’‘马瑟兰’‘美乐’‘小味儿多’‘西拉’等5个品种为实验材料,测定成熟期酿酒葡萄果实类黄酮和香气物质组成和含量。结果表明,除‘美乐’外,其他品种均含有丰富的花色苷,‘马贝克’‘马瑟兰’中黄酮醇和黄烷醇含量较高,‘马贝克’游离态C6/C9类、游离态酯类和结合态酯类香气含量最高,‘马瑟兰’结合态萜烯含量最高,‘小味儿多’游离态和结合态降异戊二烯类、游离态醛酮类香气含量最高,‘西拉’游离态萜烯和醇类香气含量最高。‘马贝克’‘马瑟兰’‘小味儿多’‘西拉’表现较好,具有种植潜力。
