血管支架术后力学损伤及其对血管支架设计影响的研究
2021-11-28姚家亮范振敏杨晓红叶霞刘曼曼邓小燕
姚家亮 范振敏 杨晓红 叶霞 刘曼曼 邓小燕


摘 要:血管支架植入是心血管介入治疗最重要且有效的手段;但是,因术后面临支架内再狭窄和血栓等临床问题,制约了其治疗效果。尽管支架内再狭窄和晚期血栓发生的机理至今不明;但是,支架植入后对宿主血管所造成的损伤是引发后续不良事件的重要原因。综述支架植入后对宿主血管的影响,着重从力学环境的变化角度分析了支架植入对宿主血管壁的损伤过程和影响因素,为新型血管支架的设计和放置提供了理论依据。
关键词:动脉粥样硬化;支架介入;支架内再狭窄;支架设计
中图分类号:R318.01 文献标识码:A 文章编号:2095-7394(2021)04-0085-10
心血管疾病是威胁人类生命健康的严重疾病之一,据统计,目前我国每年约有300万人死于心血管病[1],其中,动脉粥样硬化是心血管疾病中最为常见的一种。动脉粥样硬化(Atherosclerosis),如图1所示,一般表现为血管壁累积“黄色粥状”(用希腊语athero命名)的斑块,斑块不断向血管内腔生长造成内腔减小或完全狭窄,严重的狭窄使远端支路血液不畅导致远端组织供血不足、机能障碍性病变等,甚至会引发缺血性坏死[2]。在临床上,斑块破裂和血栓形成是脑梗死、冠心病猝死、外周血管病以及急性心肌梗死等急性事件的主要原因。
1 支架置入术
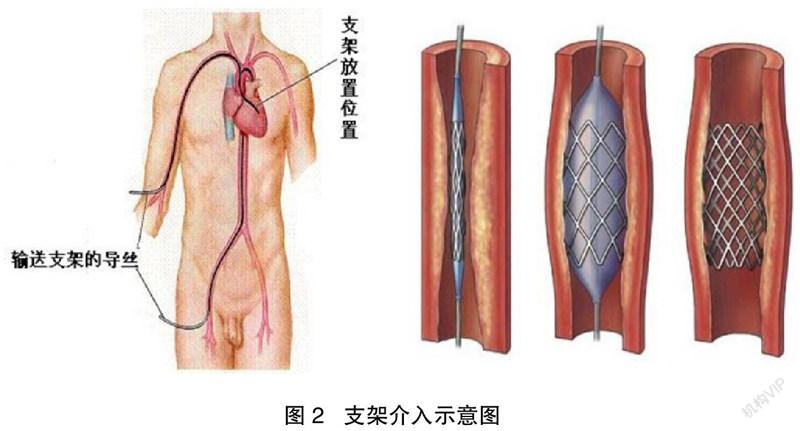
目前,针对动脉粥样硬化的治疗方法有很多。临床上,对于中轻度狭窄的动脉粥样硬化,通常采用药物治疗(如他汀类药物)稳定斑块,从而延缓动脉粥样硬化进程。然而,对于存在严重血管狭窄的患者,通常需要用手术进行更积极的治疗,比如血管成形术及支架置入术(Angioplasty and Stent Placement)、血管搭桥术(Bypass Surgery)以及动脉内膜剥脱术(Endarterectomy)等。其中,如图2所示血管支架置入术因为创伤小、操作简单,成为一种广泛应用且有效的治疗方法[3]。这种治疗方法将血管支架压缩并固定于由导丝和导管等组成的支架输送系统上,随后将支架输运到病变位置后进行扩张,完成支架撑开狭窄血管壁的过程,从而达到恢复血液畅通的治疗效果。
1912年,法国医生Alexis[4]首先提出借用外源物支撑血管壁以恢复血管内腔通透性的方法,他将覆盖石蜡的玻璃管和金属管植入犬胸主动脉。1977年,GR?NTZIG[5]首次成功进行了冠状动脉的球囊支架形成术,开启了支架介入治疗心血管疾病的新时代。据第二十一届全国介入心脏病学论坛会议数据统计显示,2017年我国冠脉支架植入术多达753 142例,已经超过美国成为全球最大的介入国。
虽然支架置入术已广泛应用于临床;但是依然面临着支架内再狭窄(Restenosis)和支架内血栓(Stent Thrombus)等问题。临床数据显示:冠状动脉植入金属裸支架后6个月,血管的再狭窄率仍高达15%~30%,如果患者兼具糖尿病和肾功能不全等其他疾病,支架术后再狭窄率可高达80%[6-8]。此外,支架术后血栓发生率虽约为2%,但血栓发生后的致残率和死亡率达到了90%[9]。因此,这种支架植入不仅会给患者及其家属带来一定的经济压力,而且会给他们造成严重的心理负担。
2 支架术后的生理反应
在支架植入后,损伤的血管将会经历内皮剥脱、再内皮化和内膜增生三个阶段[10]。作为异物植入的支架,将使得术后血管内皮细胞遭到部分或者完全破坏,导致内膜出现损伤,继而造成血液中的血小板和纤维蛋白原等活化和沉积;同时,血液中大量的白细胞、单核细胞、巨噬细胞粘附在损伤处并激活释放各种生长因子和细胞因子。在这種环境下,血管中膜的平滑肌细胞被激活,开始大量增殖并向损伤的区域迁移,引发炎症反应[11];随后,损伤的内皮层开始修复,新形成的血管化组织覆盖在损伤内皮表面,启动血管再内皮化;支架术后数周,新生的内皮细胞完全覆盖损伤区域[10]。然而,对于较严重的或者更深层的血管壁损伤,可能会出现再内皮化的延迟。内皮化完成后,平滑肌细胞聚集在内膜层,增殖迁移逐渐减缓,但内膜中的平滑肌细胞会分泌出大量的细胞外基质,使得内膜层不断增厚,最终血管内腔出现狭窄[12]。此外,成纤维细胞生长因子(FGF)、胰岛素样生长因子(IGF)、转化生长因子β(TGF-b)、血小板衍生的生长因子(PDGF)和血管内皮生长因子(VEGF)等在参与损伤血管愈合过程的同时,还将进一步促进内皮细胞和平滑肌细胞增殖。如图3所示,整个支架再狭窄的进程是复杂的多因素共同作用的结果[12]。
支架植入初期即可形成血栓,血管内皮层被局部破坏后出现血小板聚集、活化,启动凝血级联,炎症反应等使得支架表面覆盖一层薄薄的血栓层。在支架植入中期,内皮细胞修复逐渐完成,凝血级联反应逐渐减弱,平滑肌细胞从中膜迁移到内膜导致内膜增厚,局部炎症反应趋于正常。由于抗凝血因子分泌不足,再内皮化虽然完成,但其功能不健全,可能会引发晚期血栓。而且,不利的血流动力学环境可导致斑块的形成,抑制内皮再生,造成内皮功能障碍;局部的高剪切力也会促进易损斑块的出现,最终可能导致晚期血栓形成。
3 支架植入造成的力学损伤
虽然,支架术后再狭窄和血栓的发生机制非常复杂且尚不明了;但是,人们普遍认为支架术后再狭窄和血栓的形成与支架植入后所带来的损伤密切相关。支架置入术对宿主血管的损伤包括以下方面。
首先,表现为支架在输送、撑开和作用血管壁后对血管壁造成力学损伤,如图4所示[12]。支架的传输和撑开造成内皮损伤、剥脱或者功能障碍,支架撑开的过程会撕裂动脉内弹性层(the internal elastic lamina,IEL),血管壁的机械扩张导致中膜和外膜层损伤及局灶性开裂等。
其次,支架的传输和撑开使得血管壁受到由内向外的损伤。内皮剥脱是损伤事件和后续不良事件启动的重要诱因[12-13]。一方面,内皮剥脱使得其上的糖萼层(EGL)遭到破坏,糖萼层是一层覆盖在内皮细胞上的多糖蛋白质复合物,呈现为相对规则的超微结构。功能完整的内皮糖萼层可以作为一个分子筛[14],对于跨内皮的物质传输发挥排阻效应。糖萼层一旦遭到破坏,可能会增加大分子尤其是有害大分子(如低密度脂蛋白等物质)的跨内皮输运。另一方面,支架植入对内皮细胞造成部分或者完全破坏。这种破坏和作为异物植入的血管支架引起局部炎症反应,进而导致血液中的白细胞、血小板、脂质等物质发生局部黏附,随着黏附物质的积累,逐渐形成病灶[12]。而且,这种破坏能够增加内皮细胞对白蛋白通透性,降低对大分子的阻力,从而增加有害物质在血管的积累。有实验表明,内皮细胞破坏后高导水率和渗透率使得更多的大分子在内膜快速累积[15-16]。而且,内皮细胞损伤能够影响其表达各种蛋白质和血管活性因子,如:血管舒张因子(NO)、粘附分子(ICAM-1)、生长因子(PDGF)、生长抑制因子(heparin)、收缩因子(ET-1)、趋化因子(MCP-1)等,参与介导多种支架术后的生理和病理过程[11,17]。此外,支架植入会撕裂血管内膜中内弹性层,进一步损害血液和管壁之间的通透性屏障。内弹性层(IEL)位于血管内皮下,是内皮和内平滑肌细胞层之间的柔性屏障。IEL上的小孔洞充当了物质在内膜和中层之间扩散的低阻通道,它几乎能够完全屏蔽掉高分子量脂质的通过。然而,当IEL受损时,渗透性更强的IEL将允许高分子量的致动脉粥样硬化的化学物质从内膜到中膜的输运[18];并且,IEL还在平滑肌细胞从中膜向内膜迁移的过程中发挥重要作用[19]。
再次,血管支架的机械扩张导致中膜和外膜层的机械损伤。支架植入过程中血管中膜和外膜的细胞感受到血管力学环境的改变,并将力学信号传导进入胞内,进而调整细胞行为,使得如弹性模量等重要的血管壁力学参数发生明显变化[20-21]。研究发现,颈内支架术后弹性模量大约提高了4倍,而支架术后的顺应性降低为术前的1/3;这使得支架术后支架-动脉壁形成的管壁刚性增强,且其流量压力关系更接近于刚性壁。在这种状况下,用以动脉扩张的能量将转为驱动宿主血管内血流流动,从而提高宿主血管内的血流速度[20];而且,平滑肌细胞和成纤维细胞将会通过调整其表型和行为,来响应支架术后引起的力学环境变化。當血管硬化和张应力降低时,平滑肌细胞的表型从收缩状态转变为合成状态,造成细胞基质降解,并引发更多细胞的增殖或迁移,从而导致血管病变的发生和发展[22-24]。
最后,支架置入术对宿主血管的损伤还来自于支架植入后局部血流环境的改变。血管支架植入在恢复血液畅通的同时,也在血管内腔引入凸起的支架丝,这对宿主血管的几何形状造成剧烈的改变。这些过程使得宿主血管内的血流和剪切力分布出现改变,并使整个支架段的壁面剪切力处于较低水平[25]。支架术后变化的局部血流环境直接作用于内皮细胞,进一步影响其正常生理功能,如:各种蛋白质和血管活性因子的表达,参与介导多种生理和病理过程等。如图5所示,在支架丝附近形成了血液扰流区或停滞区[11],以及低壁面剪切力(WSS)、高振荡剪应力指数(OSI)和长相对停滞时间(RRT)等血流动力学特征[26],这更容易发生支架不正确放置、分叉和支架重叠区等情况。大量的临床数据已经表明:低壁面剪切力使得动脉内皮损伤,是引发支架置入术后支架内再狭窄和血栓等并发症的重要危险因素[25];在裸金属支架治疗的冠状动脉血管中,壁面剪切力与支架内再狭窄的程度呈负相关[17]。离体的动物实验也发现:支架植入后,高壁面剪切力能够减轻支架术后的炎症和减少平滑肌细胞迁移,进而减轻支架术后的内膜增生。剪切震荡指数(Oscillatory shear index,OSI)能调节内皮细胞功能,高的OSI会引起管壁炎症反应,促进管壁结构衰退,并与动脉粥样硬化等病变的形成关系密切[27];因此,支架段的高OSI可能是影响其术后变现的重要因素。相对滞留时间(Relative residence time,RRT)连接OSI和WSS,用来反映流场扰动情况,表征血流在壁面处停留相对时间的长短。JIMENEZ等人[28]研究发现,无论支架高度如何,都会促进近端和远端扰流的产生,其延长物质停留时间、使停滞区域定位于支架支柱周围等特征,将导致更多的低密度脂质蛋白黏附在动脉管腔表面,从而加速支架术后不良事件的发生。
以上支架植入后所带来的损伤在很多情况下还会进一步加重,比如:对于存有严重狭窄的血管,在支架介入前需进行预扩张;对于支架在病变位置没有完全扩张的情况,仍需进行二次扩张[29]。此外,血管壁的几何形状和内部组成使得撑开过程不同:如果充气压力过大会造成血管壁的严重损伤;如果充气压力过小,会造成支架与血管壁不贴合等[30]。
4 血管支架设计的重要方面
支架术后的损伤程度与支架的设计密切相关。虽然,支架的存在必然会导致流动分离和汇流区域形成;但是,不同支架对宿主血管内局部血流动力学的影响是存在区别的。不恰当的支架植入必然会增大术后不良事件发生的风险;因此,优化支架术后力学环境仍是亟待解决的问题。在支架干预治疗过程中,最大限度地优化支架植入取决于支架的结构设计、放置方式、输送过程和材料选择等多个方面[26, 31]。为了减少支架植入后对宿主血管的力学损伤,在支架设计时应考虑以下重要方面。
4.1 支架丝的厚度
如图6所示为药物支架丝形状和厚度的发展历程[32]。支架丝厚度是影响支架植入后宿主血管内剪切率和壁面剪切力等局部力学环境的主要因素。较厚支架丝不仅会给宿主血管内带来更大面积的异物植入,而且加剧了管腔内血流的紊乱、分离程度,同时增加了回流区域等[33];而较薄支架丝可促进再内皮化,减少了支架周围信息和纤维蛋白沉积[25]。在体外模型中,较厚支架丝植入的血栓形成能力是相同设计的薄支架丝的1.5倍[25]。KASTRATI等人[34]分析了651位冠状动脉患者的术后表现,其中:有326位患者植入薄支架(50[μm]);325位患者植入厚支架(140[μm])。术后薄支架组血管的再狭窄发生率为15.0%,而厚支架组为25.8%。目前,可降解支架支架丝较厚(厚度≥150[μm])且难以嵌入组织,对血液流动造成了更大的障碍,这将增加血小板黏附、加剧炎症反应以及减少再内皮化等,这些问题成为这一类型支架发展的主要瓶颈[25];因此,在满足血管支架其它性能的前提下,降低支架丝厚度是支架优化设计的重要方面。
4.2 支架丝的形状
支架丝的形状也将影响支架植入后宿主血管内的局部力学环境。研究发现,冠状动脉产生的不良血流动力学与支架丝形状有关。如图7所示,长方形等非流线型支架丝会导致更多扰流和低壁面剪切力,而圆形等流线型支架丝可以明显减少支架附近扰流的产生[35],并且非流线型支架的血流分离距离更长[36]。显然,符合流体动力学设计的支架会减少扰流等问题的产生,从而降低动脉再狭窄和血栓发生的风险。
4.3 支架的长度
支架的长度由病变位置决定;但是,长支架的植入势必会引入更多不良力学环境因素,从而加大支架术后不良事件发生的风险。也有研究表明:如果支架过短可能使得支架的末端伸进脂质斑块中,导致血管壁局部应力激增,造成急性事件的发生。YANO等人[37]在研究药物支架长度对经皮冠状动脉介入治疗长期临床疗效的影响中发现,完全覆盖弥漫性病变的长支架是经皮冠状动脉介入治疗(PCI)的最佳策略。尽管过短支架的植入将恶化血管壁及脂质斑块力学环境并引起不良的术后表现,但是,这种现象在临床上却难以避免;这是因为在支架植入过程中外界环境、人为因素和病变位置的测量等均存在不同程度的影响,其中,源于病变位置测量引起的误差尤为明显。据CHOI等人[38-39]的研究表明,使用冠状动脉造影(Quantitative Coronary Angiography,QCA)和近红外光谱(Nearinfrared Spectroscopy,NIRS)相结合技术测得的病变长度,远大于仅使用冠状动脉造影所测得的数据。
4.4 支架丝的间距
支架丝的间距也与宿主血管内的不良血流动力学环境密切相关。BEIER等人[40]通过用0.83 mm、1.25 mm、1.67 mm和2 mm支柱间距的支架建模发现,随着支架柱增多,支架间距减小,支架柱附近的动脉壁面剪切力逐渐减小。小间距会导致更大低壁面剪切力区域出现,当增加间距后,这种情况有所缓解;因此,在保证支架性能的同时,适当减少支架支柱的数量,可以改善宿主血管内的血流动力学环境。
4.5 血管支架的贴壁状况
支架的径向几何丢失现象表现为支架植入后支架和血管壁的不贴合(“Incomplete Stent Apposition”或“Malapposition”),使得支架和血管壁之间存在间隙。COOK等人[41]首次证明了支架不贴合和支架内晚期血栓的相关性。在发生晚期血栓的13位病人中,有10位病人存在支架不贴合现象,且这10位病人中有9位支架血管壁横截面最大间隔面积超过8.3 mm2。MOSES等人[42]的研究也得到类似的结论,他们发现在心肌梗塞致死的病人中约50%出现支架的不贴合现象,其中:35%支架不贴合出现在支架近端;15%支架不贴合出现在支架末端。如图8所示为贴壁良好和贴壁不良的支架植入情况[43],贴壁不良的支架丝植入后,宿主血管内会出现扰流和高剪切率区域,这是导致支架内血栓的重要原因[44]。KOLANDAIVELU等人[45]的研究也显示,贴壁不良支架的血栓形成能力约是正常植入组的1.5倍。因此,贴壁良好的支架植入是改善支架术后表现的重要方面。
除了造成宿主血管壁的损伤从而引起再狭窄和血栓之外,支架在植入后还可能会发生断裂,失去对闭塞动脉的支撑能力,进而导致再狭窄、血栓形成或者动脉穿孔[46];甚至可能出现血管支架的迁移,比如右肺靜脉支架等,造成心律失常和心力衰竭等状况;并会面临支架自身的抗疲劳能力等问题[47]。
5 结论
综上所述,虽然通过血管支架的植入能够即刻恢复血液畅通;但是,却给宿主血管带来了新的问题。不理想的支架植入会进一步损伤血管壁,影响宿主血管内的局部力学环境,加剧临床不良事件的发生;而合理优化支架植入和支架设计过程,可以减少宿主血管内不良力学特征产生,从而降低支架术后出现并发症的风险。本文通过研究得到以下结论:
(1)虽然,支架已被广泛应用于冠状动脉狭窄患者的治疗;但是,术后相对较高的支架内再狭窄率和支架内血栓发生,依然影响了治疗效果。
(2)支架植入后会引起宿主血管内一系列不良的生理反应,这些均与支架植入所造成的力学损伤密切相关。
(3)支架在传输和撑开以及植入后,局部力学环境的改变可能会损伤宿主血管,增加支架术后不良事件发生的风险。
(4)支架的结构、支架丝间距、支架尺寸等参数,影响了宿主血管内的局部力学环境。
总之,应合理优化支架植入和支架设计过程,减少宿主血管内不良力学特征的产生,从而降低支架术后出现并发症的风险。但是,血管支架的各项性能之间是相互制约的。“完美”的血管支架既要具有较好的径向支撑力,轴向弯曲性、顺应性,较小的支架丝厚度,又要有较大的支架丝间隔和良好的贴壁性能等;然而,在设计中径向支撑力的保证离不开支架丝厚度的增加以及支架丝间隔的减小,支架丝厚度的增加和间隔的减小又使得支架的弯曲性和顺应性变差。可见,“完美”的血管支架其各项性能之间是相互矛盾的,这些问题的逐步解决,将成为未来血管支架植入术优化设计发展的重要方向。
参考文献:
[1] CARNETHON M R,PU J,HOWARD G,et al. Cardiovascular Health in African Americans:a scientific statement from the American Heart Association[J]. Circulation,2017,136(21):393-423.
[2] HOLZAPFEL G A,MULVIHILL J J,CUNNANE E M,et al.Computational approaches for analyzing the mechanics of atherosclerotic plaques:a review[J]. Journal of Biomechanics,2014,47(4):859-869.
[3] MULLANY C J. Cardiology patient pages.Coronary artery bypass surgery[J]. Circulation,2003,107(3): 21-22.
[4] ANDERSEN P. The Nobel Prize in physiology or medicine 1967[J]. Tidsskr Nor Laegeforen,1967,87(22):1926-1927.
[5] GRüNTZIG A. Transluminal dilatation of Coronary-Artery Stenosis[J]. Lancet,1978,311(8058):263.
[6] JAVAID L,JULIAN G,SERRUYS P W. Coronary stents:historical development,current status and future directions[J]. British Medical Bulletin,2013(1):193-211.
[7] FOERST J,VORPAHL M,ENGELHARDT M,et al. Evolution of Coronary Stents:from Bare-Metal Stents to fully biodegradable,Drug-Eluting Stents[J]. Combination Products in Therapy,2013,3(1-2):9-24.
[8] HOFFMANN R,MINTZ G S. Coronary in-stent restenosis - predictors,treatment and prevention[J]. European Heart Journal,2000,21(21):1739-1749.
[9] STONE G W,ELLIS S G,COLOMBO A,et al. Offsetting impact of thrombosis and restenosis on the occurrence of death and myocardial infarction after paclitaxel-eluting and bare metal stent implantation[J]. Circulation,2007,115(22):2842-2847.
[10] GREWE P H,DENEKE T,MACHRAOUI A,et al. Acute and chronic tissue response to coronary stent implantation:pathologic findings in human specimen[J].Journal of the American College of Cardiology,2000, 35(1):157-163.
[11] WANG J,JIN X,HUANG Y,et al. Endovascular stent-induced alterations in host artery mechanical environments and their roles in stent restenosis and late thrombosis[J]. Regenerative Biomaterials,2018,5(3): 177-187.
[12] KIPSHIDZE N,DANGAS G,TSAPENKO M,et al. Role of the endothelium in modulating neointimal formation:vasculoprotective approaches to attenuate restenosis after percutaneous coronary interventions[J]. Journal of the American College of Cardiology,2004,44(4):733-739.
[13] TRUSKEY G A,ROBERTS W L,HERRMANN R A,et al. Measurement of endothelial permeability to 125I-low density lipoproteins in rabbit arteries by use of en face preparations[J]. Circulation Research,1992,71(4):883-897.
[14] VINK H,DULING B R. Identification of distinct luminal domains for macromolecules,erythrocytes,and leukocytes within mammalian capillaries[J]. Circulation Research,1996,79(3):581-589.
[15] KARNER G,PERKTOLD K. Effect of endothelial injury and increased blood pressure on albumin accumulation in the arterial wall:a numerical study[J]. Journal of Biomechanics,2000,33(6):709-715.
[16] WANG Z,LIU M,LIU X,et al. Hydraulic conductivity and low-density lipoprotein transport of the venous graft wall in an arterial bypass[J]. Biomedical Engineering Online,2019,18(1):50.
[17] KOSKINAS K C,CHATZIZISIS Y S,ANTONIADIS A P,et al. Role of endothelial shear stress in stent restenosis and thrombosis:pathophysiologic mechanisms and implications for clinical translation[J]. Journal of the American College of Cardiology,2012,59(15):1337-1349.
[18] SANDOW S L,GZIK D J,LEE R M. Arterial internal elastic lamina holes:relationship to function?[J]. Journal Anatomy,2009,214(2):258-266.
[19] CHAPMAN S L,SICOT F X,DAVIS E C,et al. Fibulin-2 and fibulin-5 cooperatively function to form the internal elastic lamina and protect from vascular injury[J]. Arteriosclerosis Thrombosis and Vascular Biology,2010,30(1):68-74.
[20] LAL B K,HOBSON R W,GOLDSTEIN J,et al. Carotid artery stenting:is there a need to revise ultrasound velocity criteria?[J]. Journal Vascular Surgery,2004,39(1):58-66.
[21] DOBSON G,FLEWITT J,TYBERG J V,et al. Endografting of the descending thoracic aorta increases ascending aortic input impedance and attenuates pressure transmission in dogs[J]. European Journal of Vascular and Endovascular Surgery,2006,32(2):129-135.
[22] GAMBILLARA V,THACHER T,SILACCI P,et al. Effects of reduced cyclic stretch on vascular smooth muscle cell function of pig carotids perfused ex vivo[J]. American Journal Hypertension,2008,21(4):425-431.
[23] FORTE,AMALIA,CORTE D,et al. Role of myofibroblasts in vascular remodelling:focus on restenosis and aneurysm[J]. Cardiovascular Research,2010,88(3):395-405.
[24] SAZONOVA O V,LEE K L,ISENBERG B C,et al. Cell-cell interactions mediate the response of vascular smooth muscle cells to substrate stiffness[J]. Biophysican Journal,2011,101(3):622-630.
[25] NG J,BOURANTAS C V,TORII R,et al. Local Hemodynamic forces after stenting:implications on restenosis and thrombosis[J]. Arteriosclerosis Thrombosis and Vascular Biology,2017,37(12):2231-2242.
[26] BALOSSINO R,GERVASO F,MIGLIAVACCA F,et al. Effects of different stent designs on local hemodynamics in stented arteries[J]. Journal of Biomechanics,2008,41(5):1053-1061.
[27] KU D N,GIDDENS D P,ZARINS C K,et al. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Arteriosclerosis[J]. Arteriosclerosis (Dallas, Tex.),1985,5(3):293-302.
[28] JIMENEZ J M,DAVIES P F. Hemodynamically driven stent strut design[J]. Annals of Biomedical Engineering,2009,37(8):1483-1494.
[29] HE R,ZHAO L G,SILBERSCHMIDT V V,et al. Finite element evaluation of artery damage in deployment of polymeric stent with pre- and post-dilation[J]. Biomechanics And Modeling In Mechanobiology,2020,19(1): 47-60.
[30] GERVASO F,CAPELLI C,PETRINI L,et al. On the effects of different strategies in modelling balloon-expandable stenting by means of finite element method[J]. Journal of Biomechanics,2008,41(6): 1206-1212.
[31] TOMINAGA R,KAMBIC H E,EMOTO H,et al. Effects of design geometry of intravascular endoprostheses on stenosis rate in normal rabbits[J]. American Heart Journal,1992,123(1):21-28.
[32] FOIN N,LEE R D,TORII R,et al. Impact of stent strut design in metallic stents and biodegradable scaffolds[J]. International Journal of Cardiology,2014,177(3):800-808.
[33] KARANASIOU G S,PAPAFAKLIS M I,CONWAY C,et al. Stents:biomechanics,biomaterials,and insights from computational modeling[J]. Annals of Biomedical Engineering,2017,45(4):853-872.
[34] KASTRATI A,MEHILLI J,DIRSCHINGER J, et al. Intracoronary stenting and angiographic results: strut thickness effect on restenosis outcome (ISAR-STEREO)trial[J]. Circulation,2001,103(23):2816-2821.
[35] POON E K,BARLIS P,MOORE S,et al. Numerical investigations of the haemodynamic changes associated with stent malapposition in an idealised coronary artery[J]. Journal of Biomechanics,2014,47(12):2843-2851.
[36] SEO T,SCHACHTER L G,BARAKAT A I. Computational study of fluid mechanical disturbance induced by endovascular stents[J]. Annals of Biomedical Engineering,2005,33(4):444-456.
[37] YANO H,HORINAKA S,ISHIMITSU T. Impact of everolimus-eluting stent length on long-term clinical outcomes of percutaneous coronary intervention[J]. American Journal of Cardiology,2018,71(5):444-451.
[38] LEGUTKO J,JAKALA J,MINTZ G S,et al. Virtual histology-intravascular ultrasound assessment of lesion coverage after angiographically-guided stent implantation in patients with ST Elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. American Journal of Cardiology,2012,109(10):1405-1410.
[39] CHOI I J,KOH Y S,LIM S,et al. Impact of the stent length on long-term clinical outcomes following newer-generation drug-eluting stent implantation[J]. American Journal of Cardiology,2014,113(3):457-464.
[40] BEIER S,ORMISTON J,WEBSTER M,et al. Hemodynamics in idealized stented coronary arteries: important stent design considerations[J]. Annals of Biomedical Engineering,2016,44(2):315-329.
[41] COOK S P,WENAWESER P,TOGNI M,et al. Incomplete stent apposition and very late stent thrombosis after Drug-Eluting stent implantation[J]. Circulation,2007,115(18):2426-2434.
[42] MOSES J W,DANGAS G,MEHRAN R,et al. Drug-eluting stents in the real world:how intravascular ultrasound can improve clinical outcome[J]. American Journal of Cardiology,2008,102(9):24-28.
[43] FOIN N,TORII R,MATTESINI A,et al. Biodegradable vascular scaffold:Is optimal expansion the key to minimising flow disturbances and risk of adverse events?[J].EuroIntervention:journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology,2014,10(11).DOI:10.4244/EIJY14M11_09.
[44] FOIN N,GUTIERREZ-CHICO J L,NAKATANI S,et al. Incomplete stent apposition causes high shear flow disturbances and delay in neointimal coverage as a function of strut to wall detachment distance:implications for the management of incomplete stent apposition[J]. Circulation Cardiovascular Interventions,2014,7(2): 180-189.
[45] KOLANDAIVELU K,SWAMINATHAN R,GIBSON W J,et al. Stent thrombogenicity early in high risk interventional settings is driven by stent design and deployment,and Protected by Polymer-Drug coatings[J]. Circulation,2011,123(13):1400-1409.
[46] CUI X,REN Q,LI G,et al. Influence of the realistic artery geometry parameters on a coronary stent fatigue life[J]. International Journal of Computational Methods,2018.18420
006.DOI:10.1142/S0219876218420069.
[47] YANKOV G,PETKOV R,MEKOV E,et al. Migration of Bare-Metal stent placed in the right iliac vein into the Right Pulmonary Artery[J]. Annals of Thoracic Surgery,2020,110(3):205-207.
責任编辑 盛 艳
