脯氨酸羟化酶3 在乳腺癌中的表达及其对乳腺癌细胞恶性表型的影响
2021-11-28赵梓彤宋咏梅张柏林
王 杨 赵梓彤 宋咏梅 张柏林
1.国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院乳腺外科,北京 100021;2.国家癌症中心 国家肿瘤临床医学研究中心中国医学科学院北京协和医学院肿瘤医院分子肿瘤学国家重点实验室,北京 100021
据世界卫生组织国际癌症研究中心发布的全球肿瘤流行病统计数据(GLOBOCAN 2018)显示,全球每年新增乳腺癌病例达208 万例,死亡62.6 万例[1]。近年来,虽然乳腺癌的诊断和治疗取得了显著进步,但仍面临许多难题,乳腺癌的发病机制仍不够清楚。近年来乳腺癌分子靶向治疗得到越来越多的关注[2],因此寻找合适的靶向治疗位点,进行基因靶向治疗逐渐成为乳腺癌的研究热点。
脯氨酸羟化酶3(Egl nine homolog 3,EGLN3)属于脯氨酸羟化酶家族,该家族酶类通过羟化缺氧诱导因子α(hypoxic inducible facter-α,HIF-α)保守的脯氨酸残基来调节细胞对氧的反应,起到氧传感器的作用[3]。目前大多数EGLN3 相关肿瘤研究中,EGLN3 通常作为一种肿瘤抑制因子发挥作用,在多种肿瘤中发现了其蛋白水平的表达下调,与预后呈正相关[4-7],但其在乳腺癌中的表达及功能尚不明确。本研究旨在探讨EGLN3 在乳腺癌中的表达情况及对乳腺癌细胞恶性表型的影响。
1 资料与方法
1.1 一般资料
1.1.1 TCGA 和GTEx 数据库样本 收集TCGA 和GTEx数据库中乳腺癌组织样本及正常组织样本,使用GEPIA 网站(http://gepia.cancer-pku.cn)分析两组间EGLN3 mRNA 表达的差异。
1.1.2 临床样本 选取2010 年1 月至2017 年12 月中国医学科学院北京协和医学院肿瘤医院(以下简称“我院”)乳腺外科收治的经病理确诊的52 例女性乳腺癌患者的癌组织及癌旁组织(病灶周围病理组织检查未见癌组织的正常组织),其中Luminal 型27 例,Her2 过表达型9 例,三阴型16 例,组织提取后置于-80℃冰箱保存备用。患者平均年龄(45.12±10.84)岁,所有患者术前均未接受化疗或放疗。本研究所采用的人体标本经我院医学伦理委员会批准,患者知情同意。
1.2 主要仪器设备及试剂
EGLN3 的小干扰RNA 试剂(O0619,广州市锐博生物科技有限公司);xCELLigence RTCA MP 系统[艾森生物(杭州)有限公司];兔抗EGLN3 抗体(O105174583,1 mg/ml,北京博奥森生物技术有限公司);β-actin抗体(B178893,1 mg/ml,Sigma-Aldrich 公司);逆转录试剂盒(0000361591,美国Progmega 公司)和real time PCR kit(0234845532002,加拿大ABM 公司);脂质体转染试剂LipofectamineTM3000(1831591,美国Life Technologies 公司);BCA 试剂盒(20200625,苏州新赛美生物科技有限公司);RNA 抽提试剂盒(20191231,苏州新赛美生物科技有限公司)。
1.3 研究方法
1.3.1 细胞培养 乳腺癌细胞(ZR-75-1、SK-BR-3、MDA-MB-453、BT474、MCF-7、T47D、MDA-MB-231、CAL-51、HS578T、MDA-MB-468、HCC1937)的培养条件为90% DMEM 培养基,加10%胎牛血清;正常乳腺上皮细胞(MCF-10A)的培养条件为DMEM/F12+表皮细胞生长因子(20 ng/ml)+氢化可的松(0.5 μg/ml)+霍乱霉素(100 ng/ml)+胰岛素(10 μg/ml),加5%马血清。细胞置于37℃、5%CO2培养箱中培养。
1.3.2 瞬时转染 取对数生长期细胞接种于6 孔板,设置空白对照组(NC)、转染敲降组1(siRNA-1)、转染敲降组2(siRNA-2)、转染敲降组3(siRNA-3),基因转染步骤参照LipofectamineTM3000 试剂盒说明书进行。选取EGLN3 高表达的乳腺癌细胞MDA-MB-231转染EGLN3 siRNA,检测其蛋白水平。
1.3.3 real-time PCR 在Bio-rad 仪器上进行real-time PCR 反应,依据SYBR-Green 法半定量,实验至少重复3 次。反应体系如下:1×SYBR-Green Premix EX Taq(perfect real-time)试剂(10 μl),50 ng DNA(1 μl),基因引物0.1 μmol/L(1 μl),用去离子水补齐终体积共20 μl。反应条件为95℃5 min(预变性);95℃5 s(变性)、60℃31 s(退火+延伸),40 个循环;95℃5 s、60℃15 s(熔解曲线)。通过分析产物的溶解曲线来确定扩增的特异性,特异性的引物序列包括EGLN3 正向:5’-AGTACATCGTGCCCTGTCTG-3’,反向:5’-GTGTCGCTTGGAGACGCC-3’;GAPDH 正 向:5’-TGTTGCCATCAATGACCCCTT-3’,反向:5’-CTCCACGACGTACTCAGCG-3’。
1.3.4 Western blot 制备12%的SDS-PAGE 分离胶和5%的积层胶。提取细胞总蛋白后,利用BCA 试剂盒进行酶标仪法蛋白定量,取等量蛋白,加入等体积缓冲液,100℃加热5 min,待蛋白变性后上样。全程100 V 电压跑电泳,直至染料到达最下沿。以0.35 A恒流湿转30 min,将PVDF 膜放入封闭液中(1×PBS+5%脱脂奶粉),室温封闭1 h。封闭液按一定比例稀释一抗,装入杂交袋中,4℃过夜。1×PBST 室温漂洗3 次,每次7 min。封闭液按一定比例稀释二抗,杂交袋室温孵育1 h。1×PBST 室温漂洗3 次,每次7 min。将Western blot Chemiluminescence Luminol Kit 的A 液和B 液等量混合,滴在膜上,使之完全覆盖硝酸纤维素膜。用FUJIFILM 仪器进行曝光。
1.3.5 细胞增殖 转染24 h 后将细胞应用胰蛋白酶消化,培养基终止消化后,以每孔2000 个细胞接种于xCELLigence RTCA MP E-plate 96 孔板,以6 h 为细胞贴壁时间对得到的生长曲线用RTCA Software 进行细胞指数标准化分析细胞的增殖情况。
1.3.6 克隆形成实验 转染24 h 后将细胞应用胰蛋白酶消化,培养基终止消化后,以每孔1000 个细胞接种于6 孔板内,5~6 d 换液,培养10~14 d 后观察细胞克隆形成群落情况。
1.3.7 Transwell 实验 转染24 h 后将细胞应用胰蛋白酶消化,培养基终止消化后,Transwell 小室内加入含2% Matrix 胶的双无DMEM 培养基100 μl,此后取细胞计数1×105个置于小室内,下层加入800 μL含20%FBS 的DMEM 培养基,培养20~24 h,取出观察结果。
1.4 统计学方法
采用SPSS 22.0 统计学软件进行数据分析,使用GraphPad Prism 8 以及R 语言作图,组间比较采用配对t 检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 EGLN3 mRNA 在乳腺癌组织及正常组织中的表达情况
TCGA 和GTEx 数据库共收录1085 例乳腺癌组织和291 例正常组织的相关信息,结果显示,乳腺癌组织EGLN3 mRNA 表达高于正常组织,差异有统计学意义(P <0.05)。见图1。

图1 EGLN3 mRNA 在乳腺癌组织及正常组织的表达情况
2.2 乳腺癌组织及癌旁组织EGLN3 mRNA 表达情况
乳腺癌组织EGLN3 mRNA 表达高于癌旁组织,差异有高度统计学意义(P <0.01),见图2A。在不同分型的亚组分析中,三阴型及Luminal 型乳腺癌组织EGLN3 mRNA 表达高于癌旁组织,差异有高度统计学意义(P <0.01),Her2 型乳腺癌组织与癌旁组织EGLN3 mRNA表达比较,差异无统计学意义(P >0.05),见图2B。

图2 乳腺癌组织及其癌旁组织EGLN3 mRNA 中的表达情况
2.3 正常乳腺上皮细胞及乳腺癌细胞中EGLN3 蛋白的表达情况
EGLN3 蛋白在乳腺癌细胞MDA-MB-231、CAL-51、MDA-MB-468 和HCC1937 中高表达,而在正常乳腺上皮细胞及其他乳腺癌细胞中不表达。见图3。

图3 EGLN3 在正常乳腺上皮细胞及各乳腺癌细胞系中的表达情况
2.4 转染siRNA 敲降EGLN3 后的Westernblot 实验结果
siRNA-1 与siRNA-3 中EGLN3 蛋白表达下降,siRNA-2 中EGLN3 蛋白表达未下降。见图4。

图4 转染siRNA 敲降EGLN3 后的Western blot 实验结果
2.5 敲降EGLN3 对乳腺癌细胞的增殖、克隆形成的影响
敲降EGLN3 后,乳腺癌细胞的增殖能力、细胞克隆形成能力均下降。见图5。

图5 敲降EGLN3 对乳腺癌细胞的增殖、克隆形成的情况
2.6 敲降EGLN3 对乳腺癌细胞的侵袭、迁移能力的影响
敲降EGLN3 后乳腺癌细胞的侵袭、迁移能力下降。见图6。
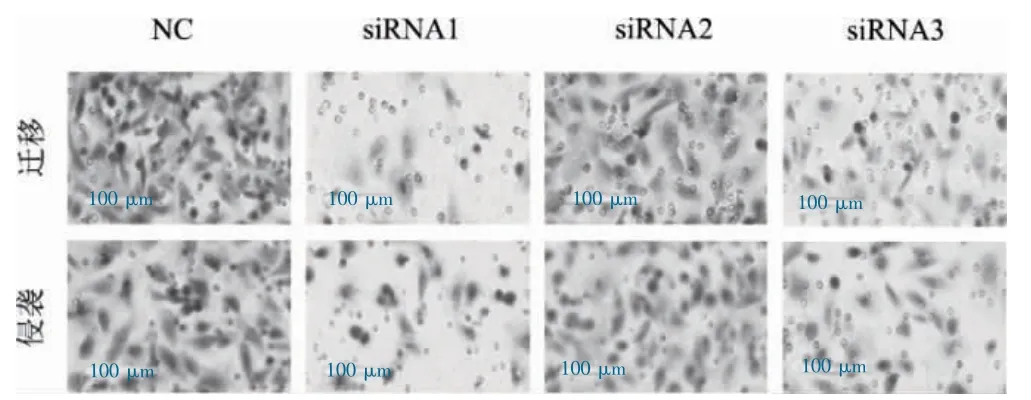
图6 敲降EGLN3 对乳腺癌细胞的侵袭、迁移能力
3 讨论
近年来研究发现,HIF 本身并不能感受氧分压的变化,需要脯氨酸羟化酶来感受氧分压变化,并使HIF-1α 的数量保持稳定[8]。HIF-1α 可以激活多种致癌途径基因的表达,如血管内皮生长因子及促红细胞生成素,促进肿瘤血管生成[9-10],同时HIF-1α 可通过介导丙酮酸激酶同工酶2 的转录参与肿瘤细胞代谢重编程[11],也可通过诱导E-钙黏蛋白缺失,通过上皮间质转化增强肿瘤的侵袭性[12]。
目前已知的研究中,EGLN3 属于HIF-1α 的负调节因子,广泛存在于生物体内[13-15],EGLN3 可以作为支架蛋白,促进表皮生长因子受体的内化作用从而调节其活性[16-17],也可以通过调控血小板源性生长因子通路控制肿瘤生长和血管结构,这些非HIF 途径相关靶蛋白通路的发现暗示其蕴藏了更多的潜力[18-19]。在人胶质瘤中,EGLN3 的功能缺失可以造成明显的细胞增殖[20],也可以通过p53 抑制干细胞相关基因NANOG的表达,抑制结肠癌干细胞特性[3]。在胰腺癌中,过表达EGLN3 可以抑制胰腺癌细胞接受放疗后的增殖及克隆能力,加速细胞凋亡[21],EGLN3 的低表达也与肝癌患者的不良预后相关[22]。但同时其在部分肿瘤中却发挥相反的作用,如在人类头颈部鳞状细胞癌之中,敲降EGLN3 后,肿瘤细胞在缺氧状态下生长能力明显减弱[23],在胰腺癌中,EGLN3 可通过调控羟脯氨酸水平,促进癌细胞的转移[24]。
本研究结果显示,转染siRNA 后细胞的增殖、克隆形成、侵袭、迁移均有所减弱,提示敲降EGLN3 可以抑制乳腺癌细胞的恶性表型,因此推断EGLN3 促进了乳腺癌细胞的增殖、转移,起到癌基因的作用。同时在细胞系Western blot 检测中,EGLN3 蛋白在乳腺癌细胞系MDA-MB-231、CAL-51、MDA-MB-468 和HCC1937 中高表达,这4 种细胞系同属于三阴型乳腺癌细胞系[25],侵袭能力较强,因此推断EGLN3 高表达可能是高侵袭型乳腺癌细胞系的特点之一。
综上所述,本研究发现EGLN3 在乳腺癌中高表达,在乳腺癌细胞中敲降EGLN3 的表达后,细胞的增殖、克隆形成、侵袭和迁移能力均下降。EGLN3 可能作为癌基因,在乳腺癌的发生发展中发挥作用。本实验为乳腺癌的诊断及防治提供证据,为乳腺癌的生物治疗提供理论基础。
