化学发光免疫分析法检测尿液中N1,N12-二乙酰精胺含量的研究
2021-11-27杨梦瑶吴雨晴刘辰辰刘俊伟
杨梦瑶 ,吴雨晴 ,刘辰辰 ,郭 宇,刘俊伟
(1. 天津国际生物医药联合研究院 天津 300457;2. 南开大学药学院 天津 300350)
有研究表明快速生长的组织一般都有活性的多胺合成体系,尤其是肿瘤的快速生长亦有赖于多胺含量的显着增长[1]。作为精胺的二乙酰化衍生物,N1,N12-二乙酰精胺(N1,N12-diacetylspermine,DiAcSpm)对于非小细胞肺癌患者,尤其是Ia临床阶段患者的灵敏度比其他肿瘤标志物都要高[2],并且尿液中的DiAcSpm可作为生存率的独立预后因素[3-4]。图1为N1,N12-二乙酰精胺的化学结构式。在不同临床阶段,DiAcSpm对结肠癌检测的灵敏度也高于CEA和CA19-9[5]。同时,因为不同个体之间N1,N12-二乙酰精胺的尿液含量差别较小,所以通过DiAcSpm含量变化来检测癌症的发生相对于总多胺或其他多胺类化合物而言准确率较高[6-8]。
但是由于DiAcSpm缺乏伯氨基,再加上其在尿液中的含量低于0.5%,以常规的仪器分析手段无法满足检测需求,需用GC-MS、HPLC-MS以及MSICE-MS/MS[9-10]等高灵敏度检测仪器。这些仪器检测用时长、价格昂贵,无法满足临床上的日常检测[11]。本研究以N1-乙酰精胺为半抗原,通过与载体蛋白偶联制备出N1,N12-二乙酰精胺人工抗原,通过免疫动物获得抗DiAcSpm特异性抗体,结合化学发光免疫分析法建立了可用于人体尿液样本中N1,N12-二乙酰精胺的快速检测方法。
1 实验部分
1.1 仪器和试剂
N1-乙酰精胺(美国Cayman Chemical公司);N1,N12-二乙酰精胺(美国Quality Control Chemicals公司);戊二醛(50%)、牛血清蛋白(BSA)、卵清蛋白(OVA)、脱脂奶粉、Triton X-100、吐温-20(上海生工生物工程有限公司);明胶(苏州亚科科技股份有限公司);鱼皮胶(德国Sigma-Aldrich 公司);弗氏佐剂(德国Sigma-Aldrich 公司);化学发光底物(湖州英创生物科技公司);HRP-山羊抗兔IgG(英国Abcam公司);BS3(美国Thermo Fisher Scientific公司);大耳白兔(天津科奥公司);Protein A亲和层析柱(美国GE公司);其他试剂均为分析纯(国药集团化学试剂有限公司)。
1.2 实验方法
1.2.1 人工抗原与抗体的制备
以BS3为交联剂,将半抗原N1-乙酰精胺与载体蛋白偶联,制备二乙酰精胺人工抗原。通过免疫日本大耳白兔,获得抗DiAcSpm血清。采用亲和层析法纯化得到抗DiAcSpm抗体,具体方法见参考文献[12]。
1.2.2 化学发光免疫分析法检测步骤
将包被原100µL/孔固定在96孔板中,37℃孵育2h后洗板。每孔加入200µL封闭1h后洗板。
每孔分别加入50µL标准品(或待测样品)以及抗DiAcSpm抗体后37℃孵育,洗板后加入HRP-山羊抗兔IgG 100µL/孔,37℃孵育30min后洗板。加入化学发光底物后立即用化学发光仪测定每孔的相对发光强度(Relative light units,RLU),并根据RUL计算抑制率,进而绘制标准曲线或计算待测样含量。
1.2.3 实验条件的优化
通过单因素实验,本研究考察了包被原浓度、封闭液种类、一抗稀释倍数、竞争反应时间以及化学发光底物稀释倍数等参数对检测性能的影响;通过比较半抑制浓度IC50及RLUmax/ IC50比值作为评价各影响因素的标准,确定最优反应条件[13]。
1.2.4 标准曲线的建立
按照以上确定好的优化条件进行化学发光检测实验,以DiAcSpm浓度为横坐标、抑制率为纵坐标建立标准曲线。本研究以IC50值作为方法的灵敏度,以IC25值作为最低检测限。
1.2.5 尿液样品前处理
由于尿液成分复杂,可能会干扰对DiAcSpm含量的检测,在实际检测时必须对样品进行前处理,以降低样品本身对检测的影响。本实验尝试不同的样品稀释液及不同的稀释倍数,通过添加回收实验确定了尿液样品的前处理方法。
2 结果与讨论
2.1 实验条件的优化
通过对实验参数进行摸索,确定了实验参数:包被原浓度为2.5µg/mL;封闭液为脱脂奶粉/PBS;一抗稀释倍数为3000倍;竞争反应时间为30min;HRP-山羊抗兔IgG的稀释倍数为1×104倍;化学发光底物稀释4倍。在此基础上,本实验建立化学发光免疫分析法的标准曲线,见图2,得到线性回归方程:
该检测方法的灵敏度(IC50)为(1.74±0.09)ng/mL (n=3),最低检出限(IC25)为(0.19±0.04)ng/mL (n=3)。
2.2 尿液样品前处理研究
本实验以鱼皮胶为掩蔽剂,通过不同浓度的溶液稀释DiAcSpm而得到不同的抑制曲线,将其与标准曲线比较后,选取了抑制曲线重合程度最好的0.5%鱼皮胶/PBS溶液为尿液样品稀释液。本实验在尿液样品稀释2倍、5倍、10倍和20倍的基础上分别进行了添加回收实验,通过计算回收率的高低来确定样品稀释倍数。结果如表1所示:以2倍稀释尿样测得样本添加回收率为98.2%~151.8%,以5倍稀释尿样测得样本添加回收率为92.8%~104.1%,以10倍稀释尿样测得样本添加回收率为79.7%~118.9%,以20倍稀释尿样测得样本添加回收率为86.3%~135.2%,由此可见各个稀释倍数均能满足该检测方法所需的准确度,但是为了减少尿液稀释倍数且尽量减少尿液本身对检测的影响,确保检测结果的准确性,最终选择以0.5%鱼皮胶/PBS溶液稀释5倍的处理方法。
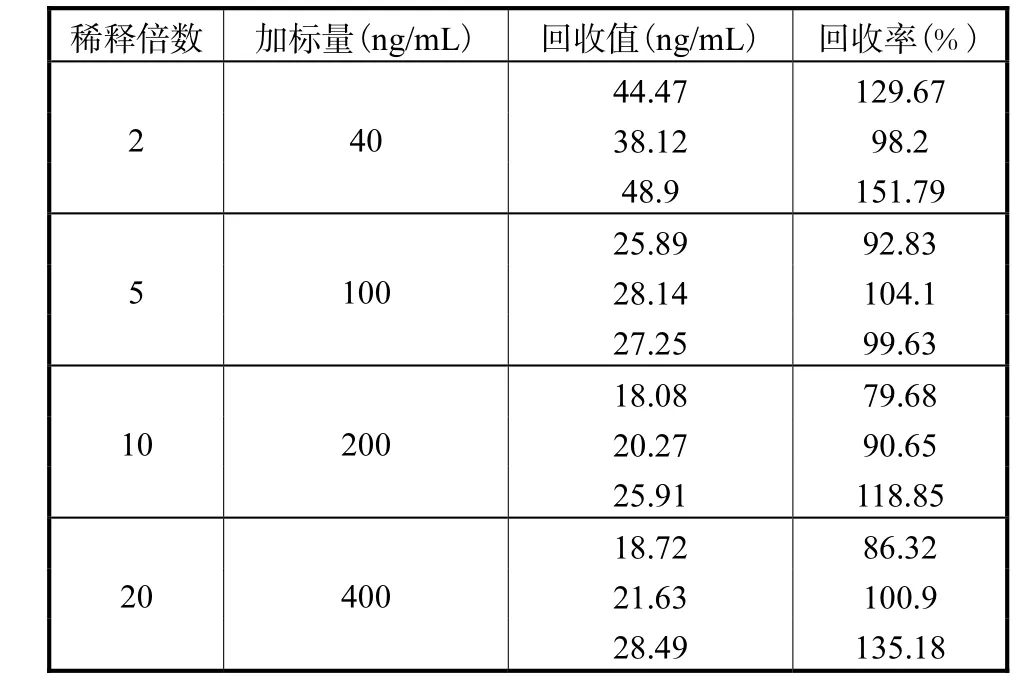
表1 尿样前处理中稀释倍数选择的结果Tab.1 Results of dilution fold selection in urine sample pretreatment
2.3 样品准确性研究
本实验选取了3份正常人尿液样本,分别向其中添加了25ng/mL、50ng/mL和100ng/mL N1,N12-二乙酰精胺,在最佳实验条件下测定并计算回收率。结果见表2。该方法的回收率在80.02%~102.69%之间,准确度和稳定性较好,可用于实际样品检测。
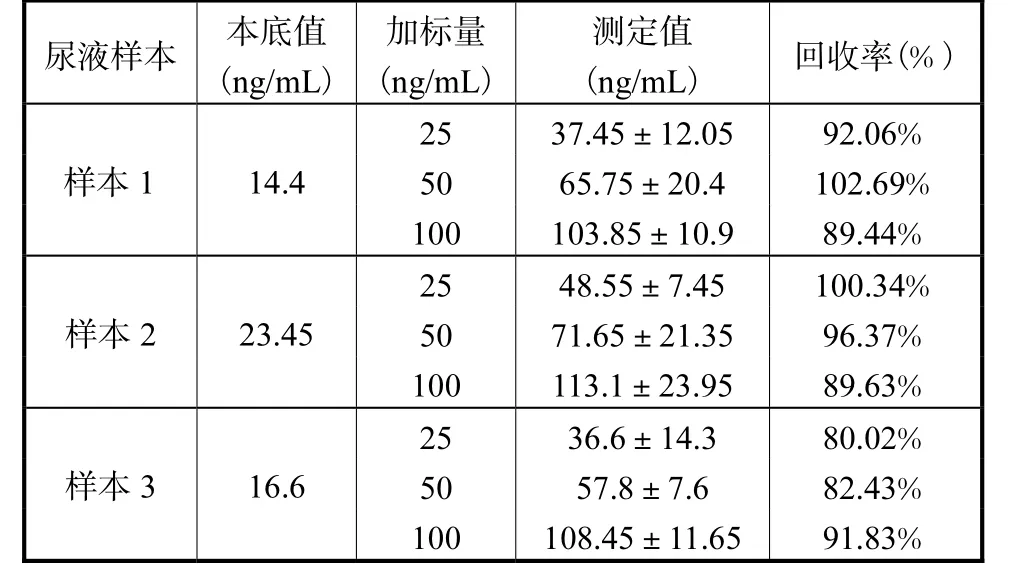
表2 尿液样本中N1,N12-二乙酰精胺回收率测定(n=3)Tab.2 Determination of recovery rate of N1,N12-diacetylspermine in urine samples(n=3)
3 结论
本研究利用多克隆抗体建立的用于检测人体尿液样本的化学发光免疫分析方法,具有灵敏度高、准确度好,样品前处理简单等优点。其灵敏度(IC50)为(1.74±0.09)ng/mL,最低检出限(IC25)为(0.19±0.04)ng/mL,尿液样品的添加回收率为80.02%~102.69%。本研究将为N1,N12-二乙酰精胺的高效定量检测提供借鉴,为开发快速检测试剂盒奠定基础,从而有利于在临床上进行癌症患者的早期筛查及预后评估。
