肝细胞肝癌治疗前后MRI-PWI参数、sFas、miR-224含量变化及对短期生存状况的预测价值
2021-11-26郑雪丽黄宝生王颖超燕丽红
朱 宏 郑雪丽 黄宝生 王颖超 燕丽红
(1.河西学院附属张掖人民医院;2.河西学院临床医学院,甘肃 张掖 734000)
据统计,肝细胞肝癌(Hepatocellular carcnoma,HCC)病死率居所有癌症相关死亡的第2 位,严重威胁患者生命安全,给予HCC 患者及时有效治疗尤为重要[1-2]. 目前经皮肝动脉化疗栓塞术(Transcatheter hepatic arterial chemoembolization,TACE)在HCC 患者中应用价值受到临床医师广泛认可,但对其疗效评估方面存在一定争议[3].磁共振成像(Magnetic resonance imaging,MRI)是评估TACE疗效的影像学手段之一,但其多依赖于肿瘤形态学改变评估疗效,具有一定局限性.而磁共振灌注成像(MRI-perfusion weighted imaging,MRI-PWI)通过灌注参数值进行定量分析,能有效弥补MRI不足.可溶性Fas(Soluble Fas,sFas)是肿瘤坏死因子受体超家族成员之一,在HCC患者中呈过表达[4].新近研究表明,微小RNA-224(microRNA-224,miR-224)可促进肝癌细胞增殖、迁移、侵袭,并抑制其凋亡[5],但关于其与HCC患者疗效、生存状况关系尚需进一步探究.鉴于此,本研究选取89例HCC患者,观察MRI-PWI参数、sFas、miR-224含量变化,分析其与疗效、短期生存状况关系,以期为临床确定治疗措施提供依据.
1 资料与方法
1.1 临床资料
选取2018 年1 月~2019 年10 月我院89 例HCC 患者作为研究对象,(1)纳入标准:符合《内科学》HCC诊断标准[6],结合病理检查确诊;年龄18~80岁;Child-Puch分级B级、C级;均成功施行TACE;生存周期>12周;患者及家属知晓并签署同意书;(2)排除标准:其他恶性肿瘤者;心脑血管疾病者;入组前4周接受免疫制剂治疗者;MRI-PWI不耐受者.其中男48例,女41例;年龄18~80岁,平均(49.11±13.89)岁;体质量指数(BMI)18~25 kg/m2,平均(21.56±1.38)kg/m2;肿瘤数目:38例≥2个,51例<2个;肿瘤直径:35例≥5cm,54例<5cm;分化程度:37例中高分化,52例低分化;Child-Puch 分级:49 例B 级,40 例C 级;微血管浸润:37 例有,52 例无;淋巴结转移:35例有,54例无.本研究经医院伦理委员会审核批准.
1.2 方法
1.2.1 MRI-PWI 检测 检查前,禁食12h,仰卧位,叮嘱受检者胸式呼吸,应用GE Discovery MR 750 3.0 T MR扫描仪及8通道体部相控阵线圈,先行常规轴位T1WI、T2WI扫描,随后经高压注射液于肘前静脉团注对比剂扎喷酸葡胺注射液,剂量0.2mmol/kg,速度4ml/s,同时追加20ml生理盐水,更换至PWI模式,定位像为屏气冠状位T1WI,使用body线圈,快速扰相GRE序列,TE1.3ms,TR5.3ms,矩阵256×256,FOV34×26,层厚8.0mm,NEX1.0,间隔2.0mm,扫描时间3min,每3s进行1 次全肝采集.所得原始图像上传至AW4.3 工作站,以相关软件处理,选取病灶横截面积最大、信号最强的层面绘制感兴趣区(ROI),获得容积转运常数(Ktrans)、血管外细胞外间隙容积比(Vc),所有数据连续测量3次,取均值.由2名高年资医师盲法判断,意见不统一时,请教上级医师,得出统一结论.
1.2.2 血清指标检测 (1)标本采集:清晨8:30~9:30,抽取4ml 外周静脉血,分为两份(各2 ml),静置20min,以2500r/min速度离心15min,取上清液,-70℃保存备用.(2)sFas:应用全自动生化分析仪(日本日立公司,HITACHI7180型),以双抗体酶联免疫法测定血清sFas水平.由我院检验科医师完全参照试剂盒说明书操作.(2)miR-224:取2ml 血清标本,参照德国Qiagen 公司提供miRNeasy 血清试剂盒提取总RNA,RNA 质量以分光光度计评估,所有洗脱RNA 样品经DNA 酶Ⅰ(Sigma)处理;以miScriptⅡRT 试剂盒(Aiagen)逆转录成熟miRNA,参照Applied Biosystem 7500 实时RCP系统进行实时定量聚合酶链式反应(QRT-PCR),反应体系20 μl,反应条件:94℃预变性2min,94℃20s,60℃30s,60℃34s,共35~40 个循环反应,miR-224 引物:s:5,-GTCGTATC⁃CAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTAAACG-3,as:5,-CGCAAGTCCTAGTG⁃GTTCCG-3,;U6引物:s:5,-CTCGCTTCGGCAGCACA-3,,as:5,-AACGCTTCACGAATTTGC⁃GT-3,,上述引物均由上海生工生物工程有限公司合成,每个miRNA的相对表达量用2-△△Ct表示,△△Ct=(CtHCC-miR224-CtHCC-u6)-(CtNC-miR224-ctNC-u6),每个样本重复3次试验.
1.2.3 治疗方法 所有患者均行TACE,利多卡因(浓度2%)局麻,Terumo股动脉专用套管针进行一次性穿刺,置入5F动脉鞘管,先行腹腔动脉、肝总动脉及肠系膜上动脉常规造影,确定肿瘤大小、部位、血供,自肿瘤供血血管注入25mg吡柔比星+700mg氟尿嘧啶,同时将10mg吡柔比星与2 ml碘化油混合液与一定量明胶海绵颗粒栓塞靶动脉,每月1次,连用2次,术后常规给予保肝、抗生素、止痛等药物.
1.3 疗效评价
参照实体瘤疗效评价标准评估,完全缓解(CR):目标病灶动脉期增强显影消失;部分缓解(PR):目标病灶直径总和缩小30%及以上;疾病稳定(SD):目标病灶直径总和缩小29%及以下;疾病进展(PD):目标病灶直径总和增大20%及以上,或出现新病灶.将CR、PR、SD 归入稳定,PD归入进展.
1.4 观察指标
(1)HCC患者治疗前、治疗后4周MRI-PWI参数、血清sFas、miR-224水平.(2)不同疗效患者治疗前、治疗后4周MRI-PWI参数、血清sFas、miR-224水平.(3)不同生存状况治疗前、治疗后4周患者MRI-PWI 参数、血清sFas、miR-224水平.(4)MRI-PWI参数、血清sFas、miR-224水平单一或联合预测HCC死亡价值.(5)MRI-PWI参数、血清sFas、miR-224水平与HCC患者死亡关系.
1.5 统计学处理
2 结果
2.1 治疗前后各指标
89例HCC患者治疗后4周miR-224、sFas、Vc、Ktrans低于治疗前(P<0.05).见表1.
表1 治疗前后各指标(±s)
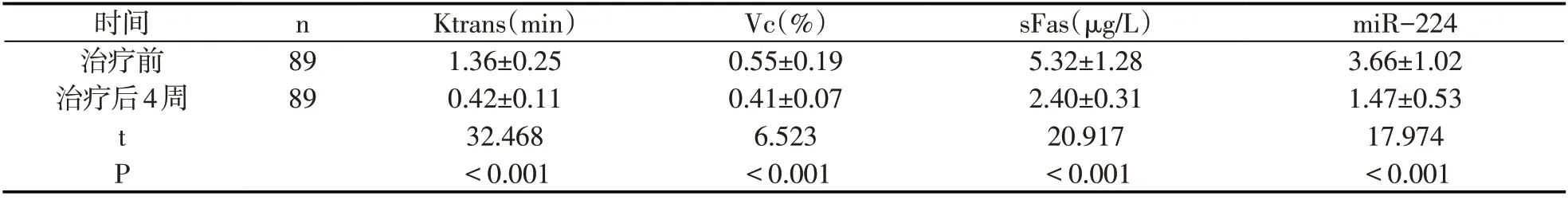
表1 治疗前后各指标(±s)
时间治疗前治疗后4周n 89 89 t P Ktrans(min)1.36±0.25 0.42±0.11 32.468<0.001 Vc(%)0.55±0.19 0.41±0.07 6.523<0.001 sFas(μg/L)5.32±1.28 2.40±0.31 20.917<0.001 miR-224 3.66±1.02 1.47±0.53 17.974<0.001
2.2 进展及稳定患者治疗前后各指标
治疗前进展及稳定患者sFas、miR-224、Vc、Ktrans比较,无显著差异(P>0.05),治疗后4周稳定患者miR-224、sFas、Vc、Ktrans低于进展患者(P<0.05).见表2.
表2 进展及稳定患者治疗前后各指标(±s)
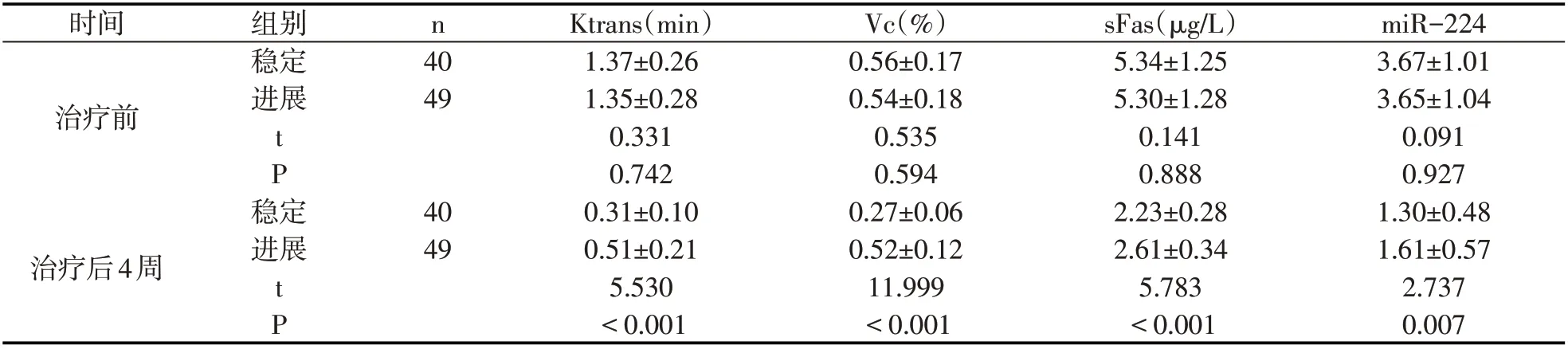
表2 进展及稳定患者治疗前后各指标(±s)
时间n治疗前组别稳定进展40 49 tP稳定治疗后4周进展40 49 tP Ktrans(min)1.37±0.26 1.35±0.28 0.331 0.742 0.31±0.10 0.51±0.21 5.530<0.001 Vc(%)0.56±0.17 0.54±0.18 0.535 0.594 0.27±0.06 0.52±0.12 11.999<0.001 sFas(μg/L)5.34±1.25 5.30±1.28 0.141 0.888 2.23±0.28 2.61±0.34 5.783<0.001 miR-224 3.67±1.01 3.65±1.04 0.091 0.927 1.30±0.48 1.61±0.57 2.737 0.007
2.3 生存及死亡患者各指标
治疗后随访12 周,发现12 例死亡,77 例生存.治疗前生存及死亡患者sFas、miR-224、Vc、Ktrans比较,无显著差异(P>0.05),治疗后4周生存患者miR-224、sFas、Vc、Ktrans低于死亡患者(P<0.05).见表3.
表3 生存及死亡患者治疗前后各指标(±s)
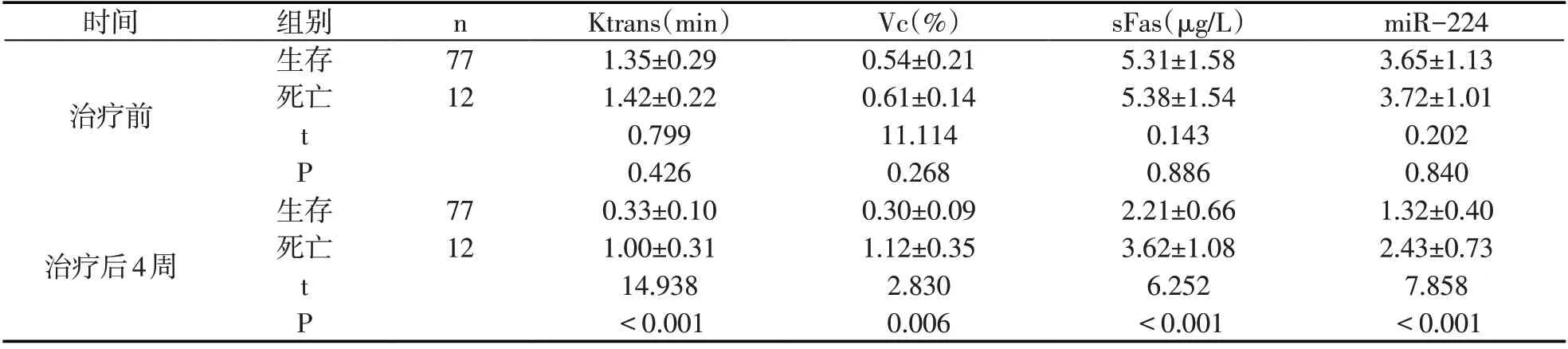
表3 生存及死亡患者治疗前后各指标(±s)
时间n治疗前组别生存死亡77 12 t P生存治疗后4周死亡77 12 t P Ktrans(min)1.35±0.29 1.42±0.22 0.799 0.426 0.33±0.10 1.00±0.31 14.938<0.001 Vc(%)0.54±0.21 0.61±0.14 11.114 0.268 0.30±0.09 1.12±0.35 2.830 0.006 sFas(μg/L)5.31±1.58 5.38±1.54 0.143 0.886 2.21±0.66 3.62±1.08 6.252<0.001 miR-224 3.65±1.13 3.72±1.01 0.202 0.840 1.32±0.40 2.43±0.73 7.858<0.001
2.4 单一及联合预测HCC患者死亡价值
ROC 显示,联合预测HCC 患者死亡价值的AUC 为0.881(95%CI:0.795~0.940),诊断敏感度及特异度分别为83.33%、89.61%,其次为Ktrans 0.827(0.733~0.899)、Vc 0.811(0.714~0.886)、miR-224 0.805(0.708~0.882)、sFas 0.797(0.699~0.875).见表4,图1~2.
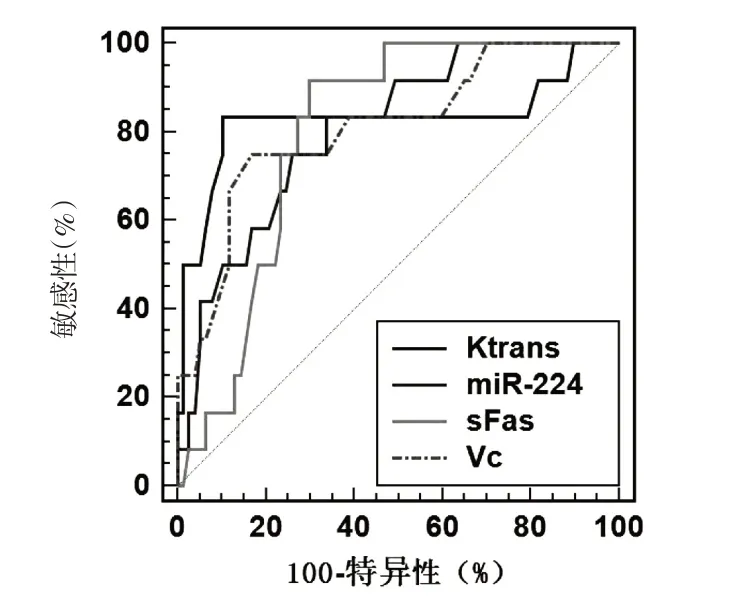
图1 单一预测HCC患者死亡价值

表4 单一及联合预测HCC患者死亡价值
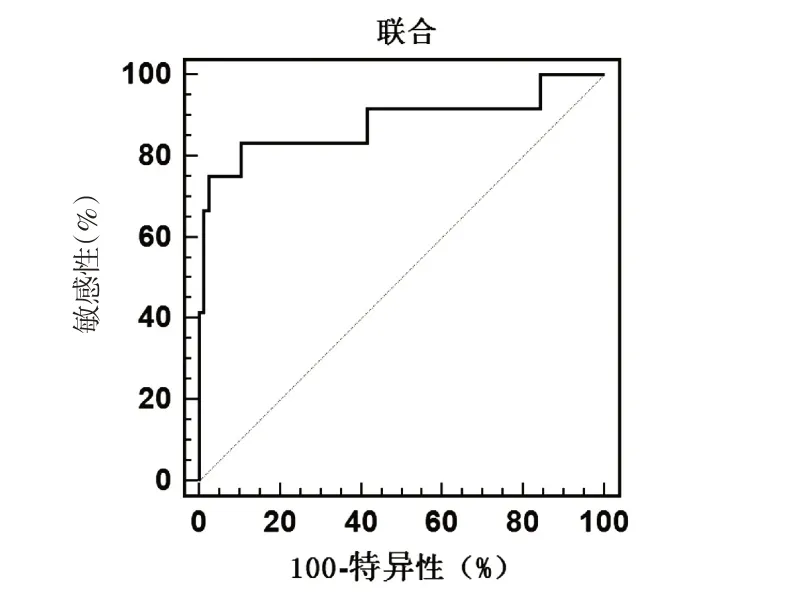
图2 联合预测HCC患者死亡价值
2.5 各指标与生存状况关系
根据ROC分析sFas、miR-224、Vc、Ktrans最佳截断值分为高危组和低危组.KM曲线显示,sFas、miR-224、Vc、Ktrans 高危组生存率低于低危组(χ2分别为8.667、6.489、4.680、6.782,P<0.05).见图3~6.
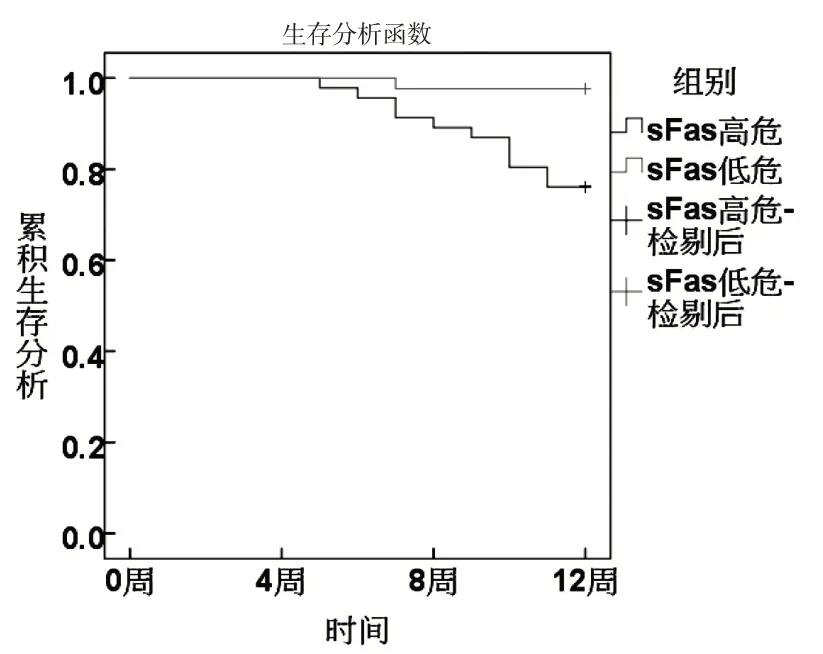
图3 sFas与生存状况关系
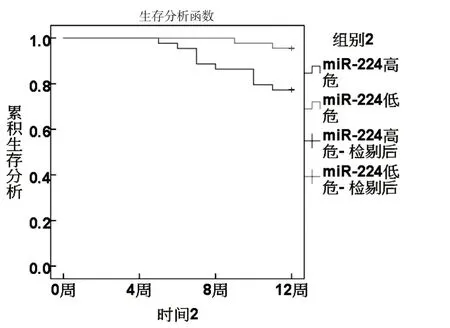
图4 miR-224与生存状况关系
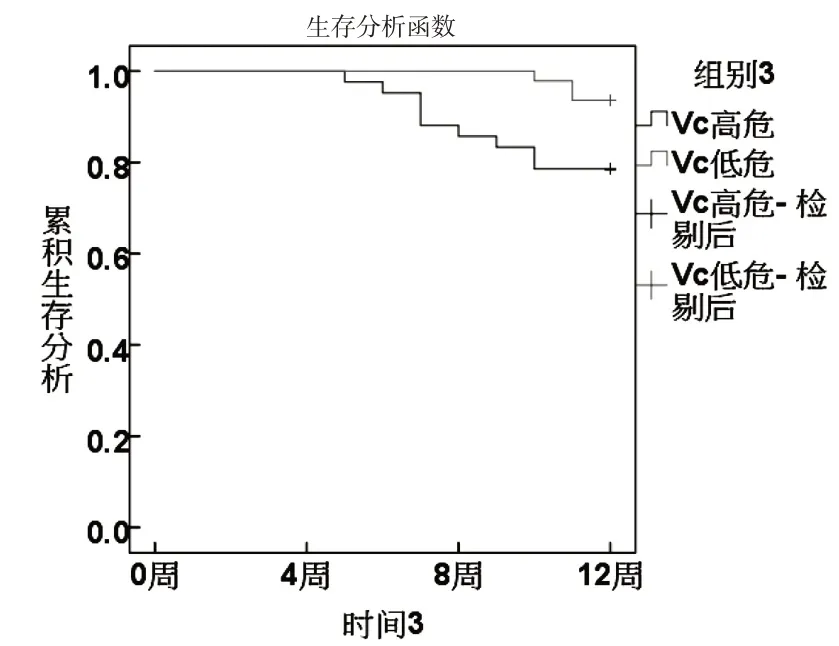
图5 Vc与生存状况关系
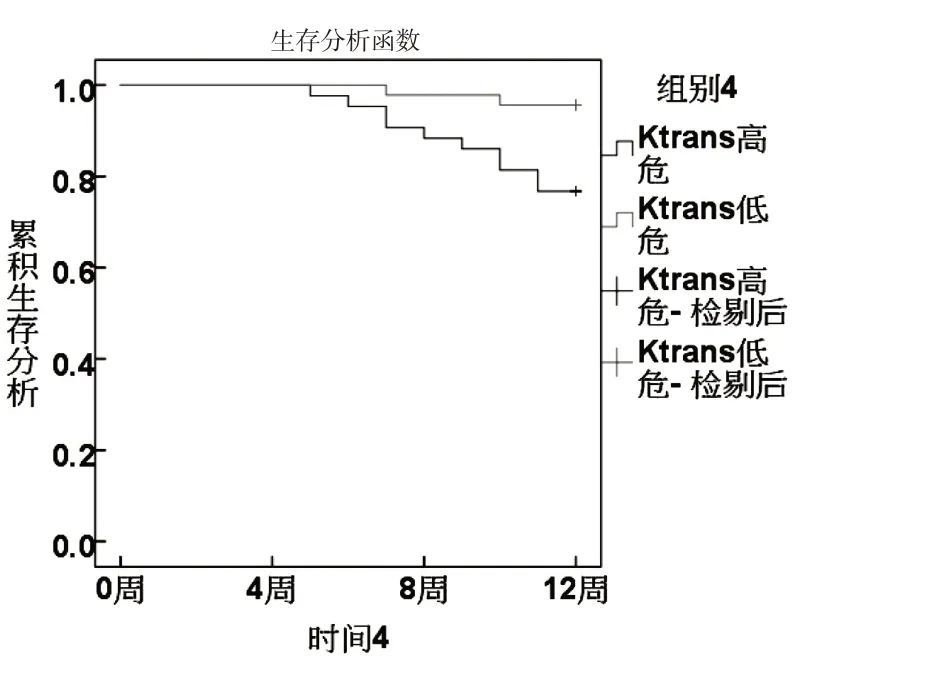
图6 Ktrans与生存状况关系
2.6 logistic回归分析影响HCC患者死亡因素
以HCC患者是否死亡作为因变量,分化程度、肿瘤直径、Child-Pugh 分级、肿瘤数目、微血管侵犯、淋巴结转移、sFas、miR-224、Vc、Ktrans 作为自变量纳入logistic 回归模型,结果显示,低分化程度、肿瘤直径≥5cm、肿瘤数目≥2个、Child-Pugh 分级C级、微血管侵犯、淋巴结转移、sFas≤2.50μg/L、miR-224>2.06、Vc>0.82%、Ktrans>1.01min是影响HCC患者死亡危险因素(P<0.05).见表5.
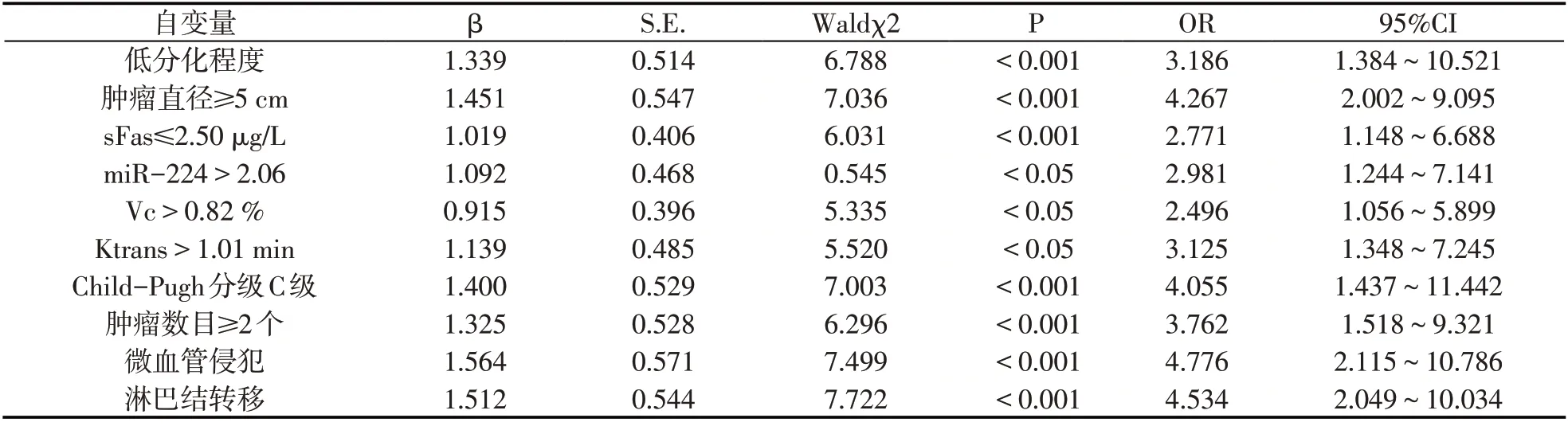
表5 logistic回归分析影响HCC患者死亡因素
3 讨论
HCC是恶性程度最高肿瘤性疾病,易于复发和远处转移,因而临床治疗效果差,病死率高[7].发病初期,HCC 患者无特异性临床表现,确诊时已属中晚期,需采取TACE 等介入治疗.TACE 作用机制是将抗癌药物直接作用于病变部位,杀伤肿瘤细胞,结合栓塞可影响肿瘤细胞血供,导致肿瘤细胞死亡,但其无法完全杀伤肿瘤细胞,需行多次TACE,特别是瘤体巨大者[8-9].如何客观评价TACE疗效,了解TACE介入术后肿瘤坏死程度,对临床调整治疗方案具有积极意义.
目前,TACE的疗效判断主要依赖于MRI,但常规肝脏MRI检查序列多局限于形态学,随医学技术快速发展,影像医学正从单纯形态学逐步向形态学结合反映细胞、分子水平生理生化改变的功能学检查发展[10-11].PWI可无创性反映组织血管化程度及血流灌注情况,量化分析组织及肿瘤血管动力学方面信息,现已广泛应用于神经系统、肌肉骨关节系统.传统观念认为,PWI易受脉搏、呼吸、肠道蠕动等因素影响,难以在肝脏、胃等腹部脏器广泛应用[12].近年随磁共振快速及超快速成像序列开发及应用,成像时间、信噪比得到明显改善,腹部磁共振灌注成像质量得到明显提高,对实现磁共振肝脏灌注成像提供有利依据.本研究给予89例接受TACE 的HCC患者MRI-PWI检查,结果发现,治疗后4周Ktrans低于治疗前,且稳定患者Ktrans低于进展患者(P<0.05),与朱正[13]研究结果相符,提示Ktrans值越低,HCC患者TACE疗效越好.Vc是对比剂在组织血管外细胞外间隙所占容积比,资料显示,恶性肿瘤Vc值高于正常组织,并指出对TACE治疗有效的肿瘤组织Vc值会降低[14],究其原因在于,TACE 治疗后,肿瘤血供受化疗药物、碘油填充破坏较大,坏死较彻底,肿瘤体积缩小更为明显,Ktrans 及Vc值下降越明显.本研究随访12周发现,生存患者Vc、Ktrans 低于死亡患者(P<0.05),说明Vc、Ktrans 升高可能与HCC 患者生存状况有关.ROC 显示,Vc、Ktrans 升高可作为HCC 患者死亡预测指标之一. logistic 回归分析显示,Vc>0.82%、Ktrans>1.01min为患者死亡的独立危险因素,提示MRI-PWI 参数升高会增加HCC 患者死亡风险,需及时给予相应治疗.
HCC发生发展与细胞凋亡密切相关,而sFas可能是肝癌细胞凋亡途径之一[15].sFas可结合sFas配体,刺激半胱天冬蛋白酶,导致细胞发生蛋白水解,诱导肝癌细胞凋亡.亦有研究表明,原发性肝癌患者血中sFas水平高于健康体检者[16].sFas可抑制FasL诱导的淋巴细胞凋亡,增加体内激活淋巴细胞数量,参与原发性肝癌病理过程.鲁玉娟等[17]研究指出,香菇多糖联合TACE可降低原发性肝癌患者sFas水平.但目前关于HCC患者经TACE治疗后sFas水平变化研究较少,故本研究对此进行分析,发现治疗4周后血清sFas水平低于治疗前,且稳定患者低于进展患者,可能与TACE治疗后肿瘤病灶肝动脉及门静脉供血得到治疗有关,亦从侧面反映高sFas 可能与HCC 患者TACE 治疗疗效有关.本研究还发现,治疗4 周后生存患者sFas 低于死亡患者(P<0.05),说明HCC 患者sFas持续升高会导致淋巴细胞凋亡延迟,加剧肝组织损伤,进而导致患者死亡.ROC 显示,sFas 预测HCC 患者死亡价值的AUC 为0.797.logistic 回归分析显示,sFas 是HCC 患者死亡的独立危险因素.上述结果均说明sFas水平越高,HCC患者死亡风险越大,建议临床及时采取治疗措施,以降低死亡率.
近年miR-224与肿瘤形成、复发转移关系成为当前生物医学研究热点领域.相关研究指出,血清miR-224 在HCC 患者中平均表达量约为健康人的10 倍,推测是由于肝癌组织中高表达的miR-224 以一定方式释放入外周血所致[18].亦有学者发现,血清miR-224 浓度与肝癌组织浓度呈正相关,手术切除肿瘤组织后,其浓度明显下降[19-20].上述结果提示HCC患者血清miR-224浓度升高可能与肿瘤组织有关,但其释放机制尚未清晰.本研究结果显示,89例HCC患者治疗后4周miR-224低于治疗前,且稳定患者低于进展患者(P<0.05),可能与TACE能缩小肿瘤体积,降低血清miR-224 水平有关,同时说明miR-224 有望成为评估TACE 疗效的生物学标志物之一.另有研究报道,血清miR-224 与HCC 患者临床分期、病理分化程度密切相关,可增加肿瘤侵袭性,引起肿瘤转移,加剧病情进展,降低患者生存率[21].本研究还发现,治疗后4周生存患者miR-224低于死亡患者(P<0.05),说明miR-224对HCC患者死亡具有一定预测价值.同时多因素回归分析显示,miR-224 是HCC 患者死亡独立危险因素,有助于临床医师早期预测死亡风险,确定合理治疗方案.此外,ROC 曲线显示,联合预测HCC 患者死亡价值的AUC 为0.881,提示临床应重视MRI-PWI 参数、sFas、miR-224联合预测HCC死亡价值,及时调整治疗方案,降低HCC患者死亡风险.
综上可知,HCC患者TACE治疗后MRI-PWI参数、sFas、miR-224较治疗前减低,联合检测能较好预测HCC患者生存状况,为临床诊治提供科学依据.
