碳酸铵对意大利青霉的作用机制及对不同柑橘果实品质的影响
2021-11-26许金娟杨书珍张美红李笑影彭丽桃
许金娟,杨书珍,张美红,李笑影,彭丽桃
碳酸铵对意大利青霉的作用机制及对不同柑橘果实品质的影响
许金娟,杨书珍,张美红,李笑影,彭丽桃※
(华中农业大学食品科技学院,武汉 430070)
为了寻求一种安全有效的方法防治由意大利青霉()引起的柑橘青霉病,该研究分析了碳酸铵抑制意大利青霉生长的可能作用机制及对脐橙、皇帝柑、沃柑3种不同类型柑橘贮藏品质的影响。结果表明,碳酸铵能抑制意大利青霉孢子萌发和菌丝生长,且呈现剂量依赖效应,在质量浓度分别为0.4和0.8 g/L时可完全抑制孢子萌发和菌丝生长。结构观察表明,碳酸铵引起菌丝生长节点稀疏和分支减少;超微结构观察发现菌丝严重皱缩,菌丝线粒体结构异常。生理生化分析表明,碳酸铵处理引起线粒体的钠/钾离子ATP酶(Na+/ K+-ATPase)、钙离子ATP酶(Ca2+-ATPase)和镁离子ATP酶(Mg2+-ATPase)活性下降,导致还原型谷胱甘肽(Reduced Glutathione,GSH)含量及谷胱甘肽还原酶(Glutathione Reductase,GR)活性降低,活性氧清除体系超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)活性紊乱,促进H2O2积累。添加活性氧清除剂半胱氨酸(Cysteine,Cys)能部分恢复碳酸铵处理的病菌孢子萌发。活体接种表明,16 g/L碳酸铵处理显著减小了柑橘果实接种意大利青霉的病斑直径(<0.05),减轻果实发病。碳酸铵处理能降低3种类型柑橘果实自然发病率,且对果实失重率、色泽、可溶性固形物、可滴定酸、维生素C、还原糖含量无不良影响。结果表明,碳酸铵通过损伤意大利青霉菌丝线粒体结构和功能,促进活性氧积累来发挥抗真菌活性,可以作为杀菌剂的绿色有效替代品,研究结果可为碳酸铵防治柑橘果实采后腐烂提供参考。
贮藏;品质控制;意大利青霉;线粒体;碳酸铵;活性氧;作用机理;柑橘
0 引 言
柑橘是世界上主要的水果之一,橙、柑、橘、柚、柠檬等是商业上重要的柑橘类型[1]。柑橘在采后贮藏运输环节易受多种病原菌侵染,造成严重的经济损失[2]。由意大利青霉引起的青霉病柑橘占果实腐烂柑橘的30%~50%[3]。目前在生产实践中,主要采用咪鲜胺、抑霉唑等化学杀菌剂进行防治,虽有良好的防治作用,但对人体和环境存在安全隐患[4]。因此,寻找安全有效的方法替代或减少合成杀菌剂的使用至关重要[5]。
一些无机盐或有机盐如碳酸盐、山梨酸盐、硅酸盐、苯甲酸盐等,通常被认为是安全(Generally Recognized As Safe,GRAS)的药剂,由于其可接受性、低成本和高溶解度而在商业用途中有显著优势[4]。目前研究表明,碳酸盐中的碳酸钠和碳酸钾,可以显著抑制果实采后病原菌如意大利青霉()、炭疽菌()、指状青霉()和葡萄座腔菌()的菌丝生长和孢子萌发[6-8]。活体试验研究结果显示碳酸钠、碳酸钾、碳酸氢钾等盐类,可有效控制柠檬、橙子、葡萄等果实采后真菌侵染,降低果实的发病率[8-11]。碳酸铵是一种常见的无机盐,化学式为(NH4)2CO2,具有强烈的氨臭味,易溶于水,且水溶液呈碱性。有研究发现,碳酸铵具有较强的抗真菌能力,能显著降低夏橙由酸腐菌()引起的腐烂,主要是通过抑制酸腐菌菌丝呼吸,改变膜通透性,加剧核酸和蛋白的丢失来发挥其抗真菌活性[12]。碳酸铵与可食用涂膜如羟丙基甲基纤维素、蜂蜡等复配使用,有一定的防治果实采后病原菌侵染的效果,如可有效抑制樱桃番茄接种灰葡萄孢菌()后灰霉病的侵染,延长果实贮藏期[13];可降低柑橘接种焦腐病菌()的发病率,且能保持果实品质[14];显著抑制李子褐腐病菌()的菌丝生长,降低李子采后褐腐病发生率[15]。
课题组前期研究发现,碳酸铵能抑制柑橘意大利青霉活性[16],但对意大利青霉的作用机制及对不同柑橘种类果实品质的影响尚不明确。因此,本研究主要分析碳酸铵对柑橘意大利青霉抑制的可能作用机制,并评价了碳酸铵对脐橙、皇帝柑、沃柑采后腐烂和贮藏品质的影响,为碳酸铵作为有机、安全有效的柑橘防腐保鲜剂应用提供理论依据。
1 材料与方法
1.1 材料与主要试剂
意大利青霉从具有典型青霉病症状的柑橘上分离而来,并接种果实,由形态学和分子手段鉴定为意大利青霉。
用无菌接种环刮取在马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基中培养3 d的意大利青霉孢子,并将其悬浮于含有0.05%(体积分数)Tween 80的蒸馏水中。脐橙、皇帝柑、沃柑均购自华中农业大学当地市场,挑选大小相似、无机械损伤的果实,在26 ℃、相对湿度为90%~95%下贮存。碳酸铵、蔗糖、Tween等试剂均购自国药集团化学制剂有限公司。
1.2 仪器与设备
显微镜(宁波舜宇仪器有限公司,EX20Thermo Fisher);UV-1000紫外分光光度计(上海美普达仪器有限公司,UV-1000);扫描电镜(日本NTC仪器公司,JSM-6390LV);透射电镜(日本HITACHI公司,H-7650);超声波细胞粉碎机(宁波新芝生物科技股份有限公司,SCIENTZ-ⅡD)。
1.3 试验方法
1.3.1 意大利青霉孢子萌发的测定
参考熊琪等[17]的方法,分别将0.025、0.050、0.100、0.200、0.400 g/L的碳酸铵溶液与PDA培养基混匀,然后将培养基均匀涂于载玻片上,培养基凝固后,在载玻片两端滴加10L孢子悬浮液(5×106个/mL),置于灭菌培养皿中并封口后,在26 ℃生化培养箱内恒温培养,8 h后在光学显微镜下观察萌发情况,使用照相机软件(TS-View 6.2.3.2)统计孢子萌发率。按照公式(1)计算萌发率。
1.3.2 意大利青霉菌丝生长量的测定
参考Yang等[18]方法,用涂布棒将200L 意大利青霉孢子悬浮液(1×106个/mL)均匀涂布于PDA培养基上,于26℃培养箱中培养24 h。打孔器(7 mm)取菌饼并将其反贴于含不同浓度碳酸铵的PDA培养基上,于26 ℃条件下培养,每24 h采用十字交叉法测定菌落直径。
1.3.3 菌丝形态和超微结构的观察
在培养24 h菌丝的培养基中,加入碳酸铵溶液使其终浓度为0.8 g/L,对照组加等量无菌水,继续培养24 h,收集菌丝,在光学显微镜下观察。扫描电镜观察参考Yang[18]等的方法,菌丝用2.5%(体积分数)戊二醛固定48 h,磷酸盐缓冲液(Phosphate Buffered Saline,PBS,pH值7.2)洗涤3次,随后将盖玻片在梯度乙醇(30%、50%、70%、95%和100%,体积分数)中脱水20 min,并在液态CO2中干燥至临界点。离子溅射仪镀膜,然后在扫描电镜下观察样品。对于透射电镜,菌丝在3%戊二醛溶液中固定过夜,用0.1 mol/L PBS清洗3次,在2%锇酸中固定,脱水,并包埋在SPI-812环氧树脂中。用Leica UC6超薄切片后,用乙酸铀酰和柠檬酸铅染色,在透射电镜下观察切片。
1.3.4 线粒体ATPase活性测定
培养2 d的菌丝用0.4、0.8、1.6 g/L碳酸铵(该浓度分别为碳酸铵对意大利青霉的0.5、1、2倍的最小抑菌值(Minimal Inhibitory Concentration,MIC))处理不同时间,无菌水做对照。参考Li等[19]方法提取线粒体,用超声波细胞粉碎机破碎线粒体,用购买自南京建成生物科技公司的ATP酶活力测试盒检测Na+/K+-ATPase、Ca2+-ATPase和Mg2+-ATPase活力。
1.3.5 菌丝H2O2含量的测定
参考Sagisaka[20]的方法,称取1 g菌丝于玻璃匀浆器中,并加入4 mL PBS(pH值 7.5)于冰浴中进行研磨,然后加入2.8 mL 5%(体积分数)的三氯乙酸,混匀后于10 000 r/min离心10 min。取1.6 mL上清液于试管中,加入0.2 mL的硫氰酸钾(2.5 mol/L)、0.4 mL的硫酸亚铁铵(10 mmol/L)、0.4 mL 50%(体积分数)的三氯乙酸,混匀,于480 nm 波长下测定吸光度。
1.3.6 H2O2清除剂对病原菌保护作用的评价
参考张美红等[21]方法,并作适当修改。将碳酸铵溶液加入到灭菌PDA培养基中,使其终质量浓度为0.2 g/L,并在培养基加入半胱氨酸,使其终浓度分别为0、5、10、20 mmol/L,将PDA培养基平铺在载玻片上,置于培养皿中,培养基凝固后,在两端各滴加10L孢子悬浮液(5×106个/mL),用封口胶密封后置于26 ℃培养箱中,培养10 h时用显微镜观察孢子萌发。
1.3.7 还原型谷胱甘肽含量的测定
培养2 d的菌丝体过滤后称取0.5 g左右加入10 mL 的生理盐水,用组织匀浆器研磨均匀。在4 ℃、4 000×下离心 10 min,取上清,用购买自南京建成生物科技公司的谷胱甘肽试剂盒进行测定。
1.3.8 抗氧化酶活性的测定
酶活测定参考包斯琴等[22]的方法,并稍作修改。取1 g培养24 h的菌丝加入3 mL的PBS(0.05 mol/L,pH值7.2)在冰浴中研磨,于10 000 r/min、4 ℃离心20 min,上清即为提取的粗酶液。过氧化氢酶(Catalase,CAT)活性采用H2O2分解法测定;超氧化物歧化酶(Superoxide Dismutase,SOD)活性测定采用核黄素-NBT法;过氧化物酶(Peroxidase,POD)活性测定采用愈创木酚法,酶活单位均用U/mg表示。
1.3.9 碳酸铵对接种病菌果实腐烂的影响
参考Ji等[23]方法,略有修改。将柑橘果实在0.2%(体积分数)次氯酸钠溶液中浸泡2 min,用蒸馏水清洗两次,自然晾干后,在果实赤道部位造伤伤口,分别接种20L质量浓度为4、8、16 g/L的碳酸铵溶液(碳酸铵浓度根据活体试验的预试验结果确定),无菌水为对照。在室温下自然晾干后,在造伤处继续接种20L 1×106个/mL孢子悬浮液,将果实密封于保鲜盒中,置于26 ℃培养箱中,每日观察病斑变化并测定病斑直径。
1.3.10 柑橘果实贮藏品质的测定
将大小均匀的健康果实用蒸馏水清洗干净后,再将果实分别在质量浓度为4、8、16 g/L的碳酸铵溶液中浸泡处理10 min,蒸馏水作对照。自然晾干后,将柑橘储存于保鲜袋中,并置于26 ℃培养箱中,定期取样,分析失重率、腐烂率和品质指标。
果实的失重率采用称重法测定,腐烂率采用统计方法分析,色泽采用3nh分光测色计测定果实色泽变化;采用WYT-J手持糖度计测定柑橘果汁中可溶性固形物含量;2,6-二氯酚靛酚法测定柑橘维生素C含量;可滴定酸含量的测定参考Vilaplana等[24]所用的酸碱滴定法。
1.4 数据处理与分析
所有试验进行3次平行,3次重复。数据用Excel绘图并用SPSS18.0软件进行单因素方差分析。
2 结果与分析
2.1 碳酸铵对孢子萌发及菌丝生长的影响
碳酸铵处理对意大利青霉孢子萌发有显著影响,如图1a所示,随着处理浓度的增加,孢子萌发率降低,质量浓度为0.200 g/L时,抑制效果显著(<0.05),孢子萌发率为36.6%,而在0.400 g/L时,未见孢子萌发。碳酸铵对意大利青霉的菌丝生长速率的影响如图1b所示,随着碳酸铵浓度的增加,意大利青霉生长速率逐渐降低,菌落直径逐渐减小,碳酸铵质量浓度达到0.8 g/L时,在培养5 d内,未观察到意大利青霉菌丝的生长。
2.2 碳酸铵对菌丝形态和超微结构的影响
碳酸铵对意大利青霉菌丝形态的影响如图2所示,在光学显微镜下观察到,对照组的菌丝生长繁盛,分支较多,碳酸铵处理后,菌丝生长节点较少,几乎无分支;进一步通过扫描电镜观察发现,未处理的菌丝表面光滑且大小均匀,而处理后的菌丝干瘪弯曲且有明显的褶皱。这说明碳酸铵处理导致意大利青霉菌丝形态被破坏。通过透射电镜观察菌丝的超微结构发现,碳酸铵对菌丝线粒体影响较明显,对照组菌丝内部线粒体结构完整,且分布均匀,有膨大的嵴,排列整齐,而0.8 g/L碳酸铵导致线粒体严重变形,外膜断裂,线粒体基质透明化且有部分线粒体已经溶解,这表明碳酸铵处理严重破坏了意大利青霉线粒体的结构。
2.3 碳酸铵对线粒体ATPase活性的影响
碳酸铵处理后,3种ATP酶活性变化如图3所示,在处理12 h内,0.4 g/L碳酸铵处理组的Na+/K+-ATPase、Mg2+-ATPase活力都有上升趋势,而Ca2+-ATPase活性整体呈现下降趋势,处理12 h后,3种ATP酶活都显著降低(<0.05),并表现出浓度剂量效应,1.6 g/L碳酸铵处理组3种ATP酶活分别下降至0.073、0.109和0.146 U/mg。这表明碳酸铵处理破坏了线粒体ATPase活性,从而引起线粒体能量代谢障碍。
2.4 碳酸铵对H2O2含量的影响
H2O2被认为是活性氧(Reactive Oxygen Species,ROS)的主要化合物之一,主要在线粒体中产生。碳酸铵对意大利青霉H2O2的影响如图4所示,碳酸铵处理组的H2O2含量明显高于对照组,在处理6 h时,0.8 g/L碳酸铵处理组的H2O2含量为对照的1.85倍。结果表明,碳酸铵处理导致H2O2积累,进一步可能会导致线粒体损伤。
2.5 碳酸铵对还原型谷胱甘肽含量和谷胱甘肽还原酶活力的影响
碳酸铵处理对细胞中还原型谷胱甘肽(Reduced Glutathione,GSH)含量的影响如图5a所示,随着处理时间的增加,GSH水平显著下降(<0.05),且呈浓度依赖性,在处理6 h时,碳酸铵处理组GSH含量分别下降至1.087、0.472、0.425 mg/g,与对照组8.370 mg/g相比,均显著降低(<0.05),这意味着谷胱甘肽已不能及时清除机体内过量的活性氧。碳酸铵处理降低了谷胱甘肽还原酶(Glutathione Reductase,GR)活性。如图5b所示,碳酸铵处理6 h时,对照组和1.6 g/L碳酸铵处理组的GR活力分别为558.86、65.14 U/g,这表明碳酸铵处理导致GR活力降低,GR无法正常催化GSSG还原成GSH,从而导致机体中的活性氧无法及时清除。
2.6 碳酸铵对抗氧化酶活性的影响
碳酸铵对菌丝抗氧化酶的影响如图6所示,随着碳酸铵浓度的增加,CAT酶活出现上升趋势,而POD和SOD酶活则有相反的结果,随着碳酸铵浓度的增加,POD和SOD酶活逐渐减小。在处理3 h内,0.8和1.6 g/L的碳酸铵处理组的POD酶活分别降低到0.22和0.19 U/mg。结果表明碳酸铵破坏了意大利青霉抗氧化酶系的平衡,机体内活性氧无法及时清除。
2.7 H2O2清除剂对孢子萌发的保护作用
半胱氨酸是有效的H2O2清除剂,对孢子萌发的保护作用如图7所示,仅添加碳酸铵的孢子萌发率为24.58%,添加一定浓度的半胱氨酸后,孢子萌发率有所提高,培养基添加5 mmol/L半胱氨酸后,孢子的萌发率为31.85%,再次印证碳酸铵至少部分通过导致病原菌活性氧积累来发挥抗真菌活性。
2.8 碳酸铵对接种病菌果实腐烂程度的影响
柑橘接种意大利青霉5 d后,果实腐烂的变化如图8所示,经过碳酸铵浸泡处理后的脐橙、皇帝柑及沃柑的病斑直径均小于对照组,在16 g/L的碳酸铵处理下,脐橙、皇帝柑、脐橙的病斑直径分别为对照组的49.2%、48.1%、62.7%,这表明柑橘果实经过碳酸浸泡处理后,可以显著抑制意大利青霉病菌在柑橘果实上的扩散(<0.05)。
2.9 碳酸铵处理对柑橘自然腐烂率的影响
碳酸铵处理对柑橘果实自然腐烂的影响如图9所示,与对照相比,碳酸铵处理有效降低了3种柑橘的腐烂率。贮藏30 d后,16 g/L的碳酸铵处理下,脐橙、皇帝柑及沃柑的果实腐烂率与对照相比,分别降低了48.02%、29.78%、29.17%。试验表明碳酸铵可有效降低柑橘果实腐烂率,特别是16 g/L的碳酸铵作用效果较好。
2.10 碳酸铵对柑橘贮藏品质的影响
碳酸铵对3种柑橘品质的影响如表1所示,贮藏30 d后,3种品类的柑橘果实质量较贮藏前均有所降低,碳酸铵处理后,脐橙失重率低于对照组,且呈现剂量依赖效应;而对沃柑有相反的趋势,碳酸铵处理导致沃柑失重率增加;4 g/L碳酸铵使皇帝柑失重率增加,16 g/L碳酸铵处理减小了其失重率。贮藏结束后,对照组与处理组的柑橘果实可溶性固形物含量无明显变化。柑橘的维生素C含量较贮藏前有所降低,碳酸铵处理组的沃柑和脐橙的维生素C含量较对照组略高,且8 g/L处理组的维生素C含量相对较高,而处理组的皇帝柑的维生素C含量较对照组略低,说明适当浓度的碳酸铵处理可以抑制沃柑、脐橙果实维生素C的降解,且对沃柑的作用效果较好。碳酸铵处理的沃柑可滴定酸含量略低于对照组,而对于脐橙、皇帝柑,碳酸铵处理使其可滴定酸含量略有增加。16 g/L碳酸铵处理使脐橙和皇帝柑的还原糖含量略有降低,而沃柑还原糖含量略有增加。贮藏30 d后,处理组的3种柑橘的*、*、*值与对照组相比,变化较小,这表明碳酸铵处理对柑橘色泽无不利影响。
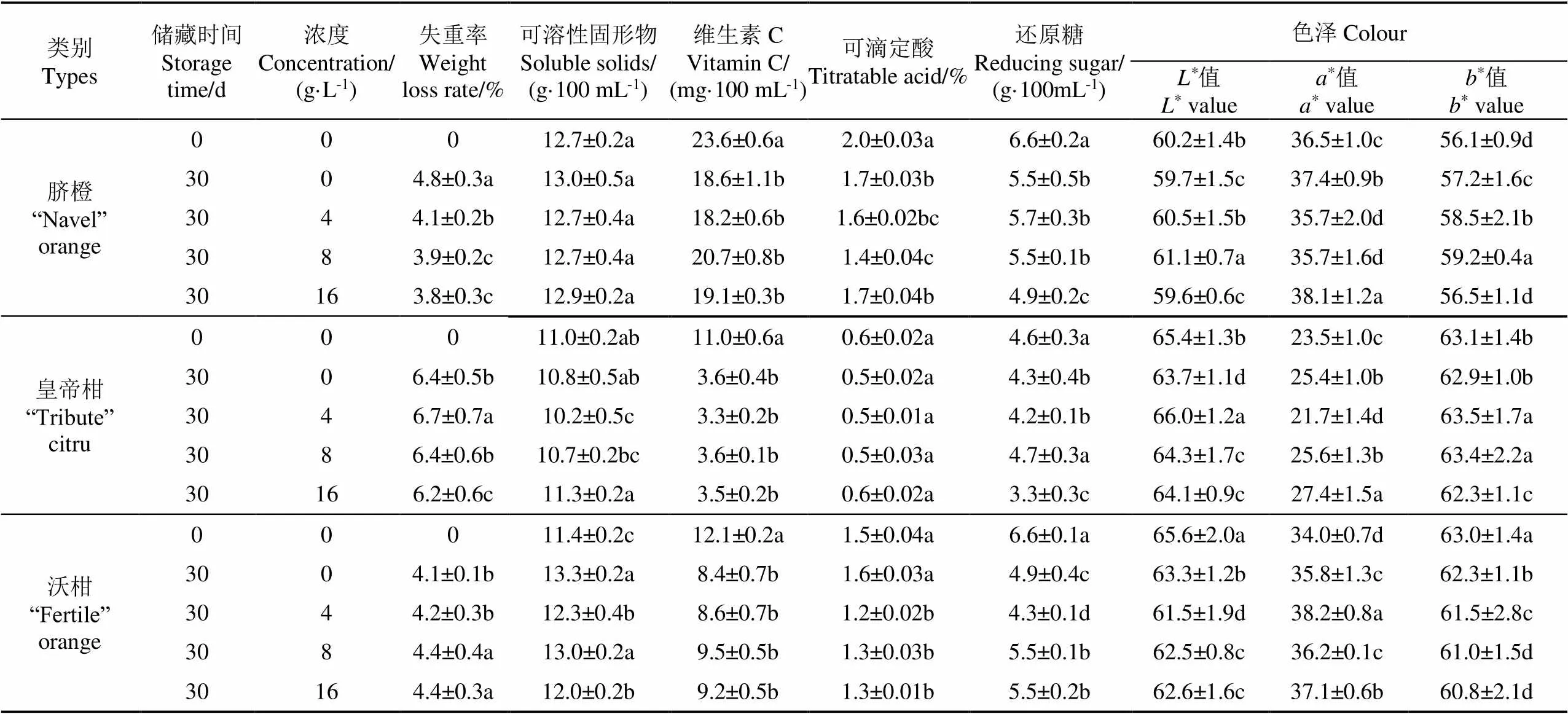
表1 碳酸铵处理对脐橙、皇帝柑、沃柑果实贮藏30 d后理化指标的影响
注:同种柑橘品质同列间相互比较,具有不同标记字母的为差异性显著(<0.05)。
Note: Citrus quality attributors are compared with each other within the same column and those with different labeled letters are considered significant (<0.05).
3 讨 论
全世界对合成杀菌剂相关健康风险认识的不断提高,促使研究人员探索新的、更安全的天然抗菌剂和食品保鲜剂产品[25]。在本项研究中,碳酸铵作为通常认为安全的药剂,可以有效抑制体外和柑橘上意大利青霉的生长(<0.05),降低柑橘在贮藏期间的腐烂率(<0.05),并且对柑橘品质无不良影响,储藏结束后,几乎闻不到氨臭味。结果表明碳酸铵是一种安全有效的柑橘采后病害的控制方法。
目前多数研究表明,盐类可以抑制病原菌的分生孢子萌发、芽管伸长[7-9]。在本研究中发现,0.4 g/L碳酸铵可以完全抑制意大利青霉的孢子萌发(图1),通过光学显微镜和扫描电镜观察发现,碳酸铵处理导致菌丝生长异常,出现褶皱,塌陷且不规则分支(图2),与NO熏蒸对意大利青霉菌丝形态的影响一致[26],这些结果均表明意大利青霉在抗真菌药物的作用下,菌丝形态可能会受到破坏。
线粒体作为细胞进行呼吸的主要细胞器,其结构的完整性与生物的生命活动密切相关。Li等[19]研究发现茶树油通过影响灰葡萄孢菌的线粒体来抑制病原菌的生长,最直观的表现为线粒体的结构被破坏,导致外膜破裂,空泡化及囊泡出现。在本研究中有类似的结果,通过透射电镜观察发现碳酸铵导致意大利青霉菌丝线粒体结构异常,外膜断裂,这表明意大利青霉线粒体可能是碳酸铵作用的重要靶点,碳酸铵处理导致线粒体结构破坏,进一步可能影响线粒体功能(图2)。ATPase是大多数生物膜中普遍存在的质子泵,在能量代谢中起重要作用,可以维持细胞内外渗透压,为物质的运输和能量的转换提供驱动力,还能平衡pH值,维持膜电位[27]。Ju等[28]研究发现在柠檬醛的处理下,娄地青霉()的Na+/K+-ATPase、Mg2+-ATPase、Ca2+-ATPase活性均显著下降,进一步导致能量代谢水平降低,表明柠檬醛可以通过破坏娄底青霉的ATPase活性发挥其抗真菌活性。在本研究中发现,1.6 g/L碳酸铵处理导致意大利青霉线粒体的3种ATPase活性显著降低(<0.05)(图3),这表示线粒体正常功能被破坏,也将会引起能量代谢失调。
活性氧(Reactive Oxygen Species,ROS)积累会导致脂质,蛋白质,碳水化合物以及核酸的损伤[29],线粒体是ROS的主要来源,因此线粒体易受到ROS的攻击而发生氧化损伤,进而导致线粒体结构功能失调。本试验结果显示,碳酸铵导致意大利青霉H2O2含量的增加(图4),H2O2是ROS的主要类型,表明碳酸铵处理引起意大利青霉菌丝活性氧累积,而导致线粒体氧化损伤,与硼酸处理导致芒果炭疽菌()孢子中ROS积累而导致线粒体功能障碍的结果一致[30]。半胱氨酸是有效的活性氧清除剂,笔者研究发现,添加5 mmol/L半胱氨酸时,可以明显提高碳酸铵处理的意大利青霉菌孢子萌发率(图7),再次印证了碳酸铵通过导致菌丝活性氧积累发挥抗真菌活性。
抗氧化酶及还原型谷胱甘肽(GSH)是细胞内是重要的抗氧化剂和自由基清除剂,谷胱甘肽还原酶(GR)可以催化氧化型谷胱甘肽(GSSG)还原成GSH。Park[31]研究发现外源性H2O2处理肺癌细胞,可以导致细胞内ROS积累,CAT活性提高,SOD活性降低,且造成GSH含量的下降,表明通过促进细胞ROS积累,导致抗氧化酶系统失衡是H2O2抑制细胞生长的重要途径。在本研究中有类似的结果,碳酸铵处理降低了菌丝内GSH含量及GR活力(图5),同时CAT活性提高,SOD、POD活性降低(图6),这表明细胞中抗氧化系统平衡被打破,无法清除过量的ROS 而出现不可逆的反应,最终也会导致线粒体功能丧失。
在活体试验中,碳酸铵处理可以降低脐橙、皇帝柑、沃柑上接种病原菌的扩散,皇帝柑经16 g/L碳酸铵的处理后,接种孢子悬浮液5 d后的果实病斑直径仅为对照的48.1%(图8)。Zhang等[32]研究发现,梨经过1.22 mmol/L 的2-苯乙基异硫氰酸酯处理后,接种链格孢菌()7 d后的病斑直径仅为对照的39%,与本试验结果相似。保鲜剂的保鲜效果还要考虑果蔬的生理生化指标变化。Fagundes等[13]发现丙酸钠、硼酸钾、磷酸铵和碳酸铵等盐类涂膜的使用不会对樱桃番茄果实的呼吸速率、硬度、颜色、感官风味和外观产生不利影响,在本研究中同样发现,碳酸铵处理可以有效降低3种柑橘在贮藏期间的腐烂率(图9),且对3种柑橘的营养成分无不利影响(表1)。
4 结 论
1)通过孢子萌发试验和菌饼生长试验,证实0.4 g/L碳酸铵处理可以完全抑制孢子萌发,0.8 g/L碳酸铵可以完全抑制菌丝生长。
2)碳酸铵处理会破坏意大利青霉菌丝的正常形态及线粒体结构,降低线粒体ATPase活性,造成H2O2积累,还原型谷胱甘肽(Reduced Glutathione,GSH)含量及谷胱甘肽还原酶(Glutathione Reductase,GR)活性降低,抗氧化系统平衡被破坏。
3)16 g/L的碳酸铵处理可以显著降低柑橘的自然腐烂率,贮藏30 d后,脐橙、皇帝柑、沃柑的自然腐烂率与对照相比分别降低了48.02%、29.78%、29.17%;碳酸铵处理明显降低3种柑橘品种接种意大利青霉后的腐烂程度,并对其营养品质无不良影响。
研究结果表明,碳酸铵对柑橘采后致病菌意大利青霉有强烈的抑制作用,且碳酸铵处理对柑橘品质无不良影响,因此,碳酸铵处理有望进一步开发为绿色、安全、有效的防治柑橘采后腐烂的技术方法。
[1] Costa J H, Bazio J M, Pontes J G D.infection mechanisms in citrus: What do we know so far[J]. Fungal Biology, 2019, 123(8): 584-593.
[2] 邓利珍,刘可,冷飞凡,等. 川芎提取液对脐橙的防腐保鲜效果[J]. 农业工程学报,2016,32(7):296-302.
Deng Lizhen, Liu Ke, Leng Feifan, et al. Effect of Ligusticum chuanxiong hort extract for antisepsis and preservation of navel orange[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(7): 296-302. (in Chinese with English abstract)
[3] Chen C Y, Qi W W, Peng X, et al. Inhibitory effect of 7-Demethoxytylophorine onand its possible mechanism[J]. Microorganisms, 2019, 7(2): 1-11.
[4] Palou L. Postharvest treatments with GRAS salts to control fresh fruit decay[J]. Horticulturae, 2018, 4(4): 1-15.
[5] Martinez-Blay V, Taberner V, Pereaz-Gago M B, et al. Control of major citrus postharvest diseases by sulfur-containing food additives[J]. International Journal of Food Microbiology, 2020, 330: 1-11.
[6] 崔建潮,贾晓辉,孙平平,等. 采后碳酸氢钠和碳酸钠处理对南果梨轮纹病的控制及贮藏品质的影响[J]. 保鲜与加工,2019,19(4):16-23.
Cui Jianchao, Jia Xiaohui, Sun Pingping, et al. Effect of sodium bicarbonate and carbonate treatment on postharvest ring rot and storage quality of ‘Nanguo’ pear fruit[J]. Storage and Process, 2019, 19(4): 16-23. (in Chinese with English abstract)
[7] Jitareerat P, Sripong K, Masaya K, et al. Combined effects of food additives and heat treatment on fruit rot disease and quality of harvested dragon fruit[J]. Agriculture and Natural Resources, 2018, 52(6): 543-549.
[8] Youssef K, Hussien A. Electrolysed water and salt solutions can reduce green and blue molds while maintain the quality properties of 'Valencia' late oranges[J]. Postharvest Biology and Technology, 2020, 159: 1-11.
[9] D'aquino S, Continella A, Gentile A, et al. Decay control and quality of individually film-wrapped lemons treated with sodium carbonate[J]. Food Control, 2020, 108: 1-9.
[10] Youssef K, Roberto S R, Oliveira A G D. Ultra-structural alterations in—The causal agent of gray mold—Treated with salt solutions[J]. Biomolecules, 2019, 9(10): 582-598.
[11] Abd Ei-Khalek A F. Effectiveness of gum Arabic, potassium salts and their incorporation in the control of postharvest diseases and maintaining quality of ‘Washington’ Navel oranges during long term cold storage[J]. Egyptian Journal of Horticulture, 2018, 45(2): 185-203.
[12] 刘寒寒,杨书珍,李哲,等. 碳酸铵对柑橘酸腐病菌的抑制效果及作用机制[J]. 食品科学,2021,42(3):204-210.
Liu Hanhan, Yang Shuzhen, Li Zhe, et al. Effect and action mechanism of ammonium carbonate against sour rot in citrus fruit[J]. Food Science, 2021, 42(3): 204-210. (in Chinese with English abstract)
[13] Fagundes C, Palou L, Monteiro A R, et al. Effect of antifungal hydroxypropyl methylcellulose-beeswax edible coatings on gray mold development and quality attributes of cold-stored cherry tomato fruit[J]. Postharvest Biology and Technology, 2014, 92(92): 1-8.
[14] Guimarães J E R, Fuente B D L, Pérez-Gago M B, et al. Antifungal activity of GRAS salts againstin vitro and as ingredients of hydroxypropyl methylcellulose-lipid composite edible coatings to control Diplodia stem-end rot and maintain postharvest quality of citrus fruit[J]. International Journal of Food Microbiology, 2019, 301: 9-18.
[15] Karaca H, Pérez-Gago M B, Taberner V, et al. Evaluating food additives as antifungal agents against Monilinia fructicola in vitro and in hydroxypropyl methylcellulose-lipid composite edible coatings for plums[J]. International Journal of Food Microbiology, 2014, 179: 72-79.
[16] 柳丽梅,张强,杨书珍,等. 碳酸铵和碳酸氢铵对柑橘青霉病的抑制作用[J]. 华中农业大学学报,2014,33(2):65-69.
Liu Limei, Zhang Qiang, Yang Shuzhen, et al. Inhibitory effect of ammonium carbonate and ammonium hydrogen carbonate on blue mold of citrus fruits[J]. Journal of Huazhong Agricultural University, 2014, 33(2): 65-69. (in Chinese with English abstract)
[17] 熊琪,杨书珍,曹正清,等. 毛霉诱导脐橙产抗病物质对指状青霉和酸腐菌的抑制[J]. 农业工程学报,2020,36(9):315-322.
Xiong Qi, Yang Shuzhen, Cao Zhengqing, et al. Inhibition of induced citrus peel disease-resistant components againstand[J]Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(9): 315-322. (in Chinese with English abstract)
[18] Yang S Z, Liu L M, Li D M, et al. Use of active extracts of poplar buds againstand possible modes of action[J]. Food Chemistry, 2016, 196: 610-618.
[19] Li Y H, Shao X F, Xu J Y, et al. Tea tree oil exhibits antifungal activity againstby affecting mitochondria[J]. Food Chemistry, 2017, 234: 62-67.
[20] Sagisaka S. The occurrence of peroxide in a perennial plant, Populus gelrica[J]. Plant Physiology, 1976, 7(2): 308-309.
[21] 张美红,王萌,杨书珍,等. β-蒎烯抑制柑橘意大利青霉作用机制初步研究[J]. 华中农业大学学报,2018,37(6):91-97.
Zhang Meihong, Wang Meng, Yang Shuzhen, et al. Possible action mode of beta-pinene against[J]. Journal of Huazhong Agricultural University, 2018, 37(6): 91-97. (in Chinese with English abstract)
[22] 包斯琴,李静,孙健,等. 盐胁迫下外生菌根菌抗氧化酶活性的变化[J]. 安徽农业科学,2012,40(15):8401-8403.
Bao Siqin, Li Jing, Sun Jian, et al. Changes of anti-oxidative enzymes activity ofunder salt stress[J]. Journal of Anhui Agricultural Science, 2012, 40(15): 8401-8403. (in Chinese with English abstract)
[23] Ji J Y, Yang J, Zhang B W, et al. Sodium pheophorbide a controls cherry tomato gray mold () by destroying fungal cell structure and enhancing disease resistance-related enzyme activities in fruit[J]. Pesticide Biochemistry and Physiology, 2020, 166: 1-8.
[24] Vilaplana R, Pazmiño L, Valencia-Chamorro S. Control of anthracnose, caused by, on postharvest organic banana by thyme oil[J]. Postharvest Biology and Technology, 2018, 138: 56-63.
[25] Youssef K, Hussien A. Electrolysed water and salt solutions can reduce green and blue molds while maintain the quality properties of ‘Valencia’ late oranges[J]. Postharvest Biology and Technology, 2020, 159: 1-11.
[26] Chen C Y, Nie Z P, Wan C P, et al. Preservation of Xinyu tangerines with an edible coating usingvahl. fruits extract-incorporated chitosan[J]. Biomolecules, 2019, 9(2): 46-59.
[27] Fang Z, Xu L, Lin Y, et al. The preservative potential of octopus scraps peptides–zinc chelate against Staphylococcus aureus: its fabrication, antibacterial activity and action mode[J]. Food Control, 2019, 98: 24-33.
[28] Ju J, Xie Y F, Yu H, et al. Major components in Lilac and Litsea cubeba essential oils killthrough mitochondrial apoptosis pathway[J]. Industrial Crops & Products, 2020, 149: 1-9.
[29] Pozniakovsky A I, Knorre D A, Markova O V, et al. Role of mitochondria in the pheromone- and amiodarone-induced programmed death of yeast[J]. Journal of Cell Biology, 2005, 168: 257-269.
[30] Shi X Q, Li B Q, Qin G Z, et al. Mechanism of antifungal action of borate againstrelated to mitochondrial degradation in spores[J]. Postharvest Biology and Technology, 2012, 67: 138-143.
[31] Park W H. Antiapoptotic effects of caspase inhibitors on H2O2-treated lung cancer cells concerning oxidative stress and GSH[J]. Molecular and Cellular Biochemistry, 2018, 441: 125-134.
[32] Zhang M, Li Y C, Bi Y, et al. 2-Phenylethyl isothiocyanate exerts antifungal activity againstby affecting membrane integrity and mycotoxin production[J]. Toxins, 2020, 12(2): 124-136.
Mechanism of ammonium carbonate onand its effect on the quality of different citrus fruits
Xu Jinjuan, Yang Shuzhen※, Zhang Meihong, Li Xiaoying, Peng Litao※
(430070,)
Citrus is susceptible to infection by a variety of fungi during storage and transportation, leading to severe economic loss.is one of two major postharvest diseases of citrus fruits, causing blue mold. It is crucial to seek a safe and effective way to replace or reduce the use of synthetic fungicides for health and environmental concerns. Since the ammonium carbonate can be expected to inhibitactivity in recent years, it still remains unknown on the specific mechanism and the effect on the fruit quality of different citrus species. Taking the “Navel” orange, “Tribute” citrus, and “Fertile” orange as the research objects, this study aims to investigate the antifungal activity of ammonium carbonate againstcausing blue mold in fruits via interfering reactive oxygen metabolism. A possible mechanism of ammonium carbonate was also clarified to evaluate the storage qualities under the safe and limited growth ofafter treatment. Scanning and Transmission Electron Microscope (SEM/TEM) were utilized to characterize the mycelial morphology and mitochondrial structure. The mitochondrial ATPase activities and H2O2content were also measured to determine the inhibition of substances against the pathogens. Furthermore, the activity of antioxidant enzymes and the content of reduced glutathione were measured to further clarify the effect of ammonium carbonate on the accumulation of Reactive Oxygen Species (ROS). In addition, an in-vivo experiment was carried out to explore the effects of ammonium carbonate on the storage quality, such as soluble solids, vitamin C, titratable acid, reducing sugar, and color of citrus. The results showed that ammonium carbonate greatly inhibited the spore germination and mycelial growth ofin a dose-dependent manner. Specifically, ammonium carbonate at 0.4 and 0.8 g/L completely inhibited the spore germination and mycelial growth, respectively. The morphology observation showed that ammonium carbonate caused the growth of mycelia with sparse nodes and fewer branches. Ultrastructural observation showed that the hypha was seriously shrunk to the abnormal structure of mitochondria. Physiological and biochemical analysis indicated that ammonium carbonate treatment caused the decrease of Na+/K+-ATPase, Ca2+-ATPase, and Mg2+-ATPase activities in the mitochondria of hypha, further resulted in the loss of reduced glutathione content and glutathione reductase activity, concurrently interrupted the balance of Superoxide Dismutase (SOD), Catalase (CAT) and Peroxidase (POD) activities in the scavenging system of ROS, and finally to promote the H2O2accumulation in hypha of. Nevertheless, the addition of Cysteine (Cys), a scavenger of ROS, partially restored the spore germination that inhibited by ammonium carbonate. In vivo test, 16 g/L ammonium carbonate treatment significantly reduced the lesion diameter of citrus fruits inoculated with(<0.05), and then alleviated the disease severity in “Novel” orange, “Tribute” citrus, and “Fertile” orange. Correspondingly, the ammonium carbonate treatment can be expected to reduce the natural disease incidence without adverse effects on fruit weight loss, color, and quality parameters, including soluble solids, titratable acid, vitamin C, and reducing sugar contents. These results demonstrated that ammonium carbonate can be used to damage the mitochondrial structure and function of, thereby promoting the accumulation of ROS for the antifungal activity. The powerful antifungal activity of ammonium carbonate againstcan offer great potential application in control of postharvest decay of citrus fruits.
storage; quality control;; mitochondrion; ammonium carbonate; Reactive Oxygen Species (ROS); action mechanism; citrus
许金娟,杨书珍,张美红,等. 碳酸铵对意大利青霉的作用机制及对不同柑橘果实品质的影响[J]. 农业工程学报,2021,37(15):299-307.doi:10.11975/j.issn.1002-6819.2021.15.035 http://www.tcsae.org
Xu Jinjuan, Yang Shuzhen, Zhang Meihong, et al. Mechanism of ammonium carbonate onand its effect on the quality of different citrus fruits[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(15): 299-307. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.15.035 http://www.tcsae.org
2021-06-04
2021-08-01
国家自然科学基金项目(31871850)
许金娟,研究方向为果蔬贮藏与保鲜。Email:2498780612@qq.com
彭丽桃,博士,教授,博士生导师,研究方向为果蔬贮藏保鲜。Email:penglt12@mail.hzau.edu.cn
10.11975/j.issn.1002-6819.2021.15.035
TS255.1
A
1002-6819(2021)-15-0299-09
