耦合浮珠-超声辅助溶剂萃取法用于微藻采收及油脂提取
2021-11-26徐开伟邹小彤张高山杜伟豪马晓静雷梣岑李彦鹏
徐开伟,邹小彤,刘 意,张高山,杜伟豪,马晓静,雷梣岑,李彦鹏,2
·农产品加工工程·
耦合浮珠-超声辅助溶剂萃取法用于微藻采收及油脂提取
徐开伟1,邹小彤1,刘 意1,张高山1,杜伟豪1,马晓静1,雷梣岑1,李彦鹏1,2※
(1. 长安大学水利与环境学院,西安 710054;2.长安大学旱区地下水文与生态效应教育部重点实验室,西安 710054)
为了优化微藻生物柴油生产工艺,开发高效低耗的微藻采收与油脂提取技术,该研究使用优化浮珠浮选工艺对小球藻进行采收,随后选取小球藻-表面层状聚合物浮珠聚集体进行破壁提油处理,并通过响应面优化破壁工艺,建立一种新型耦合浮珠-超声辅助溶剂萃取工艺。结果表明,在超声时间为13 min,正己烷:异丙醇体积比例为4,微藻质量浓度为13.6 g/L,超声功率为254 W时,油脂提取效率较高,为18.91%。相比传统气浮法与超声辅助溶剂萃取法,该法采收效率、细胞破壁效率和饱和脂肪酸含量都达到了较高水平,分别为98.36%、90.19%和37.03%。因此,耦合浮珠-超声辅助溶剂萃取工艺是一种有效提取小球藻细胞中油脂的工艺。研究结果为微藻生物柴油制备工艺的发展提供科学依据。
生物柴油;油脂;提取;微藻;浮珠浮选;超声破碎
0 引 言
中国人口数量大,人均耕地远低于世界平均水平,因此走以农作物为原料生产生物柴油的技术路线,不适合中国国情。开发利用不占耕地的生物柴油资源,对农业与社会的可持续发展意义重大[1]。微藻细胞因具有高含量的脂质、蛋白质和多糖,可用于保健品、动物饲料、医药、生物燃料和化妆品的生产及制作,而拥有广泛的应用前景[2]。然而,微藻采收过程成本占其生物质生产总成本的20%~30%[3],严重制约其大规模工业化应用,所以开发高效与低耗的采收技术,对推动微藻产业的发展意义重大。相比于传统离心、沉淀、絮凝等采收技术,浮选法因具有能耗低、采收快速且高效的优势,被认为是最具前景的采收方法之一[4]。浮珠浮选法作为一种改进的浮选技术,利用低密度的空心浮珠代替微气泡,减少了产生气泡的能量投入。已有研究表明[3],以壳聚糖为预絮凝药剂,质量浓度为0.55 g/L硅硼酸钠浮珠,在pH值为7时,小球藻和二形栅藻的采收率分别为92.47%和83.77%。然而,相比于其他浮选方法,该法的采收效率还有很大的提升空间。而且,微藻-浮珠结合体的后续分离也是需要改进的地方。
采收后,微藻生物质被用于油脂提取,这一步占总成本的30%~40%[5]。通常使用氯仿/甲醇混合溶剂萃取法分离油脂,但提取过程缓慢(一般需要振荡过夜),且因氯仿易燃、高毒,限制了该法的应用。近年来,超声辅助溶剂萃取法(Ultrasound-Assisted Solvent Extraction, UASE)被应用于微藻细胞脂质的提取[6],可缩短提取时间到原有时间的1/10,提高提取效率50~500倍[7]。然而超声辅助技术的加入,势必会引起油脂提取过程中能耗的增加,如何在缩短时间、提高效率的基础上,最大程度减少能耗,也是目前亟需解决的问题。
为此,本研究提出一种新型耦合浮珠-超声辅助溶剂萃取法(Buoyant Beads and Ultrasound Assisted Solvent Extraction, BBUASE)旨在高效快速地从小球藻生物量中提取脂质。研究首先优化浮珠浮选法(Buoyant-Bead Flotation, BBF)以最大程度采收小球藻的生物量;然后对小球藻-浮珠聚集体进行超声预处理,并采用低毒性的正己烷和异丙醇(Hexane and Isopropanol, HIP)混合溶剂进行脂质提取,以期避免采收后浮珠与微藻的额外分离过程,且减少超声过程能耗;最后采用气相色谱/质谱联用技术对提取的脂质成分进行分析,以期为微藻生物量的采收和油脂提取提供依据。
1 材料与方法
1.1 藻种培养
本研究选用淡水小球藻(,FACHB-8,中国科学研究院水生生物研究所淡水藻种库)在装载BG11培养基的光生物反应器(Photobioreactor,上海光宇生物科技有限公司)中进行培养。具体过程参见邹小彤等[8]研究。
1.2 仪器与设备
紫外分光光度计,DU270型,日本岛津公司生产;超声破碎仪,KS-650ZDN型,中国洁力美公司;磁力搅拌器,BX-3F型,常州普天仪器制造有限公司;Zeta电位仪,DelsaTM Nano型,美国贝克曼公司;红外光谱仪,Tensor II型,德国布鲁克公司;离心机,X-15R型,澳洲贝克曼公司。
1.3 浮选材料制备
首先,将低密度空心硅硼酸钠玻璃微珠(直径50~60m,上海名玻新材料科技有限公司)用乙醇脱脂,并用去离子水清洗,25 ℃下干燥。其次,将聚二甲基二烯丙氯化铵(Poly Dimethyl Diallyl Ammonium chloride, PDDA)和阴离子聚丙烯酰胺(Anion Polyacrylamide, APAM)分别分散在去离子水中(5 g/L),并用磁力搅拌器搅拌12 h(300 r/min)。依据Decher的研究[9],表面层状聚合物微球制备步骤如下:1)将浮珠(10 g/L)添加到PDDA大分子溶液中,100 r/min搅拌,并在50 Hz超声水浴中处理1 h,避免分子结构降解[10];2)过滤收集浮珠,25 ℃干燥,100 r/min清洗搅拌1 h;3)将清洗后的浮珠加入APAM溶液中,以100 r/min转速搅拌,并在40 kHz超声水浴中处理1 h;4)重复步骤2。所有步骤重复3次,最后一次重复进行到步骤2,以建立具有阳离子聚合物最外层的表面层状聚合物浮珠(Surface-Layered PolymericMicrospheres, SLPMs)。
1.4 试验方法
1.4.1 藻液预处理
浮选试验前,通过添加生物絮凝剂壳聚糖(Chitosan, CH)/表面活性剂十六烷基三甲基溴化铵(Cetyltrimethylammonium Bromide,C16TAB),改变藻细胞表面电性,使藻细胞结团,有利于后续采收。CH和C16TAB浓度梯度均为10、30、50、70、90和110 mg/L。
1.4.2 浮珠浮选试验
浮选试验在100 mL烧杯中进行,步骤如下:1)向小球藻悬浮液中加入CH(或C16TAB)和硅硼酸钠浮珠(0.55 g/L)[8],250 r/min搅拌30 s,静置15 min;2)直接向藻液中加入SLPMs(0.1、0.3、0.5、0.7、0.9和1.1 g/L),后续同1。试验前后,取液面下2 cm处液体,用紫外分光光度计测量680 nm处吸光度,采收效率(Harvesting Efficiency, HE)用公式(1)计算[3]。
式中0与1分别为浮选前后小球藻的吸光度。
1.4.3 破壁试验
采收后,将小球藻-浮珠聚集体(50 mL)进行超声处理。图1为小球藻生物产品制备流程。超声过程在超声破碎仪中进行。超声探头置于溶液中心,溶液置于冰水浴中,温度控制在25~40℃,试验探究连续超声作用下,不同超声时间(0、6、12、18、24 min)、超声功率(20%×650 W、26%×650 W、32%×650 W、38%×650 W、44%×650 W)处理下小球藻的油脂产量。
此外,试验还研究4种不同方法作用下,小球藻细胞的油脂产量:①调整的Bligh & Dyer法[11]:将22.5 mL溶剂(氯仿∶甲醇=2∶1)添加到 6 mL 小球藻悬浮液中(质量浓度约为10 g/L),震荡5 min。加入15 mL(氯仿∶去离子水=1∶1)氯仿和去离子水混合液,震荡均匀,2 000 r/min离心20 min,将下层油脂-氯仿混合液转移到预先称量好的样品瓶中,60 ℃蒸发至恒量;②调整的UASE-HIP法[12]:将10 mL HIP最优比例混合液添加到30 mL小球藻悬浮液中,超声处理后加10 mL正己烷,室温搅拌1 min,静置,溶液分三层,对上层脂质-正己烷混合液称量(见方法1);③BBUASE-HIP法:将方法②中“小球藻悬浮液”改为“确定浓度小球藻-浮珠混合液”,后续同方法②;④BBUASE-hexane法:将方法③中“HIP溶液”替换为正己烷。破壁前后藻细胞浓度用血球计数板测量。油脂产率和细胞破壁效率用如下公式计算:
式中0为破壁试验所用小球藻干质量,g;1为60 ℃蒸发至恒量后,样品瓶所增加的质量,g。

式中0为破壁试验前藻细胞的浓度,cells·mL-1;1为破壁试验后藻细胞的浓度,cells·mL-1。
1.4.4 响应面设计
本研究用响应面分析软件Design Expert 10.0,建立中心合成设计(Central Composite Design,CCD),研究了超声时间(min)、HIP比例(体积比)、藻液浓度(g/L)和超声功率(W)对脂质产量的影响。根据表1对5个不同水平的变量进行编码,设计30组试验。公式(4)是一个二阶多项式,用来描述4个变量对脂质产率的影响。
式中为油脂产率,%;A,A和A为方程系数;x和x(≠)为自变量编码值。

表1 响应面试验的因素和水平
1.4.5 脂肪酸组成分析
1 mL氯仿/甲醇(或正己烷/异丙醇)混合液加入到烘干的油脂中,使脂质重新悬浮。然后,向油脂中加入0.15 mL甲醇(含有质量分数为10%硫酸),55 ℃震荡3 h后,加入0.5 mL 甲醇(含有质量分数为25%甲醇钾)55 ℃震荡2 h后[13],加入2 mL正己烷55 ℃震荡提取4 h,取正己烷相进行气相色谱-质谱(Gas Chromatography and Mass Spectrometry, GC-MS)分析[14]。
1.5 统计分析
本文试验均进行3次平行测定,结果以平均值±标准差表示。采用Origin 2019分析软件分析。利用ANOVA(SPSS 25)一步法分析试验数据。
2 结果与分析
2.1 浮珠浮选采收
图2为不同SLPMs/药剂浓度作用下小球藻的采收效率。在不添加任何药剂的情况下,硅硼酸钠浮珠对微藻的采收效率最高只能达到54.8%[8];相比于表面活性剂+硅硼酸钠浮珠的方法,SLPMs的采收效率更高(图2a)。对于SLPMs,当浮珠浓度从0增加到0.7 g/L时,采收率达到最大值(98.36%);当浓度超过0.7 mg/L时,采收率有轻微的降低。通过Zeta电位分析,可以看出随着SLPMs/C16TAB浓度的增加,小球藻-浮珠聚集体的Zeta电位整体呈增加趋势。小球藻细胞表面带负电,添加表面活性剂有助于中和微藻表面电性,促进微藻絮体在预絮凝阶段的生成。随着C16TAB浓度的增加,聚集体Zeta电位接近0,此时微藻絮团过大,密度增加,沉淀占主导,不利于小球藻-浮珠聚集体的上浮[3]。当使用CH为预絮凝剂时,微藻悬浮液中几乎没有可见的微絮体。通过Zeta电位分析可以看出,随着CH用量的增加,聚集体Zeta电位略有升高。微藻细胞之间的静电斥力减少,因此在细胞表面的负电荷被阳离子CH聚合物吸附或中和,这一过程为补丁絮凝[15]。因此,SLPMs更有利于小球藻的浮选采收,故本研究使用SLPMs采收的小球藻-SLPMs聚集体进行下一步超声破壁操作。
2.2 油脂产率分析
与Bligh & Dyer法(油脂产量,7.94 %)相比,在BBUASE法作用下,小球藻的油脂产率为4.83%~18.86%,表面BBUASE法可以更好的提取油脂。根据试验结果进行回归分析,得回归方式(公式(5))和方差分析表(表2),其中模型值<0.000 1,2=0.940 2表明试验值拟合模型较好,自变量与响应值之间线性关系显著。经过拟合,预测在超声时间为13 min,HIP比例为4,藻液浓度为13.6 g/L,超声功率为254 W时,油脂产率达最大,为19.33%。通过试验验证,在优化条件下的油脂产率为18.91%±1.57%。
据图3a,脂质产率随着HIP比例的增加,先增大后减少。油脂提取过程中,需要极性有机溶剂(异丙醇)来破坏细胞质中中性脂质和极性脂质之间的氢键。当HIP比例超过4,异丙醇含量过低,不利于氢键的断裂;从图3a和b可以看出,油脂提取效率随超声功率的增加,呈现先增大后减小的趋势。当超声时间过长或功率过大,溶液温度超过警戒值(40 ℃),部分溶剂蒸发,油脂产率降低,这与Ido等[6]的研究结果相符。同时,通过模型方差分析(表2)和等高线图形状可以看出,超声功率和HIP比例之间存在一定的交互作用,对小球藻油脂产率的影响显著[16]。
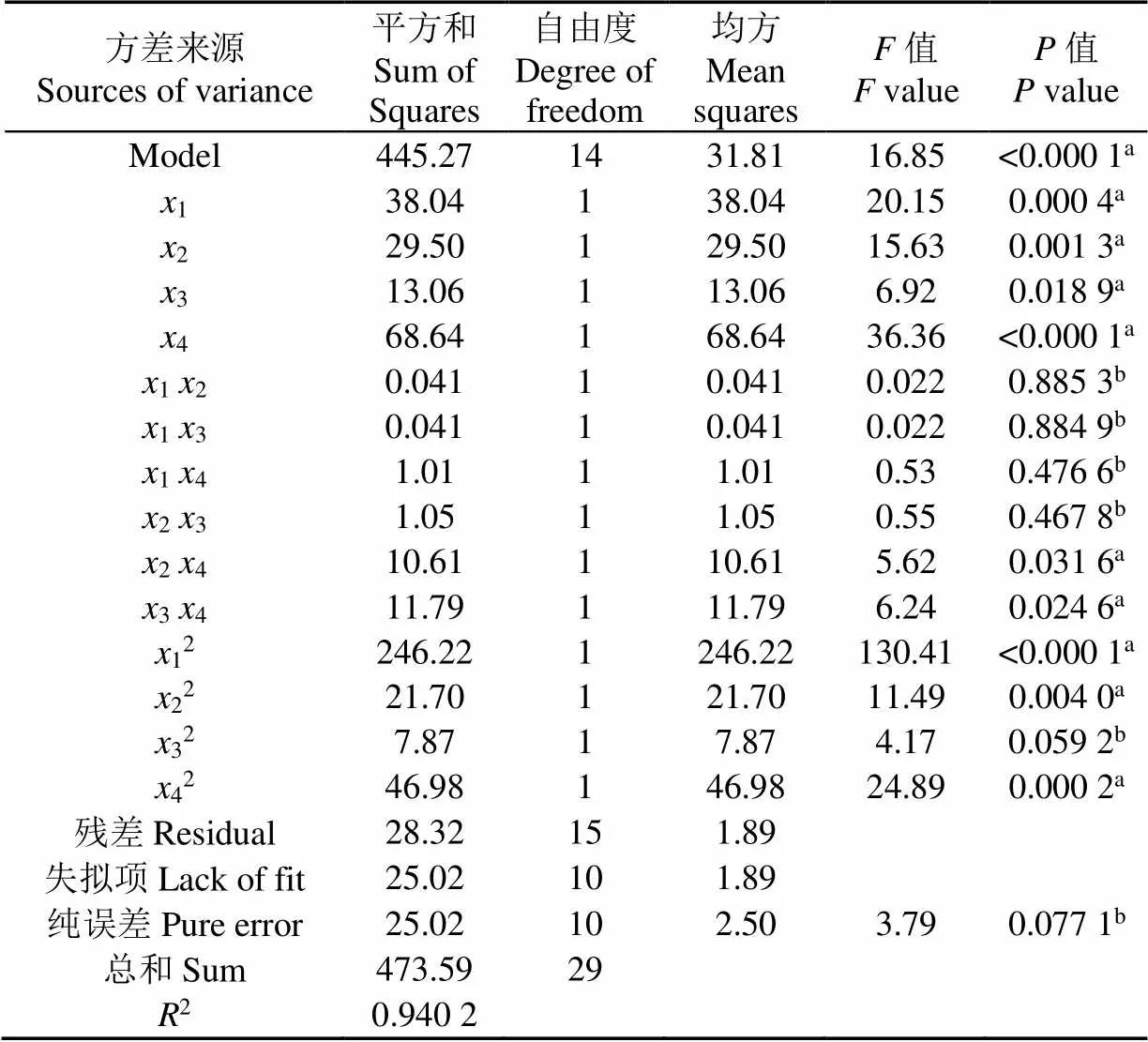
表2 回归模型方差分析
注:a 差异显著(<0.05),b 差异不显著(>0.05)。
Note: a Significant term (<0.05), b Not significant term (>0.05).
从图3b可以看出,在藻液浓度为13.6 g/L时,脂质产率达到最大,且随着藻液浓度的增加,脂质产率降低。因超声过程产生的气泡,在其破碎过程中会产生冲击波,破坏细胞壁,但随着藻液浓度的增加,气泡数量会发生减少,从而破壁效率降低,脂质提取效率也相应降低[17]。同时,通过模型方差分析(表2)和等高线图形状可以看出,超声功率和藻液浓度之间存在一定的交互作用,对小球藻油脂产率的影响显著[16]。
图4为不同超声时间下小球藻的红外光谱图,其中3 277 cm-1归属O-H键的伸缩振动,为水分子(H2O),主要来自于小球藻细胞的自由水[18];2 926 cm-1处为C-H键的振动吸收峰;1 645 cm-1处归属C=O双键的伸缩振动,与藻细胞表面的脂类化合物的存在有关[19];1 530 cm-1处为N-H键和C-N键的堆成伸缩和堆成形变振动,为酰胺II红外特征带,归属为蛋白质[20];1 393 cm-1处为C-H键和C-O键的伸缩振动峰,主要来自藻细胞表面的脂肪、碳水化合物;1 230 cm-1处为C-O-C键的伸缩振动,归为醚类物质;1 025 cm-1处为Si-O键和P-O-P键的伸缩振动峰,来自于藻细胞表面的硅磷酸盐和磷脂类物质[18]。对比原藻,超声处理13和24 min后1 645、1 530和1 393 cm-1处的振动峰值变大。故可以认为,超声会导致原本大量处于胞内的脂质、糖类和蛋白质在细胞表面、红外可探测范围内的增加,故认为超声对微藻细胞结构有一定程度的损害,有利于胞内物质的提取。然而,当超声时间超过优化值(13 min),超声作用变化不明显。
注:藻液浓度为13.6 g·L-1、超声功率为254 W、HIP比例为4。
Note: The microalgal concentration, transducer power and HIP ratio is 13.6 g·L-1, 254 W and 4, respectively.
图4 不同超声时间作用下小球藻细胞的红外光谱分析
Fig.4 FT-IR analysis ofcells under different ultrasonic time
图5为不同破碎方式下小球藻的油脂产率、细胞破壁效率和粒径分布。其中,BBUASE-HIP的油脂产率和细胞破壁效率最高,分别为18.91%和90.19%。UASE-HIP油脂产率次之,为13.39%。通常,超声波的传播可以促进粒子之间的碰撞[21]。在超声波、布朗运动和范德华引力的作用下,小球藻细胞和SLPMs浮珠相互靠近并产生碰撞。由图5可以看出,BBUASE法的细胞破壁效率更高,粒径更小。且BBUASE-hexane的油脂产率为9.56%,是BBUASE-HIP的50.99%,证明混合极性、非极性的溶剂比单一非极性溶剂具有更好的油脂提取效率。
2.3 脂肪酸甲酯组成分析
通过计算分析生物柴油中饱和脂肪酸(Saturated Fatty Acids,SFA)、单不饱和脂肪酸(Monounsaturated Fatty Acids,MFA)和多不饱和脂肪酸(Polyunsaturated Fatty Acids,PUFA)的含量,可以评价生物柴油的质量[22]。表3为不同破碎方式下,小球藻中脂肪酸的组成。可以看出,棕榈酸(c16:0)和亚油酸(c18:2)为脂肪酸甲酯的主要组成。通常来说,不饱和键的存在会对生物柴油的稳定性产生不利影响[23]。对比Bligh & Dyer法,超声辅助法处理后,藻油中PUFA占比降低,SFA占比升高。故该法可能有利于藻油中SFA提取,从而提升了藻油稳定性[23]。此外,不同破碎方式对小球藻中脂肪酸组成特征的参数也被分析(表4)。
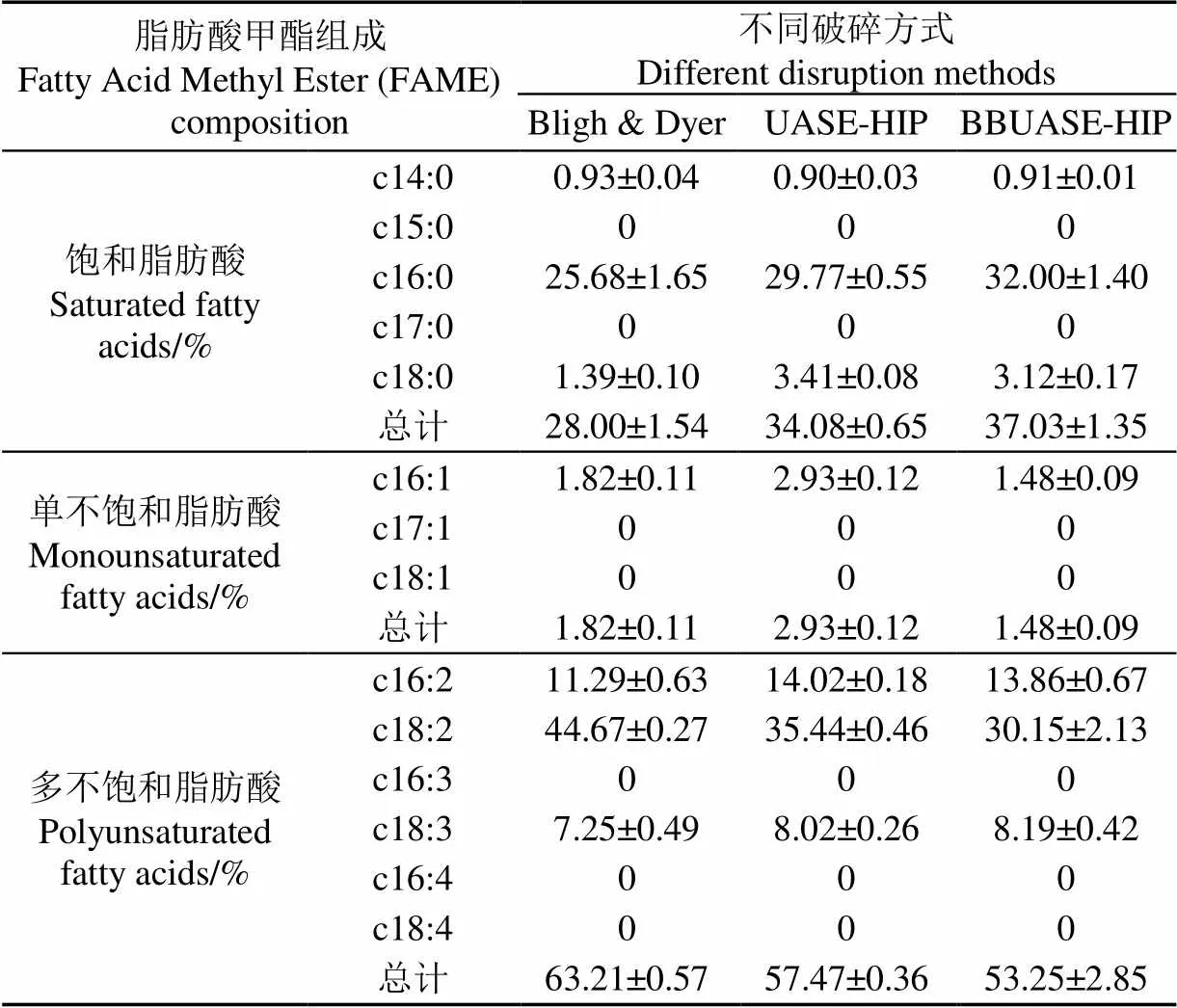
表3 不同破碎方式对小球藻中脂肪酸组成的影响

表4 不同破碎方式对小球藻中脂肪酸组成特征参数分析
其中,生物柴油的不饱和度(Degree of Unsaturation, DU)是指示最终产品十六烷值和碘值的关键参数[24]。Bligh & Dyer法、UASE-HIP法和BBUASE-HIP法的DU值分别为128.23、117.88和107.98,均符合欧盟标准。通过计算这3种方法处理后得到的生物柴油冷滤点(Cold Filter Plugging Point, CFPP),可以看出这3种方法提取的生物柴油,均适用于气温低于0 ℃以下的地区。
2.4 能耗分析
超声处理过程中的单位能量消耗(MJ/kg(以干藻粉计)),很大程度上会影响BBUASE法的应用。Ido等[6]用超声法处理质量体积比为10 g/L的藻粉溶液(400 W,100 mL,89.21 min),消耗能量为210 MJ/kg;Lee等[25]用超声法从sp.、和sp.干藻粉中提取油脂,油脂提取效率均低于10%,能量消耗为360 MJ/kg。然而,藻液干燥过程中需要额外的能量投入,每24 kg微藻生物量含油脂30%~40%(质量分数),可以产生1 000 MJ微藻生物柴油的能量,需要投入3 982 MJ的能量烘干[26]。因此,直接从藻液中提取生物柴油可以节约烘干所需的能量投入。Ellison等[27]使用不同混合溶剂和超声辅助的方式(750 W,232 mL,30 min,7.78 kg/m3),从混合液中提取油脂,经过折算,每处理1 kg干藻粉需要能量投入为581 MJ;而本文中提取油脂的能量消耗为520 MJ/kg。通常,在藻细胞破碎过程中,传统方式(珠磨、微波或高压匀浆法)能耗一般大于400 MJ/kg。此外,溶剂萃取法分离脂质费时且不环保。在本研究中,BBUASE法作用下,小球藻的油脂产率高于传统溶剂萃取法的平均水平[27-29],且所用溶剂低毒性,提取耗时短。因此,可以认为本研究提出的BBUASE法具有商业应用潜力与实践价值。
3 结 论
1)本文提出了一种集小球藻采收、破壁和油脂提取为一体的微藻处理新技术。在新型耦合浮珠-超声辅助溶剂萃取法(Buoyant Beads and Ultrasound Assisted Solvent Extraction, BBUASE)作用下,小球藻的最大油脂产率为18.91%,提取时间为13 min,正己烷和异丙醇(Hexane and Isopropanol, HIP)比例(体积比)为4,藻液浓度为13.6 g/L,超声功率为254 W。
2)相比传统气浮法与超声辅助溶剂萃取法,本法采收效率、细胞破壁效率和饱和脂肪酸含量都达到了较高水平,分别为98.36%、90.19%和37.03%。
作为浮珠浮选法(Buoyant-Bead Flotation, BBF)的后续步骤,耦合浮珠-超声辅助溶剂萃取法(Buoyant Beads and Ultrasound Assisted Solvent Extraction, BBUASE)供了一种高效、环保的技术,促进了超声辅助预处理技术的发展。后续研究可以对比用该法处理不同藻种时的油脂提取效率,并优化该技术,拓宽其的适用范围。
[1] 杨晓琴,喻艳华,谢东,等. 微藻油脂制备生物基多元醇理化性能分析与结构表征[J]. 农业工程学报,2020,36(7):256-263.
Yang Xiaoqin, Yu Yanhua, Xie Dong, et al. Physicochemical property analysis and structural characterization of bio-based polyol prepared form microalgae oil[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(7): 256-263. (in Chinese with English abstract)
[2] Kwok Y J, Sankaran R, Wayne C K, et al. A review manuscript submitted to Chemosphere Advancement of Green Technologies: A comprehensive review on the potential application of microalgae biomass[J]. Chemosphere, 2021, 281: 130886
[3] Zou X, Li Y, Xu K, et al. Microalgae harvesting by buoy-bead flotation process using Bioflocculant as alternative to chemical Flocculant[J]. Algal Research, 2018, 32: 233-240.
[4] Zhang H , Zhang X. Microalgal harvesting using foam flotation: A critical review[J]. Biomass and Bioenergy, 2019, 120: 176-188.
[5] Kumar V, Arora N, Nanda M, et al. Microalgae Biotechnology for Development of Biofuel and Wastewater Treatment[M]. Berlin: Springer, 2019: 265-292.
[6] Ido A L, Luna M D G D, Capareda S C, et al. Application of central composite design in the optimization of lipid yield from Scenedesmus obliquus microalgae by ultrasound-assisted solvent extraction[J]. Energy, 2018, 157: 949-956.
[7] Suali E, Sarbatly R. Conversion of microalgae to biofuel[J]. Renewable and Sustainable Energy Reviews, 2012, 16: 4316-4342.
[8] 邹小彤,徐开伟,文豪,等. 能源微藻无泡采收新方法及其性能[J]. 过程工程学报,2018,18(4):872-878.
Zou Xiaotong, Xu Kaiwei, Wen Hao, et al. Novel method of buoy-bead flotation for harvesting micro-algae and its performance[J]. The Chinese Journal of Process Engineering, 2018, 18(4): 872-878. (in Chinese with English abstract)
[9] Decher G. Fuzzy nanoassemblies: Toward layered polymeric multicomposites[J]. Science, 1997, 277(5330): 1232-1237.
[10] Toh P Y, Ng B W, Ahmad A L, et al. The role of particle-to-cell interactions in dictating nanoparticle aided magnetophoretic separation of microalgal cells[J]. Nanoscale, 2014, 6(21): 12838-12848.
[11] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification[J]. Canad J Biochem Physiol, 1959, 37: 911-917.
[12] Ido A L, Luna M D G d, Capareda S C, et al. Application of central composite design in the optimization of lipid yield from Scenedesmus obliquus microalgae by ultrasound-assisted solvent extraction[J]. Energy, 2018, 157: 949-956.
[13] Yao S, Mettu S, Law S Q K, et al. The effect of high-intensity ultrasound on cell disruption and lipid extra[J]. Algal Research, 2018, 35: 341-348.
[14] Zou X, Xu K, Chang W, et al. A novel microalgal biofilm reactor using walnut shell as substratum for microalgae biofilm cultivation and lipid accumulation[J]. Renewable Energy, 2021, 175: 676-685.
[15] Li S, Hu T, Xu Y, et al. A review on flocculation as an efficient method to harvest energy microalgae: Mechanisms, performances, influencing factors and perspectives[J]. Renewable and Sustainable Energy Reviews, 2020, 131: 110005
[16] 刘皓涵,钟迪颖,张润光,等. 欧李多酚提取纯化及抗氧化性研究[J]. 农业工程学报,2020,36(22):324-332.
Liu Haohan, Zhong Diying, Zhang Runguang, et al. Extraction and purification of polyphenols and determination of antioxidant activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(22): 324-332. (in Chinese with English abstract)
[17] Derakhshan M V, Nasernejad B, Dadvar M, et al. Pretreatment and kinetics of oil extraction from algae for biodiesel production[J]. Asia-Pacific Journal of Chemical Engineering, 2014, 9: 629-637.
[18] 王浚浩,张雨,杨优优,等. 微藻种类对其热解质量损失规律和产物及动力学的影响[J]. 农业工程学报,2018,34(19):239-247.
Wang Junhao, Zhang Yu, Yang Youyou, et al. Weight-loss characteristics, components of bio-oil and kinetics during pyrolysis from different types of microalgae[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(19): 239-247. (in Chinese with English abstract)
[19] 陆洪省,刘亚樵,刘文君,等. 养殖污水中蛋白核小球藻的分离鉴定及其污水处理效果[J]. 农业工程学报,2017,33(4):273-277.
Lu Hongsheng, Liu Yaqiao, Liu Wenjun, et al. Isolation, identification offrom aquaculture wastewater and its purification of wastewater[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(4): 273-277. (in Chinese with English abstract)
[20] Ng M, Liana A E, Liu S, et al. Preparation and characterisation of new-polyaluminum chloride-chitosan composite coagulant[J]. Water Research, 2012, 46(15): 4614-4620.
[21] Liu Y, Li X, Bai F, et al. Effect of system parameters on the size distributions of hollow nickel microspheres produced by an ultrasound-aided electrical discharge machining process[J]. Particuology, 2014, 17: 36-41.
[22] Jesus S S D, Ferreira G F, Moreira L S, et al. Biodiesel production from microalgae by direct transesterification using green solvents[J]. Renewable Energy, 2020, 160: 1283-1294.
[23] Chen J, Li J, Dong W, et al. The potential of microalgae in biodiesel production[J]. Renewable and Sustainable Energy Reviews, 2018, 90: 336-346.
[24] Ramos M J, Fernández C M, Casas A, et al. Influence of fatty acid composition of raw materials on biodiesel properties[J]. Bioresource Technology, 2009, 100: 261-268.
[25] Lee A K, Lewis D M, Ashman P J. Disruption of microalgal cells for the extraction of lipids for biofuels: Processes and specific energy requirements[J]. Biomass and Bioenergy, 2012, 46: 89-101.
[26] Onumaegbu C, Alaswad A, Rodriguez C, et al. Modelling and optimization of wet microalgaelipid extraction using microwave pre-treatment method and response surface methodology[J]. Renewable Energy, 2019, 132: 1323-1331.
[27] Ellison C R, Overa S, Boldor D. Central composite design parameterization of microalgae/cyanobacteria coculture pretreatment for enhanced lipid extraction using an external clampon ultrasonic transducer[J]. Ultrasonics Sonochemistry, 2019, 51: 496-503.
[28] Santos R R D, Moreira D M, Kunigami C N, et al. Comparison between several methods of total lipid extraction from Chlorella vulgaris biomass[J]. Ultrasonics Sonochemistry, 2015, 22: 95-99.
[29] Escorsim A, Rocha G, Vargas J, et al. Extraction of acutodesmus obliquus lipids using a mixture of ethanol and hexane as solvent[J]. Biomass and Bioenergy, 2018, 108: 470-478.
Microalgal harvesting and lipid extraction by coupling buoyant-bead and ultrasound-assisted solvent extraction method
Xu Kaiwei1, Zou Xiaotong1, Liu Yi1, Zhang Gaoshan1, Du Weihao1, Ma Xiaojing1, Lei Chencen1, Li Yanpeng1,2※
(1710054,;2.,’,710054,)
Microalgae can widely be considered as one of the most promising bioenergy feedstocks. There is no competition with crops, where microalgae do not require arable land for cultivation. There is also no influence on the supply or price of food crops, compared with conventional oil crops. However, the harvesting and lipid extraction of microalgae have been the major challenges in the microalgae industry. Traditional harvesting is time-consuming, energy-intensive, and/or not eco-friendly, particularly to separate microalgae cells, including centrifugation, gravity sedimentation, flocculation, and flotation. A buoy-bead flotation is emerging for harvesting the microalgae in recent years. The dried biomass powder or wet concentrate can also be used for lipid extraction after microalgae harvesting and concentration. The cost of lipid extraction accounts for 30%-40% of the total biodiesel production. Bead milling, homogenizer, microwave, and ultrasound are commonly-used mechanical disruptions. Among them, ultrasound-assisted extraction has widely been used to extract intracellular components, due to its high energy efficiency easy to be commercialized on a large scale. Specifically, the extraction time can be shortened to 1/10, while the extraction efficiency can increase by 50-500 times, compared with the control. In this study, surface-layered polymeric microspheres (SLPMs) were used in the buoy-bead flotation for harvesting microalgae. After that, the ultrasound-assisted extraction was utilized to break the cell wall, and then to extract lipid from microalgae. In harvesting, the zeta potential of flocs was analyzed to compare the harvesting efficiency of microspheres with flocculants and surface-modified microspheres by a single factor. In lipid extracting, a novel approach was developed to couple the buoyant beads and ultrasound-assisted solvent extraction for higher efficiency. Mathematical modeling and central composite design (CCD) were used to statistically optimize the effect of ultrasonic time, the ratio of hexane and isopropanol, microalgal concentration, and transducer power on lipid yield. The optimum operation condition was determined to compare with different lipid extraction. The compositions of extracted lipids were then characterized using gas chromatography/mass spectrometry analysis (GC-MS). It was found that the SLPMs achieved a higher harvesting efficiency of 98.36%, compared with the surfactant/flocculant and sodium silicate microspheres. Consequently, the maximum lipid yield was 18.91 % under an optimal combination: the ultrasonic time of 13 min, the hexane: isopropanol ratio of 4, microalgal concentration of 13.6 g/L, and transducer power of 254 W. Fourier transform infrared demonstrated that the content of lipid, polysaccharide and proteins increased significantly on the surface of microalgal cells, with the increase of ultrasonic time. More importantly, ultrasound can also damage the cell structure of microalgae cells. A higher cell disruption efficiency and small particle size were achieved in the coupled approach, compared with ultrasonic-assisted solvent extraction. Additionally, compared with the modified Bligh & Dyer method, the buoyant beads and ultrasound assisted solvent extraction (BBUASE) method has lower polyunsaturated fatty acid content and higher saturated fatty acid content. Thus, the BBUASE can be expected to serve as a highly efficient way to produce fatty acid methyl ester and raw biodiesel in the modern microalgae industry.
biodiesel; lipid; extraction; microalgae; buoy-bead flotation; ultrasound disruption
徐开伟,邹小彤,刘意,等. 耦合浮珠-超声辅助溶剂萃取法用于微藻采收及油脂提取[J]. 农业工程学报,2021,37(15):267-274.doi:10.11975/j.issn.1002-6819.2021.15.032 http://www.tcsae.org
Xu Kaiwei, Zou Xiaotong, Liu Yi, et al. Microalgal harvesting and lipid extraction by coupling buoyant-bead and ultrasound-assisted solvent extraction method[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(15): 267-274. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.15.032 http://www.tcsae.org
2021-04-23
2021-07-13
陕西省自然科学基金(2020JM-236);中央高校基本科研业务费专项(300102299703, 300102299708)
徐开伟,博士生,研究方向为生物质生化转化。Email:2418212334@qq.com
李彦鹏,教授,博士生导师,研究方向为污废资源化与能源化应用。Email:liyanp01@chd.edu.cn
10.11975/j.issn.1002-6819.2021.15.032
TQ028
A
1002-6819(2021)-15-0267-08
