杨梅素抗抑郁作用及对神经递质的调控机制
2021-11-25王玉婷
陶 静, 周 铭*, 王玉婷, 熊 英
(1.武汉市肺科医院药学部,湖北 武汉 430030;2.武汉大学药学院实验中心,湖北 武汉 430070;3.武汉市第五医院药学部,湖北 武汉 430050)
近年抑郁症患者数量不断攀升,持续的心境低落导致的自残、自杀等行为对社会和个人造成了严重危害[1]。抑郁症的发病机制有多种,很多学者研究发现中枢系统神经递质失衡,神经递质如五羟色胺(serotonin,5-HT)、多巴胺(dopamine,DA)、去甲肾上腺素(norepinephrine,NE)等的减少可能是导致抑郁的最主要原因[1-3]。目前,临床治疗抑郁症的首选药物是氟西汀,其主要是通过抑制突触间隙对5-HT的摄取起效,且治疗效果显著[3-4]。为减少长期服药带来的毒副作用,寻找天然、有效的活性药物治疗包括抑郁症、精神分裂症等神经精神类疾病成为近年研究的热点[5-8]。杨梅素(myricetin)主要存在于杨梅、山茶等植物中,其醇提物中富含大量杨梅素苷等物质,具有抗氧化、抗衰老等生理活性,其还可以通过血脑屏障,对预防神经退行性疾病等也有一定的功效[9-11]。然而,杨梅素是否具有抗抑郁作用尚不清楚,对慢性应激刺激诱导的下丘脑-垂体-肾上腺轴功能失调,逆转5-HT等递质的减少是否有调节作用也未见相关报道。因此,本研究通过复制小鼠慢性应激抑郁模型,采用悬尾实验、强迫游泳实验和旷场实验评估杨梅素对抑郁小鼠行为学的影响,与此同时,采用高效液相色谱(HPLC)检测中枢系统单胺递质5-HT、NE、DA水平,荧光分光光度法检测MAO活性,初步探讨杨梅素抗抑郁作用机制,为后续进一步的研究提供依据。
1 材料与方法
1.1 动物 清洁级昆明小鼠50只,雌雄各半,体质量20~25 g,8周龄,购自湖北省疾控中心,实验动物生产许可证号SCXK(鄂)2008-0005,清洁级动物房饲养。
1.2 试剂与药物 杨梅素对照品(美国Sigma公司,纯度>96%,批号72576);盐酸氟西汀片(礼来苏州制药有限公司,批号2079A)。5-羟色胺(5-HT)、去甲肾上腺素(NE)、多巴胺(DA)、司立吉林(MAO-B)、氯吉林(MAO-A)均购自美国Sigma公司(批号25002、1362500、H8502、M7441、M7316)。其他试剂均为分析纯。临用前,氟西汀、杨梅素分别用生理盐水配制成1、5 mg/mL混悬液备用,并将后者稀释1倍配制成低剂量(2.5 mg/mL)。
1.3 仪器 酶标仪(上海科华实验系统有限公司,型号KHB ST-360);水浴锅(郑州科华仪器设备有限公司,型号HH-600);高效液相色谱仪(HPLC,日本岛津公司,型号LC-20A)。
1.4 造模、分组及给药
1.4.1 造模 采取文献[6-7]报道的方法,每天下午15:00随机给予小鼠昼夜颠倒(24 h)、禁食(24 h)、禁水(24 h)、4 ℃冰水游泳(5 min)、45 ℃热烘(5 min)、潮湿饲养(潮湿垫料)慢性刺激中的1种,连续21 d,饲养环境为温度(24±1)℃,相对湿度(60±10)%。
1.4.2 分组及给药 50只小鼠随机分成空白对照组,模型组,杨梅素高、低剂量组(50、25 mg/kg),氟西汀组(10 mg/kg),每组10只,除空白对照组外,其他各组小鼠造模同时每天上午灌胃给药,剂量1.0 mL/100 g,连续21 d,空白对照组、模型组灌胃给予等量生理盐水。
1.5 行为学评估
1.5.1 旷场试验 参照文献[6-7],于实验第7、14、21天灌胃给药后1 h,将小鼠放入纸箱中(5×5格,500 mm×500 mm×300 mm),记录5 min内直立次数和水平穿过格数。直立次数标准为双前爪同时抬起,水平穿过格数标准为有3只及以上爪子同时穿越1个格子。
1.5.2 悬尾实验 参考文献[6-7],于实验第7、14、21天灌胃给药后1 h,将小鼠尾巴末端固定在1根横木棒上,头向下,身体倒立悬空,小鼠四周无攀抓物,观察6 min内小鼠活动情况,并记录后5 mim内小鼠悬尾不动的时间。
1.5.3 强迫游泳实验 参考文献[6-7],于实验第7、14、21天灌胃给药后1 h,将小鼠置于1个高20 cm、直径15 cm的透明容器内,提前注入(25±2)℃温水,水位达12 cm时停止,观察6 min内小鼠在容器中的游泳状况,记录后5 min内游泳不动时间,即小鼠漂浮在水面,偶尔移动或四肢没有运动,仅头露在水面以上的时间。
1.6 HPLC法测定小鼠大脑单胺递质水平 于实验第21天完成行为学实验后,断头处死各组小鼠,冰上迅速剥离脑组织,称定质量后置于冷冻管中保存,加入0.1 mol/L过氯酸(4 ℃预冷,含0.3 mmol/L的EDTA-2Na、0.5 mmol/L亚硫酸钠),冰上组织匀浆,置于4 ℃冰箱中避光静置5 min后10 000 r/mim离心10 min,取上清液,0.22 μm微孔滤膜过滤,自动进样20 μL,色谱条件参考文献[12],即Diammonsilim C18色谱柱(150 mm×4.6 mm,5 μm);流动相100 mmol/L的枸橼酸-柠檬酸钠缓冲液(pH 4.0)-0.1 mmol/L EDTA-16%甲醇;体积流量0.8 mL/min;检测波长275 nm。
1.7 荧光分光光度法检测小鼠大脑单胺氧化酶活性 根据文献[13]方法,冰上分离小鼠脑组织,称定质量,按1∶9比例加入预冷磷酸缓冲液(pH 7.8,0.05 mol/L)组织匀浆,取2.5 mL磷酸缓冲液,依次加入0.4 mL 20%Triton、0.2 mL匀浆液,振荡混匀后置于37 ℃水浴锅中孵育10 min,加入1 μmol/L MAO-B或MAO-A抑制相应的MAO,再加入30 μL终浓度为22 μmol/L的底物,在37 ℃下孵育30 min,最后加入0.2 mL 5 mol/L高氯酸终止反应并离心,取0.5 mL上清液,加到2.5 mL 1 mol/L氢氧化钠溶液中,采用荧光分光光度计测定最终产物4-氢喹啉的荧光强度(激发光318 nm,发射光380 nm)。

2 结果
2.1 杨梅素对抑郁小鼠行为学的影响 如图1所示,与空白对照组比较,模型组小鼠7 d后水平穿越格数由(92.32±19.73)下降至(54.32±28.14)格,直立次数也由(21.45±16.81)次减少至(8.73±6.05)次,差异有统计学意义(P<0.01),第14天及第21天,模型组小鼠水平穿越格数和直立次数均减少(P<0.05,P<0.01);与模型组比较,给予25、50 mg/kg杨梅素后小鼠在旷场实验中水平穿格数和直立次数均增加(P<0.01),自主活动量恢复超过70%,接近氟西汀组。
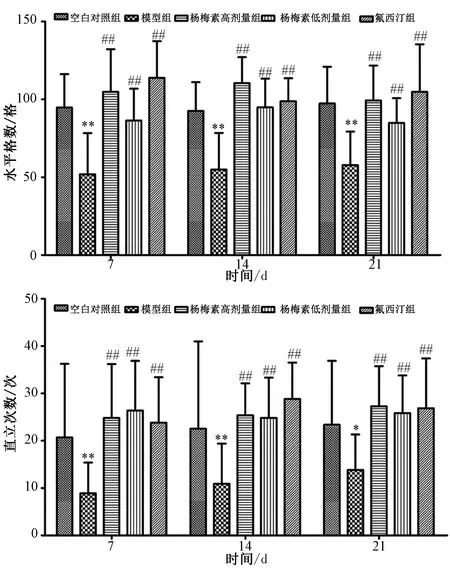
注:与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01。
如图2~3所示,第7天模型组小鼠悬尾不动时间较空白对照组从(91.06±22.14)s延长至(138.35±40.43)s,差异有统计学意义(P<0.05),游泳不动时间为(190.36±27.65)s,较空白组延长了约70 s(P<0.05),第14、21天,模型组小鼠悬尾和游泳不动时间几乎是空白对照组的2倍;杨梅素干预后,第7天悬尾及游泳不动时间减少至90 s或更短,第14、21天,小鼠抑郁不动状态得到改善,悬尾、游泳不动时间下降了50~100 s(P<0.05,P<0.01),其中50 mg/kg杨梅素效果与10 mg/kg氟西汀类似。

注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。

注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01。
2.2 杨梅素对小鼠大脑单胺递质水平的影响 如表1所示,与空白对照组比较,模型组小鼠5-HT、NE、DA水平均降低(P<0.01);与模型组比较,25、50 mg/kg杨梅素干预后小鼠脑内单胺类神经递质5-HT、NE、DA水平升高(P<0.01),以高剂量更显著。
表1 各组小鼠大脑单胺类递质水平
2.3 小鼠下丘脑单胺氧化酶活性 如表2所示,与空白对照组比较,模型组小鼠MAO-A、MAO-B活性升高(P<0.01);杨梅素干预后,小鼠下丘脑MAO-A、MAO-B活性被抑制(P<0.05,P<0.01),以高剂量组更显著。
表2 各组小鼠下丘脑单胺氧化酶活性
3 讨论
有研究采用慢性不可预知刺激大鼠后,其自主行为相关指标减少近30%,表明慢性不可预知刺激可造成动物抑郁行为[14]。本文得到了类似的结果,小鼠在旷场实验中自主活动量减少了30%~50%,抑郁造模成功;这和张业奇等[7]研究结果一致,小鼠在不可预知刺激后反应迟钝、动作缓慢,水平和直立活动均大幅度下降。悬尾实验和强迫游泳实验的不动时间长短可以反映小鼠的抑郁、绝望状态。模型组悬尾实验和强迫游泳实验中不动时间明显延长,表现出精神运动性抑制、兴趣丧失等症状,与Jin[5]、张华林等[14]研究结果类似,说明小鼠在不可预知刺激后抑郁,自主行为减少。给予杨梅素干预后,抑郁小鼠自主活动明显改善,悬尾和游泳不动时间缩短,杨梅素有效地预防并改善了小鼠抑郁状态,且疗效与剂量相关,这和许腾[8]、张华林[14]、Yu等[15]的研究结果相符,中药类物质如皂苷、黄酮等改善抑郁行为具有一定的剂量依赖性,高剂量组抗抑郁效果优于低剂量组。本文首次发现杨梅素可以改善慢性应激刺激诱导的小鼠抑郁行为改变,证实其具有抗抑郁样作用。
单胺递质假说提出,中枢系统单胺递质5-HT、NE、DA的缺乏是抑郁症发生发展的重要基础之一。下丘脑5-HT、NE和DA系统在生理活动的调控方面发挥了重要作用,具体包括睡眠、情绪及食欲等[16-17];而其缺乏、不足会直接或间接影响中枢对应的5-HT受体、α/β受体、DA受体功能从而导致精神异常、抑郁情绪或迟滞行为[15-17]。大多数抗抑郁药物都是通过提高大脑单胺递质水平起效,在不同剂量药物治疗干预下,小鼠脑内单胺类神经递质5-HT、NE和DA水平与模型组比较有了大幅回升,尤其是高剂量组小鼠单胺递质水平回升更显著。这可能得益于天然组分药物作用于中枢系统如多巴胺受体、单胺氧化酶等发挥神经调节作用[18],杨梅素也可使中枢5-HT、NE和DA等神经递质上调发挥抗抑郁作用。
当大脑中枢MAO活性被抑制后,动物的抑郁状态会得到改善[18],MAO-A主要氧化降解去甲肾上腺素和5-HT;而MAO-B主要氧化降解多巴胺和儿茶酚胺等[19]。因此本文还检测了各组小鼠大脑单胺氧化酶的活性变化,与Wang等[18]报道类似,杨梅素高剂量组小鼠下丘脑MAO-A和MAO-B活性明显被抑制,说明中药提取物可有效抑制中枢MAO活性,缓解单胺递质耗竭。杨梅素通过抑制下丘脑MAO活性,使得中枢系统参与行为、情绪活动调节的神经递质5-HT、NE和DA水平上升,进一步表明杨梅素对中枢系统的单胺神经递质具有调节作用,可以逆转应激刺激导致的中枢系统单胺递质5-HT、NE和DA水平的下降。因此,杨梅素抗抑郁的作用可能是通过抑制MAO活性,上调中枢系统单胺递质的水平起效的。
杨梅素能通过抑制大脑单胺氧化酶MAO活性,提高中枢系统神经递质5-HT、NE及DA水平,从而增加抑郁小鼠自主活动量,缩短悬尾及游泳不动时间,改善小鼠的抑郁行为和迟缓呆滞状态,起到抗抑郁样作用。高剂量(50 mg/kg)杨梅素治疗效果和10 mg/kg氟西汀相当,能够预防并改善慢性应激诱导的抑郁样行为,其可能的机制是抑制MAO活性,增加大脑中枢神经递质5-HT、NE及DA的水平。
