程序性死亡受体1基因多态性与胃癌铂类药物化疗敏感性的相关性研究
2021-11-25余玲玲何素梅徐文新
余玲玲, 何素梅, 赵 万, 徐文新
(1. 南京医科大学附属苏州科技城医院, 江苏 苏州, 215000;2. 江苏省苏州市相城区漕湖人民医院, 江苏 苏州, 215144)
胃癌的发病率在恶性肿瘤中居第4位,病死率居第2位,全球每年约有99万例新发病例,约73万例患者死亡[1]。中国2015年新发胃癌病例40.3万例,发病率为29.31/100 000[2], 多数患者就诊时已处于进展期,5年生存率低。化疗是胃癌的主要治疗手段之一,其中铂类药物是基线用药,常与其他化疗药物组成多种有效化疗方案,但是随着疗程进展,肿瘤细胞可出现耐药而导致化疗失败[3]。近年来,相关研究[4-5]发现多种耐药基因参与铂类药物化疗耐药过程。程序性死亡受体1(PD-1)是适应性和先天免疫应答的抑制剂,可抵抗肿瘤T细胞免疫,导致肿瘤免疫逃避[6]。PD-1异常表达与胃癌预后不良有关[7]。PD-1单核苷酸多态性(SNP)可引起PD-1基因异常表达和结构与功能异常,导致疾病的发生,相关报道[8]显示PD-1基因rs2227982、rs36084323、rs7421861多态性与食管胃交界处腺癌发病风险显著相关。但PD-1基因多态性与胃癌铂类药物化疗的药物反应是否存在关联尚不清楚,本研究检测了103例胃癌患者PD-1基因rs36084323、rs2227982、rs7421861位点多态性,并分析其与铂类药物化疗敏感性的关系,现报告如下。
1 资料与方法
1.1 一般资料
本研究获得苏州科技城医院伦理委员会审核批准,选取2016年5月—2020年12月于本院住院治疗的胃癌患者作为研究对象。纳入标准: ① 经组织病理学证实胃癌者; ② 汉族患者; ③ 美国东部肿瘤协作组(ECOG)体力状况评分≤2分者; ④ 接受化疗,且化疗前血常规、肝肾功能正常者。排除标准: ① 合并其他部位恶性肿瘤,严重心、肝、肾功能障碍者; ② 有铂类化疗药物禁忌证者; ③ 既往接受手术、放化疗治疗者或采用非化疗方法治疗者; ④发生广泛远处转移或腹腔种植性转移,预计存活期不足5个月,恶病质、病情危重者; ⑤ 有认知功能障碍而无法沟通者; ⑥ 拒绝参与研究者。最终共纳入103例胃癌患者,男55例,女48例; 年龄52~73岁,平均(62.35±5.12)岁; 肿瘤直径2~5 cm, 平均(3.65±0.62)cm; 肿瘤部位为胃上部29例、胃中部42例、胃下部32例; 病理类型为腺癌62例,印戒细胞癌39例,其他2例; 分化程度为低度分化57例、高中度分化46例; TNM分期为ⅢA~ⅢB期 51例、ⅢC~Ⅳ期 52例。所有患者及其家属均对研究知情同意。
1.2 化疗方法及化疗反应评估
所有患者接受奥沙利铂联合替吉奥(SOX)方案或者紫杉醇脂质体联合顺铂、5-氟尿嘧啶(PCF)方案化疗。① SOX方案: 替吉奥胶囊(山东新时代药业有限公司,批号170913)口服,早晚各1次,剂量80 mg/m2(第1~14天),注射用奥沙利铂(江苏恒瑞医药有限公司,批号170811)130 mg/m2静脉滴注(第1天)。1个化疗周期为21 d, 连续化疗2个周期。② PCF方案: 注射用顺铂(齐鲁制药有限公司,批号170113) 20 mg/m2避光静脉滴注, 1 次/d(第1~5天),注射用紫杉醇脂质体(南京绿叶制药有限公司,批号181205) 135 mg/m2静脉滴注(第1天),氟尿嘧啶注射液(天津金耀药业有限公司,批号170112)750 mg/m2静脉滴注(第1~5天)。1个化疗周期为21 d, 化疗2个周期。
治疗结束后,根据实体肿瘤疗效评价标准(RECIST)1.1版[9]进行影像学检查和疗效评价,疗效分为完全缓解(病灶完全消失)、部分缓解(病灶直径之和减少>30%)、稳定(病灶直径之和减少≤30%或增大<20%)、进展(病灶直径之和增大≥20%或出现新发病灶)。将完全缓解、部分缓解定义为化疗敏感(将此类患者纳入敏感组,共45例),稳定、进展定义为化疗抗拒(将此类患者纳入抗拒组,共58例)。
1.3 PD-1基因多态性检测
化疗结束后采集患者外周静脉血3 mL置于2%EDTA抗凝试管中,取100 μL血标本加入红细胞裂解液混匀,冰浴,离心(4 ℃,2 000转/min,离心半径10 cm,时间3 min)弃上清,加入5% Chelez 100 μL混匀, 56 ℃孵育20 min, 震荡10 s, 离心(4 ℃, 2 000转/min, 离心半径10 cm, 时间2 min), 应用核酸提取仪(美国贝克曼库尔特公司)及配套试剂提取DNA,选择波长260 nm和280 nm处的吸光度(A)比值(A260/280)在1.6~1.8, 浓度>50 ng/μL的DNA样品待检。GenBank数据库查找PD-1基因,采用Premier 5.0软件设计引物,引物序列由北京蓝博斯特生物技术有限公司设计。rs36084323: 上游引物5′-GCCATCCACAAGGTGGAAGCT-3′, 下游引物5′-CTCAACCCCACTCCCATTCTG-3′; rs2227982: 上游引物5′-GGACAGCTCAGGGTAAGCAG-3′, 下游引物5′-GCATACTCCGTCTGCTCAGG-3′; rs7421861: 上游引物5′-AAGGGGGTGAAGGCTCTTAG-3′, 下游引物5′-CTGGGGAGTCTGAGAGATGG-3′。
以提取DNA为模板进行聚合酶链反应(PCR)扩增反应,反应体系为25 μL,含有60 ng DNA,2.5 μL dNTPs(2 mmol/L), 反应条件为94 ℃ 预变性5 min, 94 ℃ 变性30 s, 55 ℃退火 30 s, 72 ℃ 延伸30 s, 35个循环, 72 ℃延伸5 min。取PCR扩增产物10 μL进行碱性磷酸酶处理后进行PCR反应, 37 ℃ 20 min, 85 ℃ 5 min, 4 ℃延伸。加入单碱基延伸反应液(包括HPLC用水0.6 μL, iPLEX Buffer Plus 0.2 μL, iPLEX Termination min 0.2 μL, Primer Mix 0.9 μL, iPLEX Enzyme 0.04 μL)进行PCR反应, 37 ℃ 20 min, 85 ℃ 5 min, 4 ℃延伸。树脂纯化10 min, 采用MassARRAY 核酸质谱分析系统(美国Sequenom公司)对PD-1基因rs36084323、rs2227982、rs7421861位点多态性进行质谱检测。
1.4 统计学分析
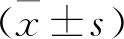
2 结 果
2.1 基线资料
敏感组高中度分化者占比、ⅢA~ⅢB期者占比高于抗拒组,差异有统计学意义(P<0.05); 2组其他基线资料(年龄、性别、肿瘤直径、病理类型、肿瘤部位、化疗方案)比较,差异无统计学意义(P>0.05)。见表1。
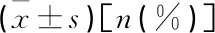
表1 2组患者基线资料比较
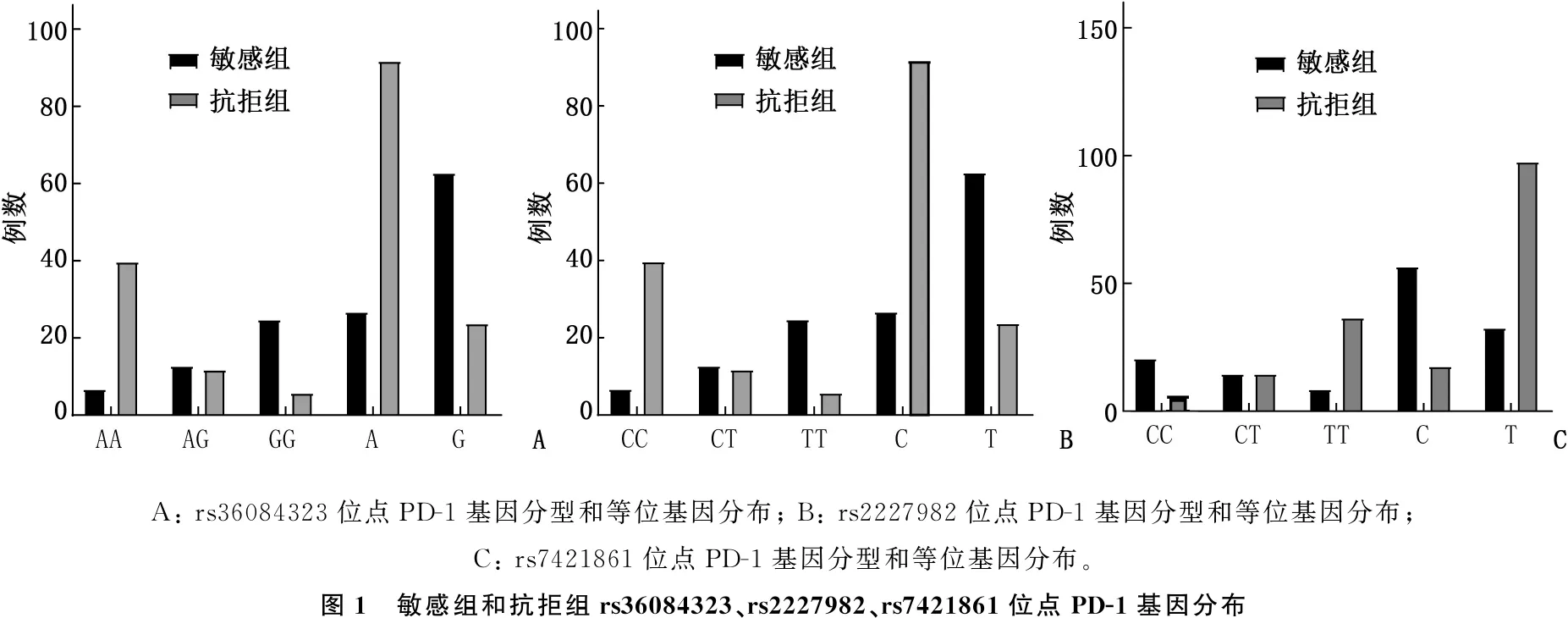
2.2 敏感组和抗拒组PD-1基因rs36084323、rs2227982、rs7421861位点多态性比较
2组rs36084323、rs2227982、rs7421861位点PD-1基因型频率分布均符合Hardy-Weinberg平衡定律(P=0.241、0.306、0.421), 具有群体代表性,可进行遗传学分析。敏感组与抗拒组rs36084323位点PD-1基因型、等位基因分布情况比较,差异无统计学意义(χ2=0.103、0.114,P=0.950、0.736); 2组rs2227982、rs7421861位点PD-1基因型、等位基因分布情况比较,差异有统计学意义(χ2=33.752、53.973、24.120、50.048,P<0.001)。rs2227982位点TT基因型(OR=1.739, 95%CI为1.656~1.867)、CT基因型(OR=1.524, 95%CI为1.435~1.663)化疗敏感性较CC基因型提高, T等位基因化疗敏感性较C等位基因提高(OR=1.721, 95%CI为1.603~1.851), 差异有统计学意义(P<0.05)。rs7421861位点TT基因型(OR=1.605, 95%CI为1.556~1.767)、CT基因型(OR=1.414, 95%CI为1.372~1.525)化疗敏感性较CC基因型降低, T等位基因化疗敏感性较C等位基因降低(OR=1.531, 95%CI为1.423~1.672), 差异有统计学意义(P<0.05)。见图1。
2.3 胃癌铂类药物化疗敏感性的影响因素分析
以胃癌患者铂类药物化疗结局为因变量(赋值: 0=抗拒, 1=敏感),以分化程度(赋值: 0=低度分化, 1=高中度分化)、TNM分期(赋值: 0=ⅢA~ⅢB期, 1=ⅢC~Ⅳ期)、PD-1基因rs2227982位点多态性(赋值: 0=CC基因型, 1= CT+TT)、PD-1基因rs7421861位点多态性(赋值: 0= TT基因型, 1= CT+CC)为自变量,建立Logistic回归模型。Logistic回归分析结果显示,分化程度、PD-1基因rs2227982位点多态性、PD-1基因rs7421861位点多态性与胃癌患者铂类药物化疗敏感性显著相关(P<0.01), 见表3。
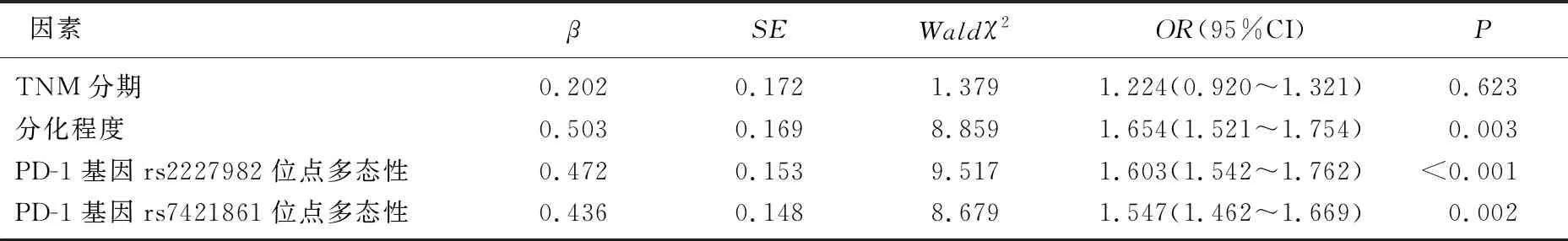
表3 影响胃癌铂类药物化疗敏感性的Logistic回归分析结果
3 讨 论
铂类药物是抗瘤活性较强的广谱抗肿瘤药物,可通过进入癌细胞与DNA结合形成Pt-DNA, 导致交链和复制障碍,诱导细胞凋亡,发挥抗癌作用,是目前治疗胃癌的基础化疗药物。但由于个体之间存在遗传异质性,即便采用同种化疗方案和同样剂量,个体疗效和毒副作用的差异性也较大[10]。相关研究[11]发现,免疫检查点不仅与肿瘤形成有关,也与化疗个体异质性反应和化疗失败有关。
PD-1属于免疫球蛋白CD28/B7超家族,是一种具有负向免疫调节功能的免疫检查点抑制剂,在T细胞、B细胞、自然杀伤细胞、单核细胞及树突状细胞中广泛表达,在肿瘤特异性T细胞上高表达,通过与程序性死亡受体配体1(PD-L1)结合负性调控T细胞增殖分化,激活抗原特异性T细胞凋亡和抑制调节性T细胞凋亡,在抑制免疫应答和促进自身耐受性方面发挥着重要作用[12-13]。T细胞表面PD-1与PD-L1结合后, PD-1胞内段C端免疫受体酪氨酸转换基序发生磷酸化而被激活,磷酸化的C端免疫受体酪氨酸转换基序募集胞内Src同源区2含域磷酸酶-2(SHP-2)分子, SHP-2可抑制Toll样受体去磷酸化,同时抑制T淋巴细胞增殖分化,损伤T细胞效能,使T淋巴细胞功能“耗竭”,降低对肿瘤杀伤能力[14]。抑制PD-1和PD-L1可增强T细胞应答,介导抗肿瘤活性[15]。临床研究[16]显示, PD-1抑制剂联合化疗可提高复发或转移性鼻咽癌的客观缓解率。PD-1抑制剂联合阿帕替尼治疗晚期胃癌,可减轻阿帕替尼毒的副作用[17]。
PD-1基因位于人类染色体2q37.3, 存在多个突变位点,本研究选取与胃癌相关的常见突变位点s36084323、rs2227982、rs7421861[8]进行多态性分析,结果发现rs2227982、rs7421861位点多态性与胃癌患者铂类药物化疗敏感性有关。rs2227982 C/T多态性位于外显子5, 编码PD-1受体胞内氨基酸,参与信号转导和免疫调节通路。REN H T等[18]发现, rs2227982位点TT基因型、CT基因型相较于CC基因型可降低人表皮生长因子受体-2(Her-2)阳性乳腺癌的患病风险。但相关研究[19]结果显示, rs2227982位点TT基因型或CT基因型相较于CC基因型增加了胃贲门癌的患病风险。本研究发现, rs2227982位点TT基因型、CT基因型较CC基因型化疗敏感性高,提示携带T基因者的化疗反应性更高。分析原因, rs2227982位点C→T突变可使PD-1受体胞外域中的缬氨酸(Val)被丙氨酸(Ala)取代,影响PD-1基因序列、分子结合和功能,进而改变PD-1在免疫调节中的作用[8], 抑制其负向调控免疫反应的作用,导致抗肿瘤活性增强,促使对铂类化疗药物有更好的反应性。rs7421861 C/T多态性位于内含子1, 涉及顺式作用元件和反式作用因子相互作用,在PD-1基因启动、活性增加、基因表达中发挥着重要作用。rs7421861位点多态性与整体癌症风险增加[19], ZANG B等[20]研究显示rs7421861位点TT基因型食管癌患者血清PD-1水平高于TC基因型和CC基因型,生存率低于TC基因型和CC基因型。本研究结果显示, TT基因型、TC基因型较CC基因型患者具有更低的铂类化疗敏感性,说明rs7421861位点C→T变异可提高PD-1活性,进而抑制T细胞应答和抗肿瘤活性,导致化疗抗拒。本研究未发现rs36084323位点多态性与胃癌铂类药物化疗反应性的关系,赵万等[21]也指出rs36084323 A/G多态性与非小细胞肺癌患者铂类药物化疗敏感性无关。
综上所述, PD-1基因rs2227982、rs7421861位点多态性可能与胃癌患者铂类药物化疗敏感性有关, rs2227982位点携带T等位基因者有更高的化疗敏感性,rs7421861位点携带T等位基因者可能有更高的化疗抗拒性。本研究局限之处在于样本量偏少,仅检测了汉族居民的PD-1基因多态性,今后还需扩大样本范围和例数开展更加深入的研究。
