基于调控ABCA1 表达探讨升麻苷抗动脉粥样硬化的作用机制
2021-11-25王仙伟何欣威柯绍发
王仙伟 雷 虹 何欣威 朱 峰 柯绍发
动脉粥样硬化(atherosclerosis,AS)是脑梗、心梗、高血压等心脑血管疾病的主要病理基础,涉及炎症细胞浸润,脂质代谢紊乱,氧化应激,内皮细胞损伤等一系列反应过程[1-2]。心脑血管疾病死亡率高居榜首[3-4]。研究表明,炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)参与AS 炎症反应,同时脂质失衡、细胞内胆固醇外流减少是AS 发生、发展过程中的重要环节之一[5-6]。前期有效防治AS 病理进展可降低心脑血管疾病的发病率与死亡率。升麻苷(cimicifugoside)为防风的有效成分,能够改善内皮细胞炎性因子IL-6、TNF-α 的释放,抑制单核与内皮细胞黏附性增高,从而达到抑制AS 炎性反应的作用,腺嘌呤核苷三磷酸结合盒转运体A1(ATPbinding cassette A1,ABCA1)是胆固醇逆向转运蛋白之一,其可介导细胞内胆固醇外流进而达到平衡脂质的作用[7-9],本文探讨升麻苷防治AS 的作用机制。
1 实验材料
1.1 细胞 THP-1 人单核细胞(批号SCSP-567,中科院上海细胞生物所)。
1.2 药品 升麻苷(批号D83729,上海源叶生物科技有限公司)。
1.3 试剂与仪器 RPMI1640 培养基、胎牛血清均购自Gibco 公司(批号27387663、12337648);CCK8试剂盒(批号AJ30298,DOJINDO 公司);佛波酯(PMA)(批号52391EA03,上海翊圣生物科技有限公司);ECL 极超敏显色液(批号P0018FM,碧云天公司);IL-6 与TNF-α ELISA 试剂盒、油红O 染色试剂盒(批号H007-2、H053-56、D027-1-1,南京建成);β-actin 抗体(批号CS-2311,武汉博士德生物科技有限公司);;ABCA1、IL-6、TNF-α 抗体(批号ab66217、ab233706、ab255275,Abcam 公司)。Cytation1多功能酶标仪(美国Biotek),纯水仪(美国MILLIPORE 公司,Synthesis A10),倒置显微镜(日本尼康,Ti2),双色红外激光成像系统(美国Odyssey CLX)。
2 实验方法
2.1 泡沫细胞诱导及鉴定 THP-1细胞培养于RPMI-1640(含10%胎牛血清、100U/mL 青霉素、100μg/mL 链霉素)培养液中,静置培养于37℃、5%CO2饱和湿度培养箱中,每36h 换液1 次,每48~72h传代1 次,于传代3 次后第1 天取对数生长期细胞铺板实验,每次细胞实验中使用150nmol PMA 孵育细胞24h,正常THP-1细胞在400 倍光镜下呈悬浮状态,为圆形或卵圆形,而PMA 刺激后显微镜下细胞形态不规则且大部分细胞伸出伪足,证实THP-1细胞已分化成为巨噬细胞[10],更换孔板培养液后加入终浓度为50mg/L 的低密度脂蛋白(ox-LDL)诱导THP-1 源性巨噬细胞泡沫化48h 后加入升麻苷进行干预研究。
2.2 油红O 染色 取对数生长期细胞培养于6 孔板,经分化处理后使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗,3×5min。50%异丙醇固定1min,油红O 红色储备液染色10min,复染液染色3~5min,水洗30~60s,封片后镜检。
2.3 CCK8 法测定细胞存活率 96 孔板四周外圈孔板铺PBS,于中间孔板部分铺浓度为2×104个/mL 的泡沫细胞200μL,每组6 个复孔,培养48h,使得细胞处于对数生长期。各组加入体积分数为10%的CCK8试剂,作用3h 后,使用Cytation1 酶标仪测量450nm处的吸光度,统计分析后计算细胞存活率。
2.4 TNF-α 及IL-6 测定 将ox-LDL 诱导的泡沫细胞传代后,接种对数生长期细胞于6 孔板中,密度为3×104个/mL,培养于37℃、5%CO2的培养箱中。培养48h 后收集各组细胞上清液,根据试剂盒说明书进行TNF-α 及IL-6 测定。
2.5 Western blot 检测相关蛋白表达 收集各组细胞加入细胞裂解液(含苯甲基磺酰氟1mmol/L),置于冰上裂解30min 后12000r/min 4℃离心15min。离心获得蛋白用BCA 法测定浓度,加入5×蛋白上样缓冲液于95℃变性15min。8%~12% SDS-PAGE 凝胶电泳分离蛋白,电泳后的蛋白样品转移到聚偏氟乙烯膜上,然后用5%的脱脂奶粉室温封闭1h,TBST 洗膜3 次后孵育相应一抗(1∶1000)4℃过夜,TBST 洗膜3次后室温孵育相应二抗(1∶5000)2h,使用ECL 试剂盒化学发光,Fluor chem R 成像系统扫描分析蛋白条带。
2.6 细胞内胆固醇流出率测定 采用闪烁计数法测定,细胞孵育结束后接种于24 孔板,调整适当的细胞密度,当细胞融合率到达90%时,使用0.2μCi/mL[3H]胆固醇孵育24h。弃去细胞培养液,PBS 液洗涤细胞3 次,再用含1% FBS 的RPMI-1640 培养液平衡24h。PBS 洗涤细胞后使用闪烁液裂解细胞,用闪烁计数法检测培养液和细胞中的[3H]胆固醇。胆固醇流出率=(培养液counts/min 值)/(总counts/min 值)×100%,其中总counts/min 值=培养液counts/min 值+细胞counts/min 值,以百分比(%)显示统计。
2.7 统计学方法 应用GraphPad Prism 8.0和SPSS 20.0 软件对实验数据统计分析,计量资料采用均数±标准差()表示,进行单因素方差分析(多组)或Student’s t 检验(两组),P<0.05 认为差异有统计学意义。
3 实验结果
3.1 THP-1 源性巨噬泡沫细胞的诱导分化 以PMA 诱导THP-1 单核细胞,24h 后可见细胞呈梭形贴壁生长,多数细胞伸出伪足,说明细胞已分化为巨噬细胞(见图1A)。对分化的巨噬细胞使用ox-LDL孵育48h,使用10%油红O 染色,显微镜下观察可见细胞质内大量红色脂质颗粒,呈现出泡沫细胞的形态特点,见图1B。

图1 THP-1 源性巨噬泡沫细胞的诱导分化(油红O 染色×40)注:A 为PMA 诱导分化的THP-1 单核细胞;B 为油红O 染色oxLDL 孵育后的巨噬细胞
3.2 不同浓度升麻苷对THP-1 源性巨噬泡沫细胞存活率的影响 不同浓度升麻苷处理THP-1 源性巨噬泡沫细胞48h,CCK8 法检测细胞存活率,结果显示,与空白对照相比,升麻苷浓度≤64μg/mL 时差异无统计学意义,且细胞活力维持在90%以上,因此该范围浓度内升麻苷对细胞作用无明显毒性;而当浓度到128、256μg/mL 时,细胞活力降低(P<0.05 或P<0.01),表明高浓度升麻苷处理细胞可能存在毒性,进而选择16、64μg/mL 作为后续药物干预浓度,见表1。
表1 各组细胞活力比较(%,)

表1 各组细胞活力比较(%,)
注:与对照组比较,aP<0.05,aaP<0.01
3.3 升麻苷对THP-1 源性巨噬泡沫细胞上清液TNF-α、IL-6 含量影响 THP-1 源性巨噬泡沫细胞组上清液中TNF-α 与IL-6 的含量明显增加,表明经诱导后的细胞具有明显的炎症反应(P<0.01),而经16、64μg/mL 升麻苷干预,可降低培养液中TNF-α与IL-6 的含量,且呈现出浓度相关性,差异有统计学意义(P<0.05 或P<0.01),见表2。
表2 升麻苷对THP-1 源性巨噬泡沫细胞TNF-α、IL-6含量影响(pg/mL,)
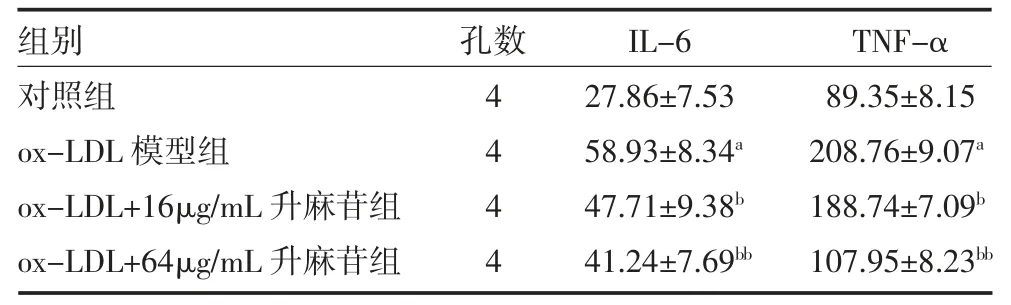
表2 升麻苷对THP-1 源性巨噬泡沫细胞TNF-α、IL-6含量影响(pg/mL,)
注:ox-LDL 为氧化低密度脂蛋白;TNF-α 为肿瘤坏死因子-α;IL-6为白介素-6;与对照组比较,aP<0.01;与ox-LDL 模型组比较,bP<0.05,bbP<0.01
3.4 升麻苷对THP-1 源性巨噬泡沫细胞相关蛋白表达影响 Western blot 检测结果表明,与对照组相比,ox-LDL 模型组的IL-6、TNF-α 蛋白表达均明显增加,膜整合蛋白ABCA1 表达明显降低,差异有统计学意义(P<0.01)。经16、64μg/mL 升麻苷药物干预后,IL-6、TNF-α 蛋白表达量降低,ABCA1 蛋白表达量增强(P<0.05 或P<0.01),见表3、图2。
表3 升麻苷对THP-1 源性巨噬泡沫细胞IL-6、TNF-α和ABCA1 蛋白表达影响()

表3 升麻苷对THP-1 源性巨噬泡沫细胞IL-6、TNF-α和ABCA1 蛋白表达影响()
注:ox-LDL 为氧化低密度脂蛋白;IL-6 为白介素-6;TNF-α 为肿瘤坏死因子-α;ABCA1 为腺嘌呤核苷三磷酸结合盒转运体A1;与对照组比较,aP<0.01;与ox-LDL 模型组比较,bP<0.05,bbP<0.01
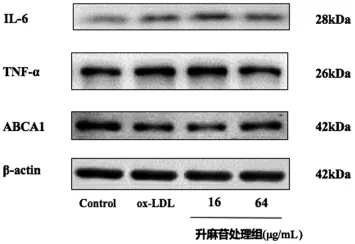
图2 升麻苷对THP-1 源性巨噬泡沫细胞相关蛋白表达影响(n=4)
3.5 升麻苷对THP-1 源性巨噬泡沫细胞胆固醇流出影响 ox-LDL 模型组泡沫细胞处理后胆固醇流出率较对照组显著增加,差异有统计学意义(P<0.01)。经16、64μg/mL 升麻苷干预细胞后胆固醇流出率进一步增加,差异有统计学意义(P<0.05 或P<0.01),见表4。
表4 升麻苷对THP-1 源性巨噬泡沫细胞胆固醇流出的影响(%,)
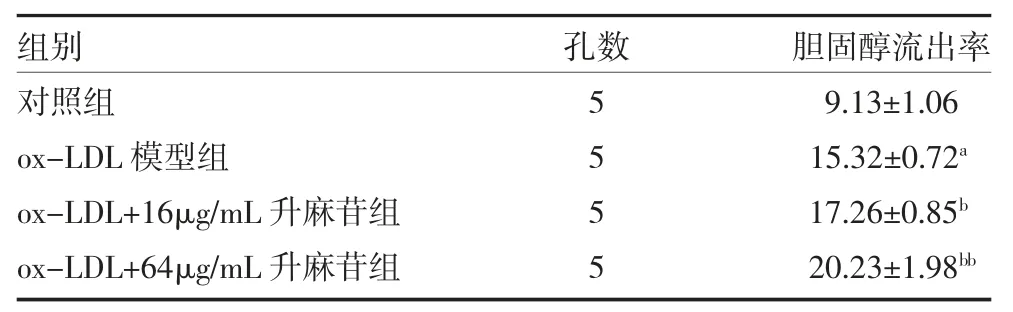
表4 升麻苷对THP-1 源性巨噬泡沫细胞胆固醇流出的影响(%,)
注:ox-LDL 为氧化低密度脂蛋白;与对照组比较,aP<0.01;与ox-LDL模型组比较,bP<0.05,bbP<0.01
4 讨论
心脑血管疾病严重危害人类生命健康,AS 是心脑血管疾病的主要病理基础,其与心脑血管疾病的发生、发展、复发有着密切的关系,以AS 为基础的缺血性事件发病率和死亡率仍在迅速增加[11-13]。IL-6是一种上游炎性细胞因子,在导致AS 的下游炎症反应中起重要作用[6],此外,促炎细胞因子TNF-α 可以激活血液中的单核细胞,这是炎症状态的标记[5,9,14]。ATP 结合盒转运体是调节胆固醇外排的重要组成部分,被称为逆向胆固醇转运的把守蛋白,而ABCA1是该蛋白家族的重要成员,其具有多种复杂的功能,能介导细胞内磷脂和胆固醇流出,并且在HDL 代谢过程中起重要作用进而维持巨噬细胞内胆固醇的稳态[7,15-17]。巨噬细胞来源的泡沫细胞凋亡导致AS斑块坏死核心的形成,减少斑块区域细胞基质的排泄,可能导致斑块不稳定和大多数心血管并发症[13,17]。AS的发生、发展全程都伴随着泡沫细胞的形成,若能够抑制泡沫细胞的形成同时减少斑块内部的脂质沉积是目前抗AS 的主要治疗策略[18]。
中医认为,AS 属于脉络病变范畴,但根据其临床表现涉及中医“眩晕”“胸痹”“中风”等疾病。病因多属本虚标实,气虚、阴伤、血虚为发病之本,风、火、痰、瘀为发病之标,本病病位在脉络,脉络失养是AS重要的病理机制。《本草新编》言:“防风,味甘、辛,气温,升也,阳也,无毒。系太阳本经之药,又通行脾、胃二经。古人曾分上、中、下以疗病,其实,治风则一。”防风解表祛风,胜湿,止痉,研究表明,其具有显著的抗炎、解热、镇痛作用[19-21]。基于上述理论,本实验通过研究防风中的主要成分升麻苷,从中西医结合角度探讨升麻苷对AS 病变过程中泡沫细胞的药理作用。
AS 的病理变化包括脂质条纹、纤维斑块、粥样斑块、复合病变等,而泡沫细胞是AS 病变的早期细胞学特征。泡沫细胞由单核/巨噬细胞和从动脉中膜迁移到内膜的平滑肌细胞摄取大量脂质而成。本研究使用的THP-1 人源性单核细胞经过PMA 与ox-LDL 联合诱导后制备的THP-1 源性巨噬泡沫细胞是目前研究AS 最为常用的细胞实验方法[22]。结果显示,经过ox-LDL 处理后的THP-1 源性巨噬泡沫细胞TNF-α 与IL-6 显著降低,而加入本实验设定的低、高浓度的升麻苷后,均可降低上述炎症因子的分泌。因此升麻苷在一定程度可改善泡沫细胞的炎症反应。本研究还显示,经过ox-LDL 处理后的泡沫细胞ABCA1 的表达明显降低,而加入低、高浓度的升麻苷后,可升高ABCA1 的表达。本研究结果还显示,ox-LDL 超载条件下,升麻苷能够促进胞内胆固醇外排,抑制THP-1 巨噬细胞模型胆固醇的积累。这提示,升麻苷可能是通过上调ABCA1 表达,促进泡沫细胞胆固醇流出,发挥抑制泡沫细胞脂质蓄积的作用。目前认为PPARγ-LXRα 通路是调控ABCA1 蛋白表达的核心通路[23-25],下一步我们将会探讨升麻苷是否通过该通路影响ABCA1 蛋白的表达,从而达到抑制胞内胆固醇积累的作用,并在动物模型中观察其对动脉硬化斑块的干预作用。总之,细胞研究结果初步表明,升麻苷可能具有抗AS 进展的作用,值得进一步深入研究。
