新型化合物EndiandrinA对脊髓损伤潜在治疗的研究
2021-11-24钱然
钱然

摘要:脊髓损伤是一种高发病率和高死亡率的疾病,而嗅鞘细胞是脊髓神经修复治疗的一种有前途的方法,并且利用天然产物可以改善嗅鞘细胞移植后的功能。我们检测了化合物Endiandrin A (End A)在神经碎片因子的存在下,对嗅鞘细胞的影响。我们发现,End A(10 mM)在存在神经碎片因子的情况下,刺激了嗅鞘细胞的增殖和迁移,证明了End A能调节嗅胶质细胞的行为,从而改善移植后的生存、增殖和迁移,从而有利于神经修复。
关键词:脊髓损伤;EndiandrinA;嗅鞘细胞
脊髓损伤(SCI)是一种高发病率和高死亡率的疾病,会导致不可逆的轴突损伤和神经元死亡,导致感觉和自主神经功能的永久性缺陷,从而导致慢性瘫痪[1]。除了最初的损伤外,一系列严重的生理并发症,包括肠、膀胱、呼吸和心脏的缺陷也是主要的威胁。。目前,脊髓损伤的治疗仍然主要是保守性的,包括处理疼痛综合征和感觉丧失并发症的临床护理。幸运的是,神经生物学研究的进展,预示着新的关键型神经保护和恢复疗法,这些治疗性干预可能会降低伤后护理的成本。
细胞治疗是治疗脊髓损伤的一种很有前途的策略,近年来,大量的动物研究表明,嗅球嗅鞘细胞(OB-OECs)和固有层嗅鞘细胞(LP-OECs)在神经系统病理学的各个区域都能促进轴突再生。这些发现包括:(1)肌萎缩侧索硬化(ALS)大鼠模型的神经保护和再髓鞘化;(2)促进中风小鼠模型神经可塑性的能力[2]和(3)神经元碎片[3]。OECs须在移植后存活,因为OECs的增殖是至关重要的。
从早期开始,富含类黄酮的食物就被认为具有神经保护作用,这种作用是由黄酮类化合物的抗氧化能力介导的。天然产物姜黄素通过增加神经碎片因子的增殖、迁移和增强其吞噬功能而成为治疗脊髓损伤的一种潜在选择,利用天然产物可以改善OECs移植后的生存、迁移和增殖功能。
材料和方法:
1. 划痕迁移试验
嗅鞘细胞的迁移通过划痕试验进行测定:在划痕试验前,嗅鞘细胞以3x103的密度被置于96孔板上48小时,以达到70%的愈合度,之后用200μl的移液管尖端在直径为1400至2000μm的无细胞区域划出划痕。用培养基清洗孔以去除细胞碎片,并在含有1%HEPES的DMEM/F12中培养12小时,在0到12小时之间,每间隔15分钟拍摄划痕。
2. 活细胞成像
所有的形态学分析、划痕迁移实验和单细胞迁移实验都是用生命细胞成像技术来进行的。OECs在含有1%HEPES的DMEM/F12培养基中生长,并且图像是在定制的37°C的温室里,不含有二氧化碳的环境下自动采集的。在Olympus IX81 Cell R显微镜上使用Hamamatsu数码相机,每10分钟获得一次12到36小时的荧光和微分干涉对比图像。为了分析活细胞成像动态图,活细胞成像实验的延时记录作为图像系列输出,并使用ImageJ进行手动分析。
结果:
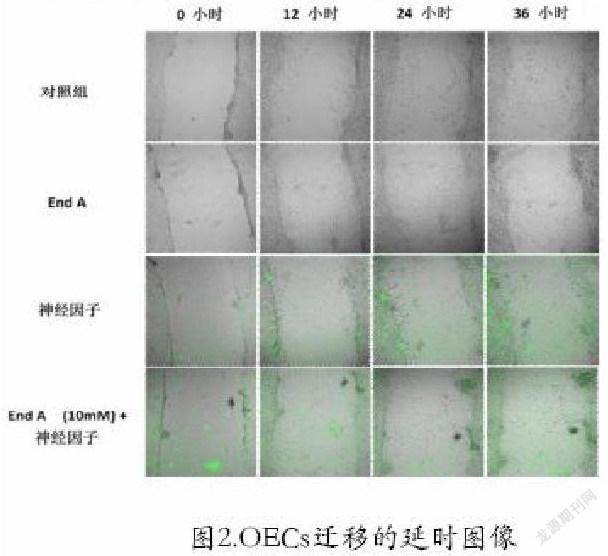
与对照组相比,神经碎片因子分别在12、24、36和48小时时抑制了OEC的迁移(图1),但是,End A在浓度为10µM时,可使伤口愈合率提高68%左右。有趣的是,在有神经碎片因子存在的情况下,End A的迁移率能增加约55%(图1)。此外,延时图像表明,治疗组划痕间隙处的神经碎片因子数量减少,提示End A可能会吞噬神经碎片因子。
讨论:
我们使用延时显微镜观察了End A对OEC迁移的影响(图2),细胞运动很明显受到邻近细胞存在的影响。因此,我们用划痕试验检测了单个嗅鞘细胞的迁移,使细胞迁移到无细胞划痕中,图像显示,细胞并没有沿着直线迁移到划痕处,而是沿着一条曲折的路线迁移。为了分析活细胞成像图像,我们将活细胞成像实验的延时记录导出为一个图像序列,并使用图像J进行手动分析,以确定其空间面积,结果发现End A和神经碎片因子联合应用显著增加了细胞迁移到划痕处的距离[4]。通過使用联合应用End A和神经碎片因子,OECs的生存能力可以显著提高,并可能促进移植后OECs的迁移和增殖,对脊髓损伤有治疗帮助。
参考文献:
1. Leal-Filho, M.B., Spinal cord injury: From inflammation to glial scar. Surg Neurol Int, 2011. 2: p. 112.
2. Katoh, H., et al., The dual origin of the peripheral olfactory system: placode and neural crest. Mol Brain, 2011. 4: p. 34.
3. He, B.R., et al., Phagocytic removal of neuronal debris by olfactory ensheathing cells enhances neuronal survival and neurite outgrowth via p38MAPK activity. Mol Neurobiol, 2014. 49(3): p. 1501-12.
4. Kuntzsch, D., et al., The plant-derived glucocorticoid receptor agonist Endiandrin A acts as co-stimulator of colonic epithelial sodium channels (ENaC) via SGK-1 and MAPKs. PLoS One, 2012. 7(11): p. e49426.
