酒赤芍炮制工艺优化及其体外抗凝血作用考察
2021-11-24武艳雪陈天丽侯晓琳闫妍方晶王孟聪翁丽丽
武艳雪 陈天丽 侯晓琳 闫妍 方晶 王孟聪 翁丽丽

中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2021)21-2613-06
DOI 10.6039/j.issn.1001-0408.2021.21.09
摘 要 目的:优化酒赤芍炮制工艺,并考察其体外抗凝血效果。方法:以氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸和水溶性浸出物的含量为考察指标,通过层次分析法(AHP)、指标相关性的指标权重确定方法(CRITIC)以及两者的混合加权法确定各指标的权重系数并计算综合评分,然后采用Box-Behnken响应面法优化酒赤芍的闷润时间、炒制时间和炒制温度等参数,再采用体外抗凝血实验对按最优炮制工艺所制备的酒赤芍进行初步药效学考察。结果:采用AHP-CRITIC混合加权法确定芍药内酯苷、氧化芍药苷、芍药苷、苯甲酸、水溶性浸出物的权重系数分别为0.233 9、0.131 7、0.183 3、0.078 9、0.372 3。酒赤芍的最优炮制工艺为闷润时间35 min、炒制时间20 min、炒制温度120 ℃。体外抗凝血实验结果显示,生赤芍和酒赤芍均能显著延长小鼠血浆的凝血酶时间、凝血酶原时间、活化部分凝血活酶时间,且酒赤芍的作用显著优于生赤芍(P<0.05)。结论:优化所得酒赤芍的炮制工艺稳定、可行;按此工艺所制酒赤芍的体外抗凝血作用较生品更好。
关键词 赤芍;酒赤芍;抗凝血作用;工艺优化;Box-Behnken响应面法
ABSTRACT OBJECTIVE: To optimize the processing technology of Paeonia lactiflora stir-baked with wine, and to investigate its in vitro anticoagulant effect. METHODS: The weight coefficient of each index was determined and the comprehensive score was calculated with analytic hierarchy process (AHP), Criteria Importance Though Intercrieria Correlation (CRITIC) and AHP-CRITIC weighting method, using the contents of oxypaeoniflorin, albiflorin, paeoniflorin, benzoic acid and water-soluble extract as index. Box-Behnken response surface methodology was used to optimize the parameters of P. lactiflora stir-baked with wine, such as moistening time, frying time and frying temperature. Then in vitro anticoagulant experiment was used to investigate the pharmacodynamics of P. lactiflora stir-baked with wine prepared according to the optimal processing technology. RESULTS: The weight coefficients of albiflorin, oxypaeoniflorin, paeoniflorin, benzoic acid and water-soluble extract determined by AHP-CRITIC weighting method were 0.233 9, 0.131 7, 0.183 3, 0.078 9, 0.372 3, respectively; the optimal processing technology of P. lactiflora stir-baked with wine included moistening time of 35 min, frying time of 20 min and frying temperature of 120 ℃. The results of in vitro anticoagulant test showed that P. lactiflora and P. lactiflora stir-baked with wine could significantly prolong the time of thrombin time, prothrombin time, activated partial thrombin time of plasma; the effects of P. lactiflora stir-baked with wine were significantly better than those of P. lactiflora (P<0.05). CONCLUSIONS: The optimized processing technology of P. lactiflora stir-baked with wine is stable and feasible. The in vitro anticoagulant effect of P. lactiflora stir-baked with wine prepared by this tehcnology is better than that of raw products.
KEYWORDS Paeonia lactiflora; Paeonia lactiflora stir-baked with wine; Anticoagulation; Technology optimization; Box-Behnken response surface methodology
赤芍为毛茛科植物芍药Paeonia lactiflora Pall. 或川赤芍Paeonia veitchii Lynch.的干燥根,味苦,微寒,归肝经[1]。赤芍的主要活性成分为芍药苷、芍药内酯苷、氧化芍药苷、苯甲酸等,具有抗肿瘤、抗凝、抗血栓、降血脂、抗动脉粥样硬化等药理作用[2]。赤芍的炮制方法有清炒、麸炒、酒制、醋制等,现代临床较为常用的有赤芍生品和酒制品[3]。酒制后可增强赤芍活血化瘀的功效[4]。虽然2020年版《中国药典》(一部)和多地的炮制规范均对酒赤芍有所记载[1,5],但并未对其炮制工艺参数进行量化。目前有关酒赤芍炮制工艺的研究还较少,已有的与赤芍相关的炮制工艺研究中考察指标也较为单一,大多局限于芍药苷的含量,且缺乏相关药效学实验验证,不能全面反映该饮片的质量内涵[6]。鉴于此,本研究拟以氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸和水溶性浸出物含量的综合评分为考察指标,基于层次分析法(AHP)、指标相关性的指标权重确定方法(CRITIC)以及两者的混合加权法计算出各指标的权重系数,然后结合Box-Behnken响应面法优化酒赤芍的炮制工艺,并通过体外抗凝血实验初步考察按最优炮制工艺所制备的酒赤芍的药效,为赤芍饮片的炮制和临床应用提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括Prominence-ILC-2030型高效液相色谱(HPLC)仪(日本Shimadzu公司)、MTN-Ⅱ型半自动凝血分析仪(长春市曼特诺医疗器械有限公司)、JA2603B型千分之一电子天平(上海天美天平仪器有限公司)、FA1004B型万分之一电子天平(上海佑科仪器仪表有限公司)、DHG-9053A型电热鼓风干燥箱(上海一恒科学仪器有限公司)、FST-Ⅲ-20s型普力菲尔超纯水机(上海富诗特仪器设备有限公司)、KQ3200E型超声波清洗器(昆山市超声仪器有限公司)、MS-5型炒药机(常州市金坛迈斯机械有限公司)、HT-866迷你型红外测温仪(广州市宏诚集业电子科技有限公司)等。
1.2 主要药品与试剂
赤芍饮片(批号HML20190722-03)购自吉林国安药业有限公司,经长春中医药大学药学院中药鉴定教研室翁丽丽教授鉴定为毛茛科植物芍药P. lactiflora Pall.的干燥根。氧化芍药苷对照品(批号P12N9S74762,纯度≥98%)、芍药内酯苷对照品(批号Y21A9H59553,纯度≥91.4%)、芍药苷对照品(批号L07M9Q60533,纯度≥98%)、苯甲酸对照品(批号Z18S7H21155,纯度≥98%)均购自上海源叶生物技术有限公司;活化部分凝血活酶时间(APTT)检测试剂盒(批号B202005B)、凝血酶时间(TT)检测试剂盒(批号D202005A)、凝血酶原时间(PT)检测试剂盒(批号A202008A)均购自赛奥生物科技(青岛)有限公司;磷酸、甲醇为色谱纯,其余试剂为分析纯,水为超纯水。
1.3 动物
本研究所用动物为SPF级健康ICR小鼠,共18只,雄性,4~6周龄,体质量18~22 g,购自长春市亿斯实验动物技术有限责任公司,实验动物生产许可证号为SCXK(吉)2020-0002。小鼠饲养于温度为(24±2) ℃、12 h光照/12 h黑暗的动物房内,予以常规饲料饲养,自由饮水、进食。小鼠适应性饲养1周后用于实验。
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液 精密称取氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸对照品各适量,置于同一量瓶中,加甲醇溶解并制成上述成分质量浓度分别为0.108 6、0.194 0、0.134 8、0.124 7 mg/mL的混合对照品溶液,备用。
2.1.2 供试品溶液 取酒赤芍样品粗粉(过二号筛,下同)0.5 g,精密称定,置于具塞锥形瓶中,精密加入80%甲醇25 mL,称定质量,超声(功率250 W,频率40 kHz)处理30 min,放冷;再次称定质量,用80%甲醇补足减失的质量,摇匀,过0.22 μm微孔滤膜,取续滤液,即得。
2.1.3 阴性对照溶液 以80%甲醇作为阴性对照溶液。
2.2 酒赤芍的制备方法
取赤芍饮片200 g,加黄酒28 g,拌匀,闷润一定时间,然后置于炒药机内,在一定温度下炒制一定时间,取出,放凉,即得。
2.3 酒赤芍中4种指标成分含量测定方法的建立
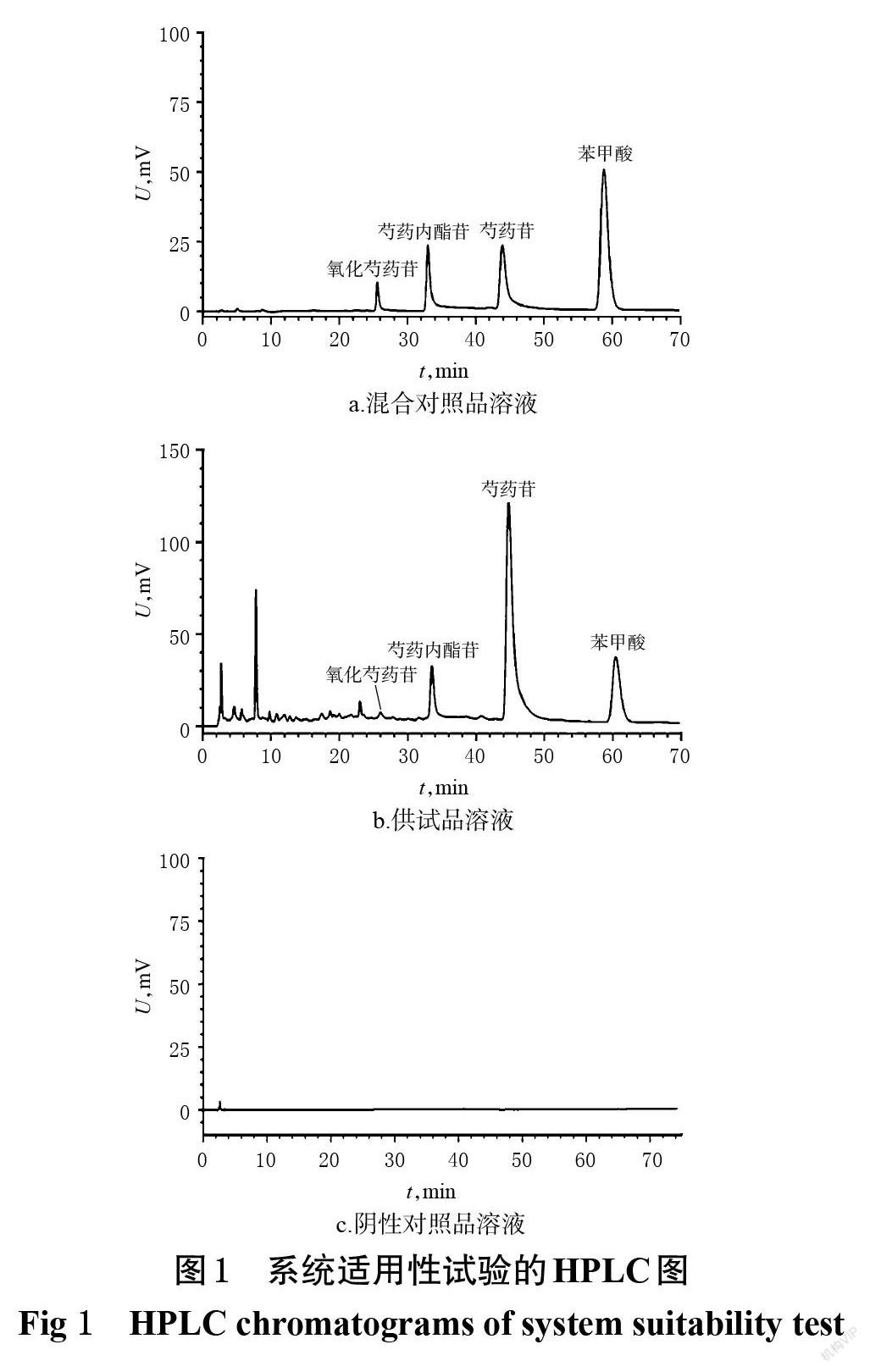
2.3.1 色谱條件与系统适用性试验 以Agilent Eclipse XDB-C18(250 mm×4.6 mm,5 μm)为色谱柱,以甲醇(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~20 min,6%A→18%A;20~35 min,18%A→20%A;35~70 min,20%A;70~75 min,20%A→95%A;75~85 min,95%A;85~90 min,95%A→5%A;90~100 min,5%A);流速为1.0 mL/min;柱温为28 ℃;检测波长为230 nm;进样量为10 μL。取“2.1”项下各溶液(其中酒赤芍样品是按“2.5”项下响应面实验中8号方案制备,下同),分别按此色谱条件进样测定,记录色谱图(图1)。结果显示,各待测成分均达到基线分离,各待测成分色谱峰与相邻色谱峰的分离度均大于1.5,理论板数均大于10 000,且阴性对照溶液对测定无干扰,表明本方法的适用性较好。
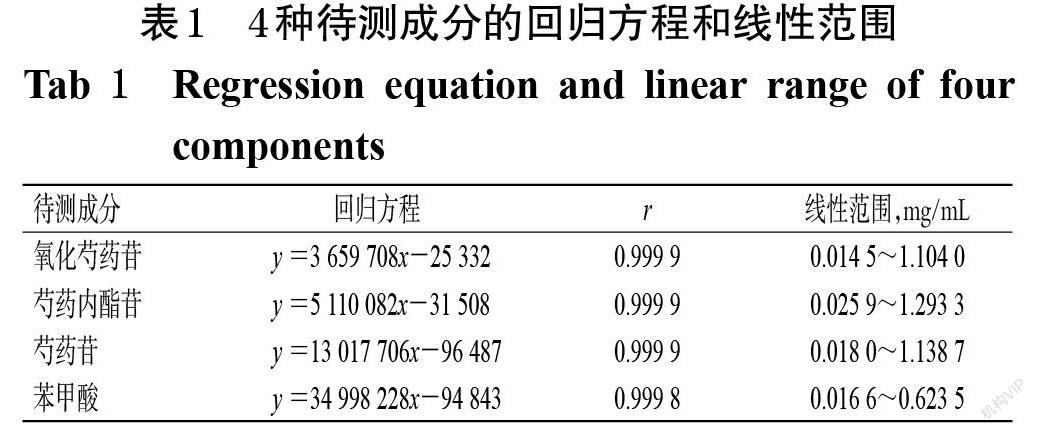
2.3.2 线性关系考察 取氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸对照品各适量,分别按“2.1.1”项下方法制成氧化芍药苷质量浓度分别为0.014 5、0.029 0、0.057 9、0.108 6、0.362 0、0.736 0、1.104 0 mg/mL,芍药内酯苷质量浓度分别为0.025 9、0.051 7、0.103 5、0.194 0、0.323 3、0.646 7、1.293 3 mg/mL,芍药苷质量浓度分别为0.018 0、0.035 9、0.071 9、0.134 8、0.337 0、0.674 0、1.138 7 mg/mL,苯甲酸质量浓度分别为0.016 6、0.033 3、0.066 5、0.124 7、0.247 0、0.332 5、0.623 5 mg/mL的系列线性工作液。取上述系列线性工作液适量,分别按“2.3.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,mg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归。结果显示,各待测成分在其质量浓度范围内与对应峰面积的线性关系均良好(r均大于0.999 0),详见表1。
2.3.3 精密度试验 精密吸取“2.1.1”项下混合对照品溶液适量,按“2.3.1”项下色谱条件连续进样6次,记录峰面积。结果,氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸峰面积的RSD分别为0.58%、1.79%、1.89%、1.69%(n=6),表明仪器精密度良好。
2.3.4 稳定性试验 取酒赤芍粗粉,按“2.1.2”项下方法制备供试品溶液,于室温下密闭放置0、2、4、8、12、24、48 h时按“2.3.1”项下色谱条件进样测定,记录峰面积。结果,氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸峰面积的RSD分别为1.67%、0.89%、0.66%、1.30%(n=7),表明该供试品溶液在室温下密闭放置48 h内的稳定性较好。
2.3.5 重复性试验 取酒赤芍粗粉0.5 g,共6份,分别按“2.1.2”项下方法制备供试品溶液,然后按“2.3.1”项下色谱条件进样测定,记录峰面积,采用外标法计算各成分的含量。结果显示,氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸的平均含量分别为0.193%、1.622%、4.184%、0.520%,RSD分别为1.90%、0.85%、0.24%、1.01%(n=6),表明本方法的重复性较好。
2.3.6 加样回收试验 取已知含量的酒赤芍粗粉9份,每份约0.25 g,精密称定,分别按已知成分含量的50%、100%、150%加入相应对照品溶液,每个浓度水平各平行3份;然后分别按“2.1.2”项下方法制备供试品溶液后,再按“2.3.1”项下色谱条件进样测定,记录峰面积并计算各成分的加样回收率。结果显示,氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸的平均加样回收率分别为100.21%、99.81%、100.79%、100.77%,RSD分别为1.34%、0.21%、1.42%、1.69%(n=9),表明本方法的准确度较好。加样回收试验结果见表2。
2.4 水溶性浸出物含量测定
取酒赤芍粗粉适量,按照2020年版《中国药典》(四部)通则“2201热浸法”测定酒赤芍中水溶性浸出物的含量[7]。
2.5 酒赤芍炮制工艺的优化
查阅文献[8-10]可知,炒制温度、炒制时间、闷润时间对酒赤芍饮片的质量有显著影响。因此,本研究结合前期预实验结果,以闷润时间(A)、炒制时间(B)、炒制温度(C)为考察因素,以氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸和水溶性浸出物含量的综合评分为评价指标,优化酒赤芍的炮制工艺。综合评分的计算公式如下:综合评分=(氧化芍药苷含量/氧化芍药苷含量最大值×氧化芍药苷权重系数+芍药内酯苷含量/芍药内酯苷含量最大值×芍药内酯苷权重系数+芍药苷含量/芍药苷含量最大值×芍药苷权重系数+苯甲酸含量/苯甲酸含量最大值×苯甲酸权重系数+水溶性浸出物含量/水溶性浸出物含量最大值×水溶性浸出物权重系数)×100。酒赤芍炮制工艺优化Box-Behnken响应面设计的因素与水平见表3,实验安排与结果见表4。
2.6 各成分含量指标权重系数的确定
2.6.1 AHP法确定权重系数 中药具有整体性的特点,其药效一般是许多化学成分的综合作用[11]。因此,本研究根据各成分的含量及其药理作用[3],将上述指标分成3个层次并确定优先顺序为水溶性浸出物>芍药苷>氧化芍药苷≈苯甲酸≈芍药内酯苷。据此顺序,采用yaahp v7.5软件构建各指标成对比较的优先判断矩阵(表5),并对矩阵进行归一化处理,计算出水溶性浸出物、芍药苷、芍药内酯苷、氧化芍药苷、苯甲酸的权重系数分别为0.381 6、0.261 4、0.170 0、0.109 0、0.078 0,一致性比率(CR)=0.028 1<0.10,表明该指标成对比较的优先判断矩阵具有满意的一致性,求得的权重系数有效[12]。
2.6.2 CRITIC法确定权重系数 将表4中各成分的含量进行无量纲化处理以消除单位量纲。无量纲数据的计算公式为:无量纲数据=(某指标检测值-该指标最小值)/(该指标最大值-该指标最小值)。然后将无量纲数据代入以下公式计算各指标的权重系数(Wj):Cj= σj[∑][i=1][n](1-rij),Wj=Cj /[∑][j=1][m]Cj。式中,Cj表示第j个(j=1,2,3,……,n)指标所包含的信息量,σj为无量纲化处理后列向量的标准差,rij表示指标i(i=1,2,3,……,n)和指标j之间的相关系数,Wj表示第j个指标的权重系数[13-14]。结果显示,氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸、水溶性浸出物的权重系数分别为0.229 1、0.261 0、0.133 0、0.192 0、0.185 0。
2.6.3 AHP-CRITIC混合加權法确定权重系数 由于AHP-CRITIC混合加权法得到的权重系数在理论上更加全面、合理且符合实际,故笔者将上述2种方法结合后计算各指标的复合权重系数(ωAHP-CRITICij):ωAHP-CRITICij=ωAHPij×ωCRITICij/∑(ωAHPij×ωCRITICij)。式中,ωAHPij表示通过AHP法计算得到的权重系数,ωCRITICij表示通过CRITIC法计算得到的权重系数,i、j分别表示指标i和指标j(加权法算的是一种指标相对于另一种指标的权重,故记为i和j)。结果显示,氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸、水溶性浸出物的权重系数分别为0.131 7、0.233 9、0.183 3、0.078 9、0.372 3。
2.6.4 3种权重分析法计算的综合评分结果比较 分别采用上述3种权重分析法所得的权重系数对响应面实验结果进行评分,结果见表6。采用SPSS 21.0软件对基于3种权重分析法所得的综合评分结果进行相关系数分析。结果显示,基于AHP法与AHP-CRITIC混合加权法、CRITIC法与AHP-CRITIC混合加权法、AHP法与CRITIC法所得综合评分的相关系数分别为0.726、0.887、0.909,三者间的相关性均显著(P<0.01),说明3种方法得到的综合评分结果具有一致性。采用SPSS 21.0软件对3种方法所得权重系数的相关性进行分析。结果显示,CRITIC法与AHP法所得权重系数之间的相关系数为0.046,相关性不显著(P>0.05),说明二者所反映的信息不具有叠加性。因AHP-CRITIC混合加权法是从主、客观两个方面进行考虑,所载含的信息更为科学、合理,故本研究最终选择AHP-CRITIC混合加权法确定的权重系数计算各指标的综合评分:综合评分=(芍药苷含量/芍药苷含量最大值×0.183 3+水溶性浸出物含量/水溶性浸出物含量最大值×0.372 3+芍药内酯苷含量/芍药内酯苷含量最大值×0.233 9+氧化芍药苷含量/氧化芍药苷含量最大值×0.131 7+苯甲酸含量/苯甲酸含量最大值×0.078 9)×100。
2.7 模型拟合及验证实验
2.7.1 模型拟合 以综合评分为因变量,以因素A、B、C为自变量,应用Design-Expert 8.0.6.1软件进行二次多元回归拟合模型分析,得到回归方程为:综合评分=4.45+0.70A-0.82B-0.085C-0.26AB+0.39AC+0.94BC-0.27A2+1.12B2-0.68C2(R2=0.921,P=0.007 3)。方差分析結果显示,因素B、C对综合评分具有显著影响(P<0.05),详见表7。由R2和P值可知,该回归方程的拟合度较好,实验误差较小,能够用来对酒赤芍炮制工艺进行分析和预测。
为进一步考察各因素交互作用的影响,本研究采用Design-Expert 8.0.6.1软件绘制了响应面图和等高线图,详见图2。由图2可知,A与B的交互作用较强。以该软件求解上述二元回归方程,得到酒赤芍的最优炮制工艺为闷润时间35 min、炒制时间20 min、炒制温度120 min;模型预测值为98.75。
2.7.2 最优炮制工艺的验证 取赤芍生品饮片,按“2.7.1”项下最优炮制工艺进行3次验证实验。结果显示,3次验证实验中各指标综合评分的平均值为95.98(RSD为2.12%,n=3),与模型预测值(98.75)的偏差为2.81%,说明该饮片酒制工艺的准确性与稳定性均良好。
2.8 酒赤芍的体外抗凝血活性考察
2.8.1 样品溶液的制备 取赤芍生品粗粉以及按最优炮制工艺制备的酒赤芍粗粉各约1 g,精密称定,置于具塞锥形瓶中,精密加入生理盐水50 mL,称定质量,超声(功率250 W,频率40 kHz)处理30 min,放冷;再次称定质量,用生理盐水补足减失的质量,摇匀,滤过,取续滤液。将续滤液蒸干,再次加入适量生理盐水溶解,然后再以3 000 r/min离心10 min,取上清液,得质量浓度均为0.104 9 g/mL的样品溶液(以生药量计),备用。
2.8.2 分组与给药 将18只小鼠按随机数字表法随机分为空白组、生赤芍组和酒赤芍组,每组6只。将小鼠摘眼球取血,将采集的血液置于含有3.2%柠檬酸钠的抗凝采血管中,将各组6只小鼠的血液分别混匀后,以3 000 r/min离心10 min,收集血浆。将血浆置于-20 ℃冰箱中,备用。
2.8.3 血浆凝血三项的检测与分析 按照相应试剂盒说明书方法操作,采用半自动凝血分析仪分别检测各组小鼠血浆的PT、TT、APTT。其中,检测PT、APTT时生赤芍组均加入50 μL血浆和25 μL生赤芍样品溶液,酒赤芍组均加入50 μL血浆和25 μL酒赤芍样品溶液,空白组均加入50 μL血浆和25 μL生理盐水;检测TT时生赤芍组加入100 μL血浆和50 μL生赤芍样品溶液,酒赤芍组加入100 μL血浆和50 μL酒赤芍样品溶液,空白组加入100 μL血浆和50 μL生理盐水。实验重复3次。采用SPSS 21.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。结果显示,与空白组比较,生赤芍组和酒赤芍组的PT、TT、APTT均显著延长(P<0.05),且酒赤芍组的PT、TT、APTT较生赤芍组均显著延长(P<0.05)。各组小鼠血浆的凝血三项指标检测结果见表8。
3 讨论
中药具有整体性的特点,其药效一般是许多化学成分的综合作用。有报道指出,以浸出物含量与特定活性成分含量组成的复合指标,可更好地控制饮片质量[2,15]。笔者在前期研究中发现,不管是采用冷浸法还是热浸法对酒赤芍中浸出物进行提取,均以水溶性浸出物的含量较高。因此,本研究最终确定以赤芍中含量较高的几种成分(氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸)和水溶性浸出物含量的综合评分为评价指标[3],采用Box- Behnken响应面法优化酒赤芍的炮制工艺。
笔者前期通过单因素实验考察了不同黄酒加入量(20、24、28、30、32、36、40 g)对酒赤芍饮片质量的影响,并确定了最佳的加酒量为28 g。此外,笔者还通过查阅文献、对药厂进行调研及进行预实验等方式,确定了本研究中的炒制温度、炒制时间、闷润时间的水平。本研究采用AHP-CRITIC混合加权法确定各成分指标的权重系数,既能够将炒制温度、炒制时间、闷润时间的重要性量化,又能够通过CRITIC法体现出样本的客观数据信息,消除人为设定量化指标的主观性 [8,12-14]。体外抗凝血实验结果显示,生赤芍和按最优炮制工艺制备的酒赤芍均能显著延长小鼠血浆的TT、PT、APTT,且酒赤芍的作用较生赤芍更优。
综上所述,本研究运用AHP-CRITIC混合加权法和Box-Behnken响应面法相结合的方式优化了酒赤芍的炮制工艺,所制酒赤芍的体外抗凝血效果较生品更好。在以往的赤芍炮制工艺相关研究中,更多的是关注药材指标性成分——芍药苷的含量。而本研究以赤芍中氧化芍药苷、芍药内酯苷、芍药苷、苯甲酸等4种成分作为考察指标,并通过AHP-CRITIC混合加权法赋予各指标不同权重系数,是中药现代化研究的一种探索。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:165.
[ 2 ] 何泽源,张妍妍,林楠,等.赤芍化学成分和药理作用及质量标志物的预测分析[J].中药材,2020,43(12):3075- 3080.
[ 3 ] 段文娟.赤芍的化学成分研究及炮制品中主要化学成分的含量测定[D].沈阳:沈阳药科大学,2008.
[ 4 ] 白宇明,郝近大.芍药的炮制历史沿革与古方中芍药给付品种相关性研究[J].西部中医药,2017,30(7):138-142.
[ 5 ] 山东省食品药品监督管理局.山东省中药饮片炮制规范[S]. 2012年版.济南:山东科学技术出版社,2013:305.
[ 6 ] 许天阳,董坤园,宋凤媛,等. Box-Behnken响应面法优化炒赤芍炮制工艺[J].中国药房,2019,30(20):2845-2850.
[ 7 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:232.
[ 8 ] 李潮,于欢,温柔,等.基于AHP-CRITIC混合加权法和响应面法的盐车前子炮制工艺优选及其利尿作用考察[J].中国实验方剂学杂志,2020,26(20):124-131.
[ 9 ] 位玉蝶,李沁,宋晨鸽,等.基于多指标响应曲面法优选醋炙香附炮制工艺及炮制终点量化研究[J].中草药,2021,52(4):982-992.
[10] 王斌,梁伟龙,林钦贤,等.酒制延胡索微波炮制工艺的优化研究[J].中国药房,2020,31(20):2503-2507.
[11] 刘丹,贾晓斌,郁丹红.基于“组分构成”理论的中药质量控制新思路[J].中国中药杂志,2012,37(6):865-870.
[12] 李学娥,张蜀,邓红,等.基于AHP-CRITIC法赋权的星点设计-效应面法优化瓜子金乳膏处方及其质量评价[J].中国药房,2020,31(21):2615-2621.
[13] 刘小妹,程中琴,施崇精,等.基于AHP-CRITIC法的正交设计优选参膝口服液提取工艺[J].中草药,2018,49(11):2577-2583.
[14] 张娇,蒋倩倩,张伯言,等.基于AHP-CRITIC法正交优选乌甘袋泡茶提取工艺及抗炎作用研究[J].中草药,2020,51(8):2177-2184.
[15] 张雪,王云,王清浩,等.栀子饮片浸出物提取方法的建立及其在栀子不同饮片质量评价中的应用[J].中国中药杂志,2019,44(13):2792-2798.
(收稿日期:2021-05-17 修回日期:2021-09-27)
(编辑:林 静)
