扶脾柔肝颗粒对肝纤维化模型大鼠的改善作用机制研究
2021-11-24安祯祥何远利唐东昕黄丹王敏王芳
安祯祥 何远利 唐东昕 黄丹 王敏 王芳

中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)21-2587-06
DOI 10.6039/j.issn.1001-0408.2021.21.05
摘 要 目的:研究扶脾柔肝颗粒(FRG)对肝纤维化模型大鼠的改善作用机制。方法:将大鼠随机分为空白组、模型组、秋水仙碱片组(化学药阳性对照,0.2 mg/kg)、扶正化瘀胶囊组(中药阳性对照,0.415 g/kg)和FRG低、中、高剂量组(20、40、80 g/kg),除空白组和模型组各11只大鼠外(各取1只用于判断是否造模成功),其余每组10只。除空白组外,其余各组大鼠腹腔注射50% CCl4橄榄油溶液并灌胃30%乙醇以复制肝纤维化模型。造模成功后,各给药组大鼠灌胃相应药物,空白组和模型组大鼠灌胃等体积生理盐水,每天1次,连续4周。末次灌胃后,观察大鼠肝组织病理形态学变化;检测大鼠血清中透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原蛋白(Col Ⅳ)水平;检测大鼠肝组织中Beclin-1、LC3-Ⅱ蛋白表达水平;检测大鼠肝组织中蛋白激酶B(Akt)、腺苷酸活化蛋白激酶(AMPK)、哺乳动物雷帕霉素靶蛋白(mTOR)、 p70核糖体蛋白S6激酶(p70S6K)的mRNA和蛋白表达水平。结果:与空白组比较,模型组大鼠肝小叶结构紊乱,纤维组织增生明显,部分有假小叶形成;血清中HA、LN、PCⅢ、Col Ⅳ水平和肝组织中Beclin-1、LC3-Ⅱ蛋白表达水平以及Akt、AMPK、mTOR、p70S6K 的mRNA和蛋白表达水平均显著升高(P<0.01)。与模型组比较,FRG各剂量组大鼠肝组织损伤明显减轻,血清和肝组织中上述指标(FRG低剂量组LN 、PCⅢ除外)水平均显著降低(P<0.05或P<0.01)。结论:FRG可改善大鼠肝纤维化,其作用机制可能与下调肝组织中自噬相关蛋白和Akt/AMPK/mTOR/p70S6K信号通路相关蛋白的表达有关。
关键词 扶脾柔肝颗粒;肝纤维化;自噬;Akt/AMPK/mTOR/p70S6K信号通路;大鼠
ABSTRACT OBJECTIVE: To study the mechanism of improvement effects of Fupi rougan granule (FRG) on hepatic fibrosis model rats. METHODS: The rats were randomly divided into blank group, model group, Colchicine tablet group (chemical positive control, 0.2 mg/kg), Fuzheng huayu capsule group (TCM positive control, 0.415 g/kg), FRG low-dose, medium-dose and high-dose groups (20, 40, 80 g/kg), with 10 rats in each group, except for 11 rats in blank group and model group (one rat was used to judge whether the modeling was successful). Except for blank group, other groups were given intraperitoneal injection of 50% CCl4 olive oil solution and intragastric administration of 30% ethanol to induce hepatic fibrosis model. After modeling, administration groups were given relevant medicine intragastrically; blank group and model group were given constant volume of normal saline intragastrically, once a day, for consecutive 4 weeks. After last administration, morphology changes of liver tissue in rats were observed. The serum levels of HA, LN, PCⅢ and Col Ⅳ in rats were detected, and protein expression of Beclin-1 and LC3-Ⅱin liver tissue were also determined. mRNA and protein expression of Akt, AMPK, mTOR, p70S6K were detected in liver tissues of rats. RESULTS: Compared with blank group, the structure of hepatic lobules in the model group was disordered, the proliferation of fibrous tissue was obvious, and some pseudolobules were formed; the serum levels of HA, LN, PCⅢ and Col Ⅳ, the protein expression of Beclin-1 and LC3-Ⅱ in liver tissue as well as mRNA and protein expression of Akt, AMPK, mTOR and p70S6K were increased significantly (P<0.01). Compared with model group, the liver injury of rats in FRG groups was significantly relieved, and the levels of the above indexes in serum and liver tissue (except for LN and PCⅢ in FRG low-dose group) were significantly reduced (P<0.05 or P<0.01). CONCLUSIONS: FRG can improve hepatic fibrosis in rats, the mechanism of which may be associated with down-regulating the expression of autophagy associated protein and Akt/AMPK/mTOR/p70S6K signaling pathway related protein.
KEYWORDS Fupi rougan granule; Hepatic fibrosis; Autophagy; Akt/AMPK/mTOR/p70S6K signaling pathway; Rats
肝纤维化是由多种不同病因所致慢性肝损伤而引起的病理性修复过程,以细胞外基质(ECM)异常沉积为特点,进一步可转变为肝硬化或肝癌[1]。研究表明,肝纤维化患者经过干预治疗后,可以得到缓解甚至恢复;若干预不及时,可进展为肝硬化,从而难以恢复[2]。因此,肝纤维化的治疗是阻断肝疾病恶化的关键环节。 肝纤维化的病理机制复杂,目前仍缺乏有效的靶向药物进行治疗。中医药具有多靶点、多途径、多层次的治疗优势,如中药复方制剂复方鳖甲软肝片、扶正化瘀胶囊等已广泛用于肝纤维化的治疗,且具有较好的临床疗效[3]。
扶脾柔肝颗粒(FRG)是由贵州中医药大学第一附属医院开发的院内制剂,由黄芪、白术、苡仁、丹参等9味药物组成,具有健脾柔肝、补气活血的功效,主要用于治疗肝纤维化、肝硬化等[4-5],其临床疗效较好,具有推广和开发为上市新药的价值。
研究发现,蛋白激酶B(Akt)/腺苷酸活化蛋白激酶(AMPK)/哺乳动物雷帕霉素靶蛋白(mTOR)/p70核糖体蛋白S6激酶(p70S6K)是经典的自噬信号通路[6-7],在肝纤维化的发生发展过程中具有重要作用,可参与调节肝星状细胞的增殖活化、胶原合成、自噬和凋亡等[8-9]。Beclin-1和LC3-Ⅱ是自噬特异性标记蛋白,可以反映自噬水平[10]。FRG是否可通过上述通路发挥改善肝纤维化的作用,尚不明确。基于此,本研究首先复制肝纤维化模型大鼠,然后以FRG进行干预后,检测大鼠肝纤维化相关指标[层粘连蛋白(LN)、透明质酸(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原蛋白(Col Ⅳ)]水平,观察其肝组织的病理形态学变化,并检测其肝组织中上述几种蛋白的表达水平,以探讨FRG改善肝纤维化的作用机制,以期为FRG的临床应用及新药开发提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有:FA2004型电子天平(上海上平仪器有限公司),D3024R型低温高速离心机(美国Scilogex公司),VE 180型微型垂直电泳槽、VE 186型转移电泳槽、EPS 300型电泳仪(上海天能科技有限公司),TY-80B型脱色摇床(金坛市荣华仪器制造有限公司),BSA224S型精密电子天平(德国Satorius公司),MUTISKAN MK3型酶标仪(美国Thermo Fisher Scientific公司),TL998-Ⅳ型实时荧光定量聚合酶链式反应(PCR)仪(西安天隆科技有限公司)。
1.2 主要药品与试剂
FRG由黄芪30 g、白术30 g、苡仁30 g、丹参30 g、当归15 g、牛膝15 g、莪术15 g、苍术15 g、枳壳15 g组成,各药材配方颗粒均购自华润三九医药股份有限公司,批号分别为1504001w、1502001w、1502001s、1503002s、1502002w、1502001w、1503001w、1502001w、1410001w;秋水仙碱片(国药准字H53021904,规格0.5 mg)购自云南玉溪生物制药有限公司;扶正化瘀胶囊(国药准字Z20020073,规格0.3 g)购自上海黄海制药有限责任公司;LN酶联免疫吸附试验(ELISA)试剂盒、HA ELISA试剂盒、PCⅢ ELISA试剂盒、Col Ⅳ ELISA试剂盒、苏木精-伊红(HE)染色液(批号分别为20160320、20160101、20160225、20160218、D006)均购自南京建成生物工程研究所;兔源Akt多克隆抗体、兔源AMPK多克隆抗体、兔源mTOR多克隆抗体、兔源P70S6K多克隆抗体、兔源Beclin-1多克隆抗体、兔源LC3-Ⅱ多克隆抗体、兔源甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体、辣根过氧化物酶标记的羊抗兔免疫球蛋白G抗体(二抗)、BCA蛋白测定试剂盒(批号分别为E1A6261、E1A6422、E1A6308、E18-6226、E90562、E1A4007、E1C604-1、E1WP318、E1WP201-2)均購自南京恩晶生物科技有限公司;ECL发光试剂(批号P0018A)购自上海碧云天生物技术有限公司;二甲基亚砜(DMSO)购自美国Sigma公司; PCR引物由上海捷瑞生物工程有限公司设计并合成(PCR引物序列与产物长度见表1);其余试剂为实验室常用规格,水为纯净水。
1.3 动物
本研究所用动物为SPF级SD大鼠,雌雄各半,共72只,体质量(160±20) g,购自南通大学实验动物中心,动物生产许可证号为SCXK(苏)2014-0001。
2 方法
2.1 分组、造模与给药
大鼠随机分为空白组、模型组、秋水仙碱片组(化学药阳性对照,0.2 mg/kg,剂量根据临床等效剂量设置)、扶正化瘀胶囊组(中药阳性对照,0.415 g/kg,剂量根据临床等效剂量设置)和FRG低、中、高剂量组(20、40、80 g/kg,剂量根据临床等效剂量的1、2、4倍设置),空白组和模型组各11只大鼠,其余每组10只。除空白组外,其余各组大鼠参照文献[11]方法进行造模,具体方法如下:大鼠每周腹腔注射50%CCl4橄榄油溶液(1.5 mL/kg)2次,并从造模第2周开始灌胃30%乙醇(10 mL/kg),每2天1次,共造模8周。造模结束后,从空白组和模型组中随机各抽取1只大鼠处死,然后按照《病毒性肝炎防治方案》中肝纤维化分期标准来判断大鼠的肝纤维化程度,当模型组大鼠肝组织有2 期以上肝纤维化形成时,则表明肝纤维化模型建立成功[12]。造模成功后,各给药组大鼠灌胃相应药物(临用时以水溶解),空白组和模型组大鼠灌胃等体积生理盐水,每天1次,连续4周。
2.2 标本采集
末次灌胃后,大鼠禁食12 h,然后腹主动脉采血。血样经抗凝离心后,收集上层血清,于-20 ℃保存,备用。取血完成后,处死各组大鼠,取其肝组织,部分以4%多聚甲醛固定,部分于-80 ℃保存,备用。
2.3 大鼠肝组织病理形态学观察
取“2.2”项下各组大鼠固定于4%多聚甲醛的肝组织,进行石蜡包埋、切片(厚度为4 μm)。各组大鼠取3张切片进行HE染色(另外3张切片后续进行免疫组化实验),然后于光学显微镜下观察大鼠肝组织的病理形态学变化,并拍照。
2.4 大鼠血清中HA、LN、PCⅢ、Col Ⅳ水平的测定
采用ELISA法进行测定。取“2.2”项下各组大鼠的血清样品,按相应试剂盒说明书方法操作,采用酶标仪于450 nm波长下测定大鼠血清中HA、LN、PCⅢ、Col Ⅳ的水平。
2.5 大鼠肝组织中Beclin-1和LC3-Ⅱ蛋白表达水平的检测
采用免疫组化法进行检测。取“2.3”项下另外3张切片,经脱蜡水化、组织抗原修复、山羊血清封闭后,滴加Beclin-1、LC3-Ⅱ一抗(稀释度均为1 ∶ 100),室温孵育2 h;以TBST冲洗5 min×3次,滴加二抗(稀释度为1 ∶ 500),室温孵育1 h; 以TBST冲洗5 min×3次,经DAB显色后,脱水封片,并于光学显微镜下观察,拍照。当切片中出现棕黄色或棕褐色颗粒则为相应蛋白的阳性表达,采用彩色病理图文分析系统测定阳性染色部分的平均光密度,以表示目的蛋白的表达水平。
2.6 大鼠肝组织中Akt、AMPK、mTOR、p70S6K mRNA的表达水平检测
采用逆转录PCR(qRT-PCR)法进行检测。取“2.2”项下冻存的肝组织5份,经裂解、氯仿抽提、异丙醇沉淀、75%乙醇洗涤后,收集总RNA;然后将RNA逆转录为cDNA进行PCR扩增。PCR反应体系为:PCR MasterMix 10 μL,上下游引物各 0.6 μL,cDNA 0.4 μL,H2O 8.4 μL。PCR反应条件为:95 ℃预变性10 min;95 ℃变性5 s,60 ℃退火30 min,共41个循环。以β-actin为内参,采用2-ΔΔCt法计算Akt、AMPK、mTOR、p70S6K mRNA的表达水平。
2.7 大鼠肝组织中Akt、AMPK、mTOR、p70S6K蛋白表达水平的检测
采用Western blot法进行检测。取“2.2”项下冻存的肝组织3份,经裂解后,提取总蛋白。采用BCA法测定蛋白浓度后,对蛋白进行加热变性处理。取变性蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转膜,以5% BSA封闭1 h;以TBST缓冲液冲洗5 min×3次,分别加入Akt、AMPK、mTOR、p70S6K、GAPDH一抗(稀释度均为1 ∶ 1 000),4 ℃孵育过夜;以TBST缓冲液冲洗5 min×3次,加入二抗(稀释度为1 ∶ 5 000),室温孵育1 h;以TBST缓冲液冲洗5 min×3次,加入ECL显色后,置于凝胶成像系统中成像。采用Adobe Photoshop CS5软件分析相应蛋白条带的灰度值,以目的蛋白与内参蛋白GAPDH的灰度值比值表示目的蛋白的表達水平。
2.8 统计学方法
采用SPSS 23.0软件进行统计分析。数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
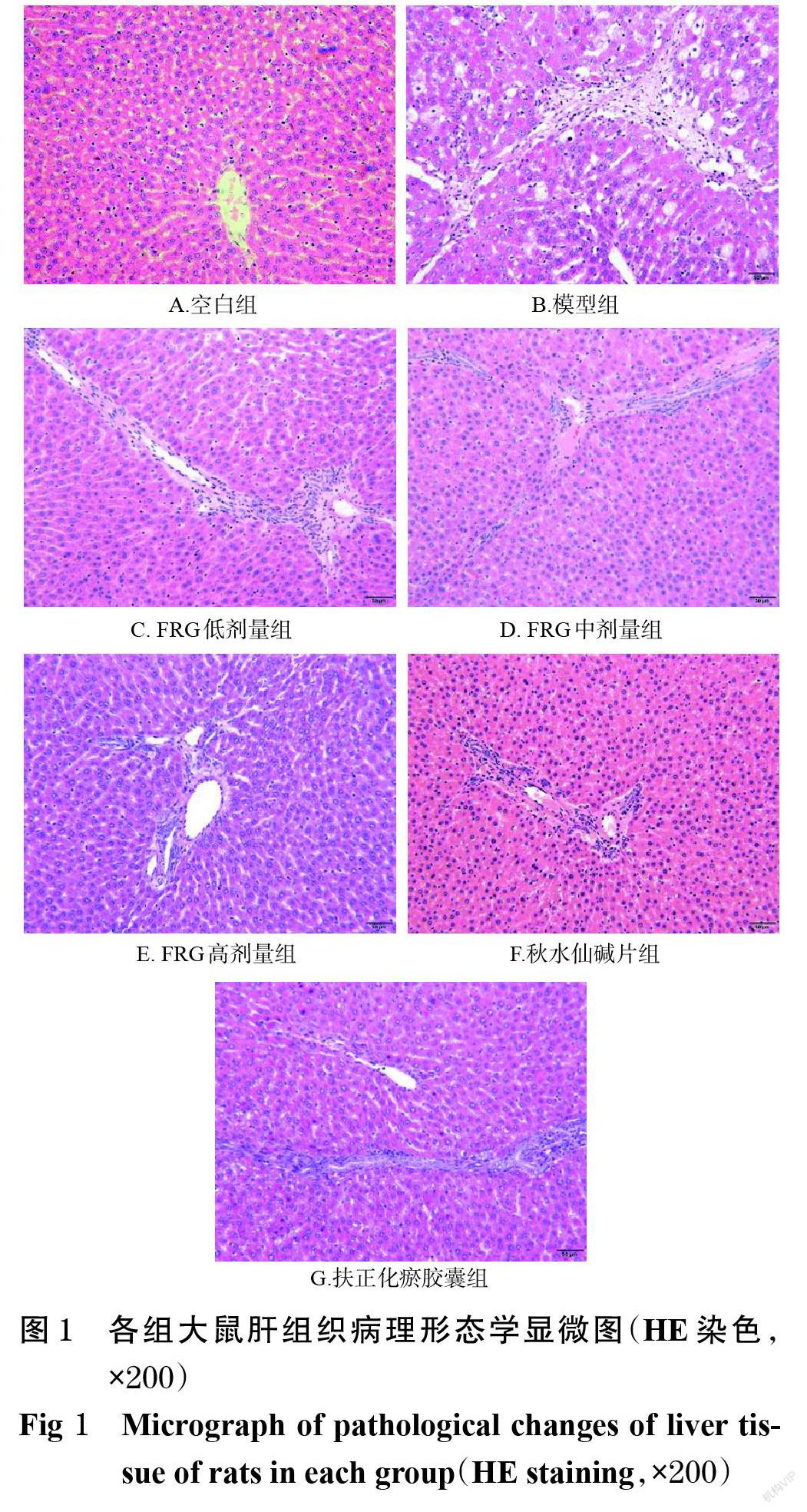
3.1 FRG对肝纤维化模型大鼠肝组织病理形态学的影响
空白组大鼠肝小叶结构正常,肝索排列整齐;模型组大鼠肝小叶结构紊乱,纤维组织增生明显,部分有假小叶形成;药物干预组大鼠肝组织损伤均较模型组明显减轻,详见图1。
3.2 FRG对大鼠血清中HA、LN、PCⅢ、Col Ⅳ水平的影响
与空白组比较,模型组大鼠血清中HA、LN、PCⅢ、Col Ⅳ水平均显著升高(P<0.01);与模型组比较,各药物干预组大鼠血清中HA、LN(FRG低剂量组和扶正化瘀胶囊组除外)、PCⅢ(FRG低剂量组除外)、Col Ⅳ水平均显著降低(P<0.05或P<0.01),详见表2。
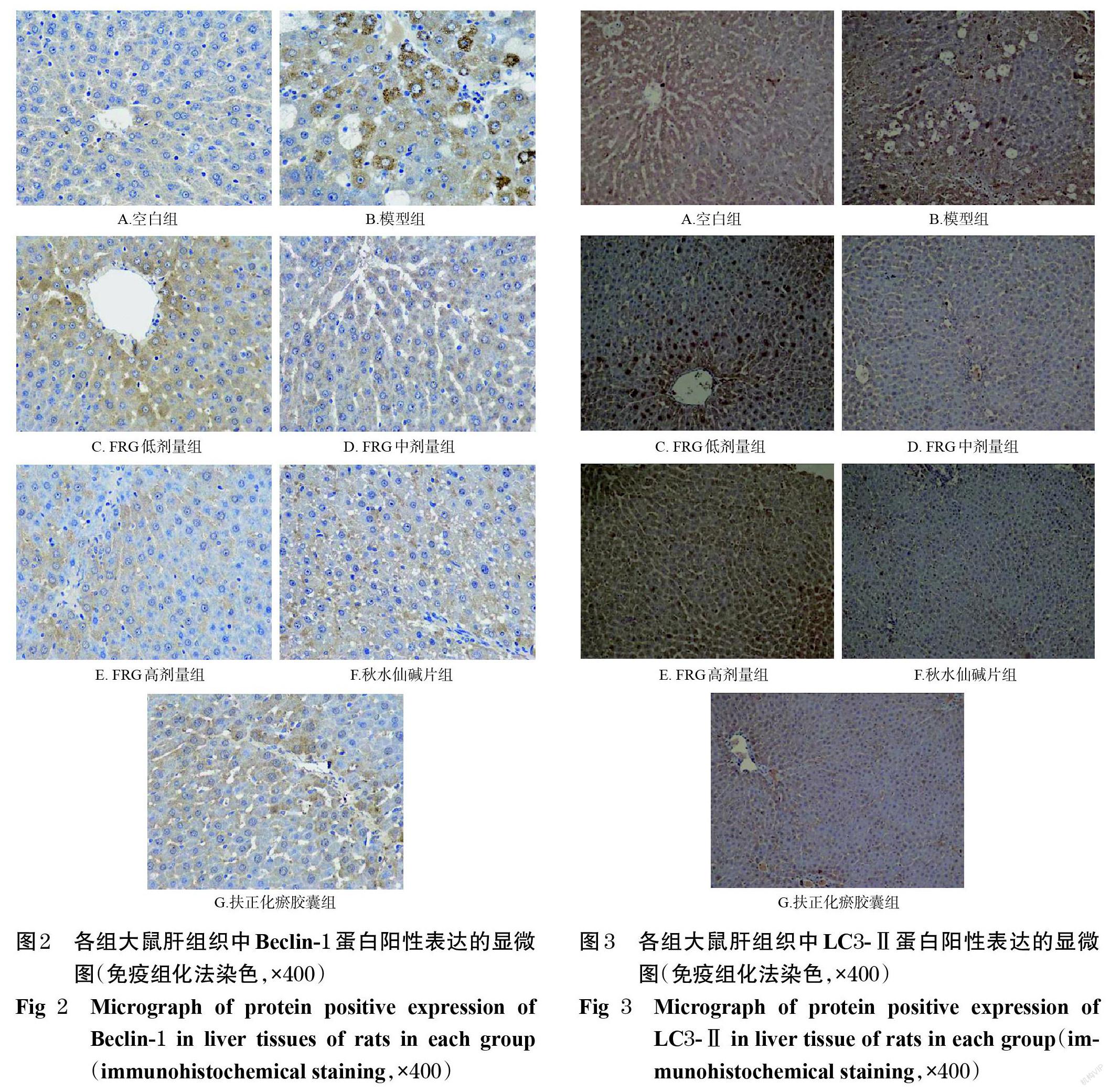
3.3 FRG对大鼠肝组织中Beclin-1、LC3-Ⅱ蛋白表达的影响
与空白组比较,模型组大鼠肝组织中Beclin-1、 LC3-Ⅱ蛋白表达水平均显著升高(P<0.01);与模型组比较,各药物干预组大鼠肝组织中Beclin-1、LC3-Ⅱ蛋白表达水平均显著降低(P<0.05或P<0.01),详见图2、图3、表3。
3.4 FRG对肝纤维化模型大鼠肝组织中Akt、AMPK、mTOR、p70S6K mRNA表达的影响
与空白组比较,模型组大鼠肝组织中Akt、AMPK、mTOR、p70S6K mRNA表达水平均显著升高(P<0.01);与模型组比较,各药物干预组大鼠肝组织中Akt、AMPK、mTOR、p70S6K mRNA表达水平均显著降低(P<0.01),详见表4。
3.5 FRG对肝纤维化模型大鼠肝组织中Akt、AMPK、mTOR、p70S6K蛋白表达的影响
与空白组比较,模型组大鼠肝组织中Akt、AMPK、mTOR、p70S6K蛋白表达水平均显著升高(P<0.01);与模型组比较,各药物干预组大鼠肝组织中Akt、AMPK、mTOR、p70S6K蛋白表达水平均显著降低(P<0.01),详见图4、表5。
4 讨论
肝纤维化属于中医“肝积”“胁痛”“积聚”等范畴。《医宗必读》有云:“积之成者,正气不足,而后邪气踞之”。中医认为,肝纤维化的基本病机为正虚瘀结,主要治疗方法为扶正补虚、活血化瘀、散结。本研究所用FRG具有健脾柔肝、补气活血的功效,临床治疗效果良好,但其具体作用机制尚不明确。基于此,本研究主要探讨FRG改善肝纤维化的作用机制,以期为其临床应用及新药开发提供参考。扶正化瘀胶囊是已被证实能多环节、多层次、多靶点抗纤维化的中药复方制剂[13],秋水仙碱片具有保护肝功能、改善肝纤维化的作用[14],故本研究选取扶正化瘀胶囊作为中药阳性对照,选择秋水仙碱片作为化学药阳性对照。
肝纤维化过程中,HA、LN、PCⅢ和Col Ⅳ在肝脏中异常沉积,从而导致胶原纤维的异常增生,最终导致肝纤维化[15]。本研究结果显示,经FRG干预后,大鼠肝组织损伤以及血清中HA、LN(低剂量组除外)、PCⅢ(低剂量组除外)、ColⅣ水平均较模型组显著降低,这表明FRG可改善大鼠肝纤维化。
自噬是细胞利用可回收的细胞器以维持内环境稳定的一种适应性机制[16-17]。Beclin-1是启动自噬的必要条件,可调控自噬体的形成[18]。LC3-Ⅱ是自噬体膜的结构蛋白,可反映自噬体的数量,是自噬过程中的标志蛋白[19]。本研究结果显示,经FRG干预后,大鼠肝组织中Beclin-1、LC3-Ⅱ蛋白表达水平均较模型组显著降低,这表明FRG可通过抑制细胞自噬,发挥改善大鼠肝纤维化的作用。
Akt/AMPK/mTOR是经典的自噬通路,在肝纤维化的发展过程中具有重要作用。mTOR是一种丝氨酸/苏氨酸蛋白激酶,是上游信号通路调控细胞生长、增殖和自噬的交汇点,是Akt和AMPK共同调控的主要信号节点[20-22];其可通过影响自噬相关蛋白Beclin-1、LC3-Ⅱ来调节自噬[23-25]。mTOR正常存在于细胞浆中,被Akt激活后转移至细胞核,从而激活下游靶分子p70S6K,进而促进肝星状细胞的增殖,最终导致肝纤维化[9,26]。本研究发现,经FRG干预后,大鼠肝组织中Akt、AMPK、mTOR、p70S6K 的mRNA和蛋白表达水平均显著降低。这表明,FRG可通过下调Akt/AMPK/mTOR/p70S6K信号通路相关蛋白的表达,发挥改善大鼠肝纤维化的作用。
综上所述,FRG可改善大鼠肝纤维化,其作用机制可能与下调肝组织中自噬相关蛋白和Akt/AMPK/mTOR/p70S6K信号通路相关蛋白的表达有关。
参考文献
[ 1 ] 中国中西医结合学会肝病专业委员会.肝纤维化中西医结合诊疗指南:2019年版[J].中国中西医结合杂志,2019,39(11):1286-1295.
[ 2 ] 徐列明.《肝纤维化中西医结合诊疗指南(2019年版)》解读[J].上海中医药杂志,2020,54(3):29-31,52.
[ 3 ] 顾宏图,桂红莲,徐列明,等.扶正化瘀片联合恩替卡韦治疗慢性乙型肝炎肝纤维化的效果观察[J].临床肝胆病杂志,2021,37(2):309-313.
[ 4 ] 孙定隆.自拟扶脾柔肝颗粒治疗肝硬化33例小结[J].贵阳中医学院学报,1998,20(2):21-22.
[ 5 ] 安祯祥,何远利,王敏.芒硝外敷联合扶脾柔肝颗粒内服治疗肝硬化腹水的临床研究[J].辽宁中医杂志,2016,43(9):1900-1902.
[ 6 ] XUE J F,SHI Z M,ZOU J,et al. Inhibition of PI3K/AKT/mTOR signaling pathway promotes autophagy of articular chondrocytes and attenuates inflammatory response in rats with osteoarthritis[J]. Biomed Pharmacother,2017,89(17):1252-1261.
[ 7 ] ZHANG Y,LING Y,YANG L,et al. Liraglutide relieves myocardial damage by promoting autophagy via AMPK- mTOR signaling pathway in Zucker diabetic fatty rat[J].Mol Cell Endocrinol,2017,448(17):98-107.
[ 8 ] PENG R ,WANG S ,RONG W ,et al. Antifibrotic effects of tanshinol in experimental hepatic fibrosis by targeting PI3K/AKT/mTOR/p70S6K1 signaling pathways[J]. Discov Med,2017,23(125):81-94.
[ 9 ] 黄秀昆,孙雪梅,韦秀桂,等.老鼠簕生物碱A对肝纤维化大鼠PI3K/Akt/mTOR/p70S6K信号通路的影响[J].中草药,2019,50(2):457-461.
[10] 程建超,童佳兵,朱洁,等.芪玉三龙汤调节Beclin1,Atg5,LC3B表达以抑制肺癌肿瘤生长机制[J].中国实验方剂学杂志,2020,26(9):29-35.
[11] 安祯祥,何远利,王敏.四氯化碳不同给药途径复合乙醇诱导大鼠肝纤维化模型的研究[J].贵州医药,2016,40(1):6-8.
[12] 中华医学会.病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324-329.
[13] 关茜,刘伟,陈佳美,等.扶正化瘀方治疗慢性肝病的临床与基础研究进展[J].临床肝胆病杂志,2021,37(6):1449-1453.
[14] 章波,麥琬婷,檀燕君,等.秋水仙碱治疗肝纤维化的网络药理学研究[J].广西医科大学学报,2020,37(3):372- 379.
[15] 许琼梅,李跃龙,曹后康,等.溪黄草水提物对四氯化碳诱导大鼠肝纤维化的保护作用及机制研究[J].中国药房,2018,29(20):2791-2796.
[16] KIM K H,LEE M S. Autophagy :a key player in cellular and body metabolism[J]. Nat Rev Endocrinol,2014,10:322-337.
[17] HERNANDEZ-GEA V,GHIASSI-NEJAD Z,ROZENFELD R,et al. Autophagy releases lipid that promotes fibrogenesis by activated hepatic stellate cells in mice and in human tissues[J]. Gastroenterology,2012,142(4):938-946.
[18] FUKUI M,YAMABE N,CHOI H J,et al. Mechanism of ascorbate-induced cell death in human pancreatic cancer cells:role of Bcl-2,Beclin 1 and autophagy[J]. Planta Med,2015,81(10):838-846.
[19] DENG Q,WANG Z,WANG L,et al. Lower mRNA and protein expression levels of LC3 and Beclin1,markers of autophagy,were correlated with progression of renal clear cell carcinoma[J]. Jpn J Clin Oncol,2013,43(12):1261- 1268.
[20] YU L,CHEN Y,TOOZE S A. Autophagy pathway:cellular and molecular mechanisms[J]. Autophagy,2018,14(2):207-215.
[21] GOGIRAJU R,HUBERT A,FAHRER J,et al. Endothelial leptin receptor deletion promotes cardiac autophagy and angiogenesis following pressure overload by suppressing Akt/mTOR signaling[J]. Circ Heart Fail,2019,12(1):e005622.
[22] 高雅婷,王心恒,王小樂,等.芪玉三龙汤调节mTOR/Bec- lin1/LC3信号轴相关分子的表达诱导肺癌A549细胞自噬[J].中国实验方剂学杂志,2021,27(1):98-104.
[23] HANSEL D E,PLATT E,ORLOFF M,et al. Mammalian target of rapamycin (mTOR) regulates cellular proliferation and tumor growth in urothelial carcinoma[J]. Am J Pathol,2010,176(6):3062-3072.
[24] JIANG X,CHEN J,ZHANG C,et al. The protective effect of FGF21 on diabetes-induced male germ cell apoptosis is associated with up-regulated testicular Akt and AMPK/Sirt1/PGC-1α signaling[J]. Endocrinology,2015,156(3):1156-1170.
[25] CUI L,LI C,GAO G,et al. Fty720 inhibits the activation of pancreatic stellate cells by promoting apoptosis and suppressing autophagy via the AMPK/mTOR pathway[J].Life Sci,2019,217:243-250.
[26] 牛学敏,王宝玉,王洋,等. PTEN在CCl4诱导肝纤维化大鼠模型中的作用及益气活血方对其的影响[J].临床肝胆病杂志,2018,34(1):122-128.
(收稿日期:2021-06-07 修回日期:2021-08-29)
(编辑:唐晓莲)
