苇茎汤对慢性阻塞性肺疾病急性加重期模型大鼠的改善作用及机制
2021-11-24廖小红张毅靖唐洪梅丘振文罗丹冬杨柳柳杨丽娥罗骞
廖小红 张毅靖 唐洪梅 丘振文 罗丹冬 杨柳柳 杨丽娥 罗骞


中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)21-2593-06
DOI 10.6039/j.issn.1001-0408.2021.21.06
摘 要 目的:研究苇茎汤对慢性阻塞性肺疾病急性加重期(AECOPD)模型大鼠的改善作用及可能机制。方法:将55只雄性SD大鼠按随机数字表法随机分为正常组,模型组,苇茎汤低、高剂量组(8.37、16.74 g/kg,以生药量计)和地塞米松组(阳性对照组,0.09 mg/kg),每组11只。除正常组外,其余各组大鼠均采用香烟联合脂多糖诱导的方法建立AECOPD模型。造模结束后,正常组和模型组大鼠灌胃水,其余各组大鼠灌胃相应药物,每天灌胃2次,连续14 d。末次灌胃后,测定大鼠血清中白细胞介素1β(IL-1β)水平,观察大鼠肺组织和支气管的病理学变化,测定大鼠肺组织中基质金属蛋白酶9 (MMP-9)、基质金属蛋白酶抑制剂1(TIMP-1) mRNA表达水平及Ras同源基因家族成员A(RhoA)、蓬乱蛋白相关形态形成活化因子1(DAAM1)和细胞增殖抑制基因(HSG)蛋白的表达水平。结果:与正常组比较,模型组大鼠血清中IL-1β水平以及肺组织中MMP-9、TIMP-1 mRNA表达水平和RhoA、DAAM1蛋白表达水平均显著升高(P<0.05),肺组织中HSG蛋白表达水平显著降低(P<0.05);支气管周围有较多慢性炎症细胞浸润,部分气道黏膜上皮脱落;肺泡代偿性扩张,肺间隔毛细血管扩张、充血。与模型组比较,苇茎汤高剂量组大鼠血清中IL-1β水平和肺组织中MMP-9 、TIMP-1 mRNA表达水平均显著降低(P<0.05);苇茎汤低、高剂量组大鼠肺组织中RhoA、DAAM1蛋白表达水平均显著降低(P<0.05),HSG蛋白表达水平均显著升高(P<0.05);苇茎汤高剂量组大鼠支气管周围炎症细胞浸润、气道黏膜脱落等病理形态学变化均得到明显改善,肺泡上皮结构较完整、未见明显肺扩张。结论:苇茎汤对AECOPD模型大鼠具有一定的改善作用;其机制可能与下调肺组织中MMP-9、TIMP-1 mRNA和RhoA、DAAM1蛋白的表达,上调肺组织中HSG蛋白的表达,从而抑制气道重建有关。
关键词 慢性阻塞性肺疾病急性加重期;苇茎汤;細胞增殖抑制基因;Wnt信号通路;大鼠
ABSTRACT OBJECTIVE: To study the improvement effects of Weijing decoction on AECOPD model rats and its possibile mechanism. METHODS:Totally 55 male SD rats were randomly divided into normal group, model group, Weijing decoction low-dose and high-dose groups (8.37, 16.74 g/kg, by crude drug),dexamethasone group (positive control group,0.09 mg/kg),with 11 rats in each group. Except for normal group, AECOPD model was induced by cigarettes combined with lipopolysaccharide in other groups. After modeling, normal group and model group were given constant volume of water intragastrically,and other groups were given relevant medicine intragastrocally,twice a day,for 14 days. After last intragastric administration, the serum level of IL-1β was determined, and pathological changes of lung tissue and bronchus were observed in each group; mRNA expression of MMP-9 and TIMP-1 genes in lung tissue were detected; protein expression of Ras homologous gene family member (RhoA),dishevelled associated activator of morphogenesis-1 (DAAM1) and hyperplasic suppress gene (HSG) in lung tissue were also determined. RESULTS: Compared with normal group, the levels of IL-1β in serum, mRNA expression of MMP-9 and TIMP-1 as well as protein expression of RhoA and DAAM1 in lung tissue were increased significantly in the model group (P<0.05), while protein expression of HSG in lung tissue was decreased significantly (P<0.05);there were many chronic inflammatory cells infiltrating around the bronchus,some airway mucosa epithelium exfoliating,alveolar compensatory dilation,pulmonary septal capillary dilation and hyperemia. Compared with model group, the levels of IL-1β in serum, mRNA expression of MMP-9 and TIMP-1 in lung tissue were decreased significantly in Weijing decoction high-dose group (P<0.05); the protein expression of RhoA and DAAM1 in lung tissue were decreased significantly in Weijing decoction low-dose and high-dose groups (P<0.05),while the protein expression of HSG in lung tissue was increased (P<0.05); the pathological changes of Weijing decoction high-dose group, such as inflammatory cells infiltrating around the bronchus and shedding of airway mucosa, were improved significantly, and there was complete alveolar epithelium structure but no obvious pulmonary dilation. CONCLUSIONS: Weijing decoction can improve AECOPD model rats to certain extent; its mechanism may be associated with down-regulating mRNA expression of MMP-9 and TIMP-1 as well as protein expression of RhoA and DAAM1 in lung tissue, up-regulating protein expression of HSG in lung tissue so as to inhibit the airway remodeling.
KEYWORDS Acute exacerbation of chronic obstructive pulmonary disease; Weijing decoction; Hyperplasic suppress gene; Wnt signaling pathway;Rat
慢性阻塞性肺疾病(COPD)是一种以肺功能障碍和持续的气流受限为特征的阻塞性肺疾病,主要症状为咳嗽和呼吸困难[1]。在COPD 病程进展中,气道重建是关键,其实质是小气道成纤维细胞的增生[2]。COPD的发生与长期吸烟和吸入灰尘、毒素等因素相关[3-4],其中长期吸烟是COPD的主要诱因,大部分COPD患者都有较长的吸烟史[5-6]。COPD分为稳定期和急性加重期(AECOPD),AECOPD患者的呼吸系统症状加重且明显高于日常水平,此时亟待调整临床治疗方案[7]。
苇茎汤出自唐代方书《外台秘要》,由苇茎、冬瓜子、薏苡仁和桃仁等4味中药材组成,具有清脏腑热、清肺化痰、逐瘀排脓的功效,主要用于治疗热毒壅肺、痰瘀互结所致的肺痈,是中医临床上常用的清肺热剂,对肺脓肿、大叶性肺炎和支气管炎等呼吸道疾病均有较好的疗效[8-10]。AECOPD以标实为主,凡是临床辨证有痰热瘀证候者即可选用苇茎汤消除脓痰[11-12]。相关研究表明,苇茎汤对AECOPD患者具有显著疗效[13-14],但其具体作用机制尚不清楚。另有研究表明,促进细胞增殖抑制基因(HSG)的高表达或抑制Wnt /平面细胞极性(PCP)信号通路的激活有可能成为抑制气道重建的突破点[2,15]。鉴于此,本研究拟建立AECOPD大鼠模型,并从HSG蛋白及Wnt/PCP信号通路角度探讨苇茎汤治疗AECOPD的分子机制,为临床用药提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有AL1240型千分之一电子天平[梅特勒-托利多仪器(上海)有限公司],BX51型光学显微镜(日本Olympus公司),BGE-140型电热鼓风干燥箱(上海博迅实业有限公司),MagNa Lyser型匀浆仪[罗氏诊断产品(上海)有限公司],ZD-85型气浴恒温振荡器(常州金坛精达仪器制造有限公司),5810R型台式高速大容量离心机(德国Eppendorf公司),1510型全波长酶标仪(美国Thermo Fisher Scientific公司),ChemiDoc MP型全能型凝胶成像系统、165-8001型垂直板电泳槽(美国Bio-Rad公司),TS-2型水平摇床(海门市其林贝尔仪器制造有限公司),塑料烟熏箱(自制,规格为120 cm×120 cm×120 cm)。
1.2 主要药品与试剂
苇茎饮片(批号2006001)购自佛山岭南中药饮片有限公司;冬瓜子饮片(批号200301)、薏苡仁饮片(批号200601)均购自广东杏林药业有限公司;桃仁饮片(批号200300831)购自普宁市康美药业股份有限公司。以上饮片由广州中医药大学第一附属医院药学部丘振文主任中药师鉴定均为真品。
醋酸地塞米松片(批号20092661,规格0.75 mg)购自新乡市常乐制药有限公司;0.9%氯化钠溶液(批号C20L032,规格10 mL ∶ 90 mg)购自山东华鲁制药有限公司;红双喜牌香烟购自上海烟草集团有限责任公司上海卷烟厂;兔源HSG、蓬乱蛋白相关形态形成活化因子(DAAM1)、Ras同源基因家族成员A(RhoA)、β-肌动蛋白(β-actin)的多克隆抗体以及辣根过氧化物酶(HRP)标记的羊抗兔免疫球蛋白G(IgG)二抗均购自美国Proteintech公司;十二烷基硫酸钠(SDS)配胶试剂盒(批号V900483)购自合肥白鲨生物科技有限公司;白细胞介素1β(IL-1β)酶联免疫吸附检测(ELISA)试剂盒(批号GR2020-09)购自武汉基因美生物科技有限公司;Trizol试剂(批号DP424)购自北京天根生化科技有限公司;逆转录试剂盒(批号DBI-2220)购自德国DBI公司;荧光定量聚合酶链式反应(PCR)检测试剂盒(批号AOPR- 1200)购自上海基点生物科技有限公司;脂多糖(批号20200106)購自广州欣励和生物科技有限公司;BCA蛋白定量试剂盒(批号FD2001)购自杭州弗德生物有限公司;水为蒸馏水。
1.3 动物
本研究所用动物为健康SPF级雄性SD大鼠,4周龄,体质量为(100±10) g,购自广东省医学实验动物中心,实验动物生产许可证号为SCXK(粤)2018-0002,实验动物使用许可证号为SYXK(粤)2018-0092。大鼠购入后饲养于广州中医药大学第一附属医院SPF级动物实验中心,饲养环境的昼夜节律为12 h/12 h、温度为(24±2) ℃、相对湿度为55%~68%,饲养期间大鼠自由进食、饮水。本实验严格遵守实验动物福利伦理原则,实验方案通过广州中医药大学第一附属医院实验动物伦理委员会审核(伦理审查编号为TCMF1-2020013)。
2 方法与结果
2.1 苇茎汤煎液的制备
取苇茎30 g、薏苡仁30 g、冬瓜子24 g、桃仁9 g,加10倍量(mL/g,下同)水浸泡1 h,然后再煎煮1 h,收集煎液;药渣再次加8倍量水煎煮0.5 h,收集煎液;合并2次煎液,浓缩制备成含生药量分别为8.37、16.74 g/kg的药液。
2.2 动物分组、造模与给药
将55只大鼠先适应性喂养7 d,然后按随机数字表法随机分为正常组,模型组,苇茎汤低、高剂量组(8.37、16.74 g/kg,以生药量计,分别为1、2倍临床等效剂量),地塞米松组(阳性对照组,0.09 mg/kg)[16],每组11只。除正常组外,其余各组大鼠均采用香烟联合脂多糖诱导的方法复制AECOPD模型[17-18]:烟熏箱用棉被堵住缝隙,每次熏烟20支,大鼠每天吸烟2次,每次持续1 h;分别于烟熏的第7、14、21天,于大鼠气管注射脂多糖1 mg/kg(注射脂多糖当天不进行烟熏),造模共持续8周。正常组大鼠于实验第7、14、21天气管注射等量0.9%氯化钠溶液。造模结束后,每组各取1只大鼠进行病理切片检查:若造模大鼠的支气管周围出现较多慢性炎症细胞浸润、部分气道黏膜上皮脱落,肺组织出现肺泡代偿性扩张、肺泡壁变薄断裂、肺大泡形成以及肺间隔毛细血管扩张、充血等现象,则表明AECOPD模型建立成功[18]。确定造模成功后,正常组和模型组大鼠灌胃水(10 mL/kg),其余各组大鼠灌胃相应药物(10 mL/kg),每天灌胃2次(9:00和15:00各1次),连续灌胃14 d。
2.3 一般情况观察
实验期间观察大鼠的一般情况,包括大鼠的活动、精神状况、毛发光泽度、体质量变化等。
2.4 取材及处理
末次灌胃2 h后,以5%戊巴比妥钠(30 mg/kg)腹腔注射麻醉大鼠,于腹主动脉采血。将血液静置2 h,然后在4 ℃下以3 500 r/min离心10 min,收集血清,置于-80 ℃冰箱中保存,备用。采血后,立即处死并解剖大鼠,取其右肺组织和右支气管,用生理盐水清洗干净;将一部分肺组织和支气管固定在10%甲醛溶液中,将另一部分肺组织冻存于-80 ℃冰箱中。
2.5 血清中IL-1β水平测定
取“2.4”项下冻存的大鼠血清样品,常规解冻后,采用ELISA法检测血清中IL-1β水平。具体操作严格按照相应试剂盒说明书方法进行,采用酶标仪进行测定。
2.6 肺组织和支气管的病理形态学观察
取10%甲醛溶液中固定24 h以上的大鼠肺组织和支气管,常规制作石蜡切片(厚度均为3 μm)后,行常规苏木精-伊红(HE)染色,然后通过显微镜观察肺组织和支气管的病理形态学变化。
2.7 肺组织中基质金属蛋白酶9(MMP-9)、基质金属蛋白酶抑制剂1(TIMP-1) mRNA表达水平测定
采用荧光定量PCR法进行测定。取“2.4”项下冻存的大鼠肺组织,常规解冻后,采用Trizol法提取组织中总RNA;检测总RNA的浓度和纯度后,按照逆转录试剂盒说明书方法操作将其逆转录为cDNA,并以cDNA为模板进行PCR扩增。PCR反应条件为:95 ℃预变性10 min;95 ℃变性 10 s,55 ℃延伸20 s,共40个循环。反应体系(总体积为20.0 μL)包括:2× All-in-One qPCR Mix 10.0 μL,上、下游引物(2 μmol/L) 各2.0 μL,cDNA模板2.0 μL,50×Rox Reference Dye 0.4 μL,ddH2O 3.6 μL。以GAPDH为内参,采用2-ΔΔCt法计算肺组织中MMP-9、TIMP-1 mRNA表达水平。PCR引物由广州四和生物科技股份有限公司设计并合成,引物序列及扩增产物长度见表1。
2.8 肺组织中RhoA、DAAM1、HSG蛋白表达水平测定
采用Western blot法进行测定,每组选取3只大鼠的样本进行实验。取“2.4”项下冻存的大鼠肺组织,常规解冻后,加入含有蛋白酶抑制剂的蛋白裂解液提取组织中总蛋白,按照BCA试剂盒方法测定总蛋白的浓度后,以95 ℃加热10 min使蛋白变性。取变性后总蛋白40 μg行SDS-聚丙烯酰胺凝胶电泳(浓缩胶电压75 V,分离胶电压120 V,电泳时间60 min),电泳结束后湿法转移(电流200 mA,转膜时间1 h)至聚偏二氟乙烯膜;用5%脱脂牛奶(以0.5%TBST制备)封闭液封闭20 min后,加入TBST洗膜3次、每次5 min;分别加入RhoA一抗(稀释比例为1 ∶ 1 000)、DAAM1一抗(稀释比例为1 ∶ 5 000)、HSG一抗(稀释比例为1 ∶ 1 000)以及内参β-actin一抗(稀释比例为1 ∶ 5 000),4 ℃孵育过夜;TBST洗膜3次、每次5 min,加入HRP标记的IgG二抗(稀释比例均为 1 ∶ 2 000),室温孵育1 h;滴加ECL发光液,曝光,采用显影、定影试剂进行显影。采用Image J 1.8.0软件分析各蛋白条带的灰度值,以目的蛋白条带与内参β-actin蛋白条带灰度值的比值表示目的蛋白的表达水平。
2.9 统计学方法
采用SPSS 21.0软件进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
3.1 一般情况观察结果
自造模第17天起,各造模组大鼠的毛发开始出现光泽黯淡、油腻等现象,且伴有轻微的弓背扎堆和眯眼症状;自造模第30天起,各造模组大鼠的反应开始变得迟钝,饲料消耗速度开始减慢;自造模第8周起,上述症状均加重,但无其他新的异常表现。正常组大鼠在整个造模期间均反应敏捷、毛发正常。灌胃给药结束后,苇茎汤高剂量组和地塞米松组大鼠的毛发光泽度、弓背扎堆等症状均有明显改善,但苇茎汤低剂量组大鼠上述症状改善不明显。
3.2 血清中IL-1β水平测定结果
与正常组[(43.46±3.10) ng/mL]比较,模型组大鼠血清中IL-1β水平[(51.77±10.34) ng/mL]显著升高(P<0.05)。与模型组比较,苇茎汤高剂量组和地塞米松组大鼠血清中IL-1β水平[(44.06±2.20)、(47.65±6.46) ng/mL]均显著降低(P<0.05),苇茎汤低剂量组大鼠血清中IL-1β水平[(48.29±4.88) ng/mL]差异无统计学意义(P>0.05)。
3.3 肺组织和支气管病理形态学观察结果
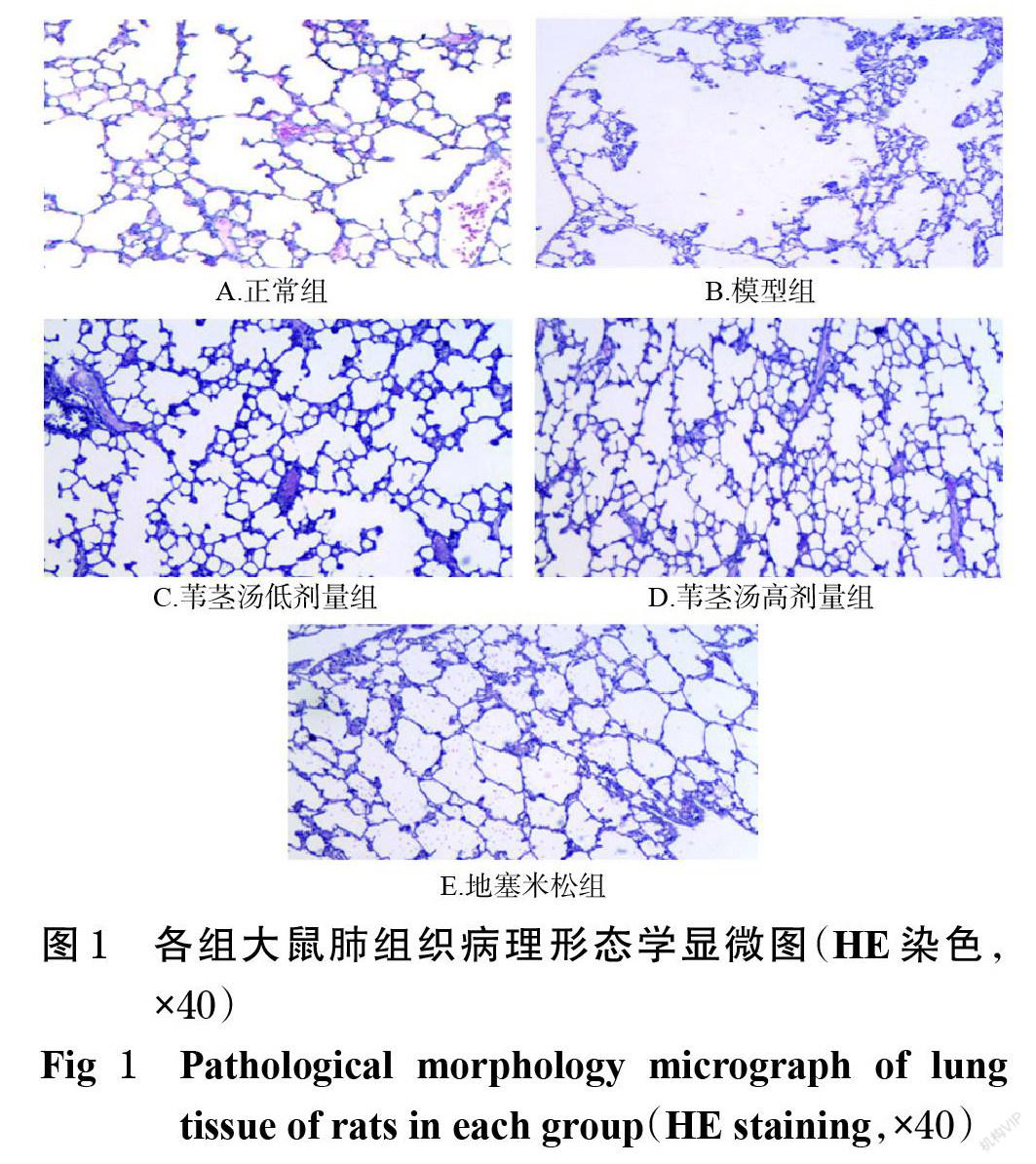
3.3.1 肺組织 正常组大鼠肺泡上皮结构完整,未见肺扩张。与正常组比较,模型组大鼠肺泡管囊状扩张,肺泡膨大,肺泡壁变薄、断裂并融合成为肺大泡。苇茎汤低剂量组大鼠肺泡管部分呈囊性扩张,部分肺泡膨大、肺泡壁变薄。苇茎汤高剂量组和地塞米松组大鼠肺泡上皮结构较完整,未见明显肺扩张。各组大鼠肺组织病理形态学显微图见图1。
3.3.2 支气管 正常组大鼠支气管黏膜上皮未见脱落,纤毛排列整齐,管壁周围未见炎症细胞。与正常组比较,模型组大鼠气管黏膜上皮部分脱落,管壁有以淋巴细胞、浆细胞为主的炎症细胞浸润;支气管黏膜皱壁显著增多、变长,突入管腔;小动脉血管平滑肌显著增生,管腔明显狭窄;终末细支气管远端狭窄。苇茎汤低剂量组大鼠气管黏膜上皮部分脱落,管壁可见少量以淋巴细胞、浆细胞为主的炎症细胞浸润;支气管黏膜皱壁轻度增多、变长,突入管腔;呼吸性细支气管及肺泡管部分呈囊性扩张。苇茎汤高剂量组和地塞米松组大鼠气管黏膜上皮未见明显脱落,纤毛排列较整齐,管壁周围未见明显炎症细胞浸润。各组大鼠支气管病理形态学显微图见图2。
3.4 肺组织中MMP-9、TIMP-1 mRNA表达水平测定结果
与正常组比较,模型组大鼠肺组织中MMP-9、TIMP-1 mRNA表达水平均显著升高(P<0.05)。与模型组比较,苇茎汤高剂量组和地塞米松组大鼠肺组织中MMP-9、TIMP-1 mRNA表达水平均显著降低(P<0.05)。各组大鼠肺组织中MMP-9、TIMP-1 mRNA表达水平测定结果见表2。
3.5 肺组织中RhoA、DAAM1、HSG蛋白表达水平测定结果
与正常组比较,模型组大鼠肺组织中RhoA、DAAM1蛋白表达水平均显著升高(P<0.05),HSG蛋白表达水平显著降低(P<0.05)。与模型组比较,苇茎汤低、高剂量组和地塞米松组大鼠肺组织中RhoA、DAAM1蛋白表达水平均显著降低(P<0.05),HSG蛋白表达水平均显著升高(P<0.05)。各组大鼠肺组织中RhoA、DAAM1、HSG蛋白表达的电泳图见图3,蛋白表达水平测定结果见表3。
4 讨论
COPD通常与肺部的炎症反应相关,其病理變化包括慢性支气管炎、气道重建、肺动脉重建、肺气肿等[19]。目前主要是采用抗炎、平喘、化痰等方法对AECOPD进行治疗。因地塞米松对AECOPD具有较好的治疗效果[20-21],因此本研究以其作为阳性对照药物。
AECOPD的发病与各种细胞因子介导的肺部炎症反应密切相关。IL-1β为重要炎症细胞因子,血清中IL-1β水平的变化对临床判断AECOPD的发生和预后具有重要作用[22]。本研究结果显示,高剂量苇茎汤可显著降低AECOPD模型大鼠血清中IL-1β水平,并可减少其支气管黏膜上皮脱落、支气管周围炎症细胞浸润和肺大泡数量。以上结果表明,高剂量苇茎汤可通过降低机体的炎症水平从而对AECOPD起到一定的改善作用。
相关研究显示,MMP-9在COPD患者血清中表达上调,其可能参与并影响了COPD的病情进展[23]。MMP-9主要是通过破坏肺泡的基质成分,使肺泡腔扩大、肺泡弹性回缩能力减弱,从而导致气流滞留,引发肺气肿;此外,MMP-9还可通过介导炎症细胞聚集,破坏上皮和内皮结构,从而参与气道的炎症反应和组织重建[24]。金属蛋白酶组织抑制剂(TIMPs)能抑制MMPs的活性,且其中以TIMP-1的活性最强[25]。相关研究表明,血清中MMP-9、TIMP-1水平高低与COPD病情的严重程度相关,血清中MMP-9、TIMP-1水平越高表明COPD的病情越重[24]。本研究结果显示,高剂量苇茎汤可显著降低AECOPD模型大鼠肺组织中MMP-9、TIMP-1 mRNA表达水平,这说明苇茎汤可通过下调肺组织中MMP-9、TIMP-1 mRNA的表达从而对AECOPD起到一定的改善作用。
赵克蝉等[26]在关于HSG与COPD中医证型相关性的研究中发现,HSG在AECOPD患者血液中呈低表达,在正常患者血液中呈高表达;并认为HSG的高表达可能影响了气道重建,与AECOPD病程可能存在着内在关联。气道重建的病理改变过程和肺血管重建极为相似,其中平滑肌细胞的收缩、增殖和凋亡都是气道重建形成的主要原因[27]。相关研究表明,RhoA、DAAM1是Wnt/PCP信号通路中2个关键信号蛋白[19]。其中,RhoA主要通过调控微丝的重组来参与细胞的增殖、迁移和凋亡等过程[28],进而影响气道重建。DAAM l是形成素蛋白家族的一个成员,具有形成素蛋白家族的性质,是Wnt/PCP信号通路核心成员之一;其可通过激活RhoA、细胞分裂周期因子42等来调节细胞的收缩、增殖等功能,进而影响气道重建[19,29]。本研究结果显示,低、高剂量的苇茎汤均可显著上调AECOPD模型大鼠肺组织中HSG蛋白的表达,下调肺组织中RhoA和DAAM1蛋白的表达,这提示苇茎汤可在一定程度上抑制AECOPD模型大鼠的气道重建。
综上所述,苇茎汤对AECOPD模型大鼠具有一定的改善作用;其机制可能与下调肺组织中MMP-9、TIMP-1 mRNA和RhoA、DAAM1蛋白的表达,上调肺组织中HSG蛋白的表达,从而抑制气道重建有关。
参考文献
[ 1 ] MACLNTYRE N R.Accurately diagnosing COPD:a clinical challenge with important consequences[J]. Respir Care,2021,66(1):173-174.
[ 2 ] 张军,葛正行,杨义.细胞增殖抑制基因调控慢性阻塞性肺疾病大鼠Wnt/PCP通路抑制气道成纤维细胞增殖[J].基础医学与临床,2019,39(10):1393-1396.
[ 3 ] RABE K F,WATZ H. Chronic obstructive pulmonary di- sease[J]. Lancet,2017,389(10082):1931-1940.
[ 4 ] BRANDSMA C A,VAN DEN BERGE M,HACKETT T L,et al. Recent advances in chronic obstructive pulmonary disease pathogenesis:from disease mechanisms to precision medicine[J]. J Pathol,2020,250(5):624-635.
[ 5 ] CHEN Z,YAN Q,ZHANG Z,et al. Immunomodulatory effects of hydrolyzed seawater pearl tablet (HSPT) on Th1/Th2 Functionality in a mice model of chronic obstructive pulmonary disease (COPD) induced by cigarette smoke[J]. eCAM,2020,2020:5931652.
[ 6 ] NAKAMURA N. Cigarette smoke attenuates p300-media- ted Nrf2 acetylation in macrophages:is stabilizing Nrf2 enough to halt COPD progression? [J]. Respirology,2021,26(1):19-20.
[ 7 ] 张晓琴.急性生理学及慢性健康状况评价系统Ⅱ评分与慢性阻塞性肺疾病和支气管哮喘生理评分对慢性阻塞性肺疾病并Ⅱ型呼吸衰竭患者预后的预测价值分析[J]. 实用心脑肺血管病杂质,2016,24(12):84-87.
[ 8 ] 林山寨.千金苇茎汤加减治疗老年慢性阻塞性肺疾病的疗效[J].医学理论与实践,2020,33(20):3382-3384.
[ 9 ] 刘子云,谢东,周刚.千金苇茎汤加减方辅助治疗支气管扩张症效果及对中医临床症状、肺功能和炎性因子改善情况[J].解放军医药杂志,2020,32(10):70-74.
[10] 何梦,陶克龙,沈巨信,等.千金苇茎汤对肺癌术后患者的影响[J].浙江创伤外科,2020,25(4):687-689.
[11] 刘建博,荆小莉,刘小虹.加味千金苇茎汤对慢性阻塞性肺病急性加重期患者气道清除功能的影响[J].广州中医药大学学报,2006,23(1):21-24.
[12] 李树强.加味苇茎汤治疗COPD急性发作期的临床疗效观察及对外周血TNF-α、IL-8的影响[J].医学信息,2009,22(12):2728-2731.
[13] 郭岩岩.苇茎汤配合西药治疗慢性阻塞性肺气肿急性期临床观察[J].河北中医,2010,32(11):1680-1681.
[14] 詹少锋.加味苇茎汤治疗慢性阻塞性肺疾病急性发作期临床研究[J].中华中医药学刊,2008,26(12):2735-2737.
[15] 袁霞. Wnt信号通路在慢性阻塞性肺疾病大鼠气道重建中调控作用及苗药紫金牛、铁掃帚干预研究[D].贵阳:贵阳中医学院,2014.
[16] 薛晓明,王洋,赵勤萍,等.宣肺平喘胶囊对慢性阻塞性肺疾病大鼠模型的影响[J].中国实验方剂学杂志,2017,23(2):120-125.
[17] 王玮,王琦,张永生,等.香烟联合脂多糖建立慢性阻塞性肺疾病大鼠模型[J].中华中医药杂志,2018,33(9):3866-3871.
[18] 许光兰,赵媚,钟云青,等.清金化痰颗粒对COPD急性期(痰热郁肺型)大鼠肺组织STAT1,STAT3的调控作用[J].中国实验方剂学杂志,2017,23(2):91-97.
[19] 张军. HSG基因调控COPD大鼠气道Wnt/PCP信号通路及RhoA基因与COPD急性加重期中医证型的相关性研究[D].贵阳:贵阳中医学院,2016.
[20] 李洪.地塞米松、红霉素对慢性阻塞性肺疾病大鼠CD4+CD25+调节T细胞的影响[D].南宁:广西医科大学,2005.
[21] 张炎,刘东海.慢性阻塞性肺疾病急性加重期应用糖皮质激素体会[J].疾病监测与控制杂志,2009,3(9):555.
[22] 范春红.慢性阻塞性肺疾病急性加重期血清IFN-γ、IL- 32、IL-1β的浓度变化及临床意义[D].广州:广州医学院,2011.
[23] 王艳,史玉红,李圣,等.沙美特罗联合噻托溴铵对慢性阻塞性肺疾病患者血清MMP?2,MMP?9及IL?8水平的影响[J].现代生物医学进展,2017,17(1):145-147.
[24] 林松娟,刘美娟,季泰令,等.慢性阻塞性肺疾病急性加重期血清 MMP-9、TIMP-1变化的临床意义[J].山东医药,2011,51(45):23-24.
[25] YADAV R K,GUPTA S P,SHARMA P K,et al. Recent advances in studies on hydroxamates as matrix metalloproteinase inhibitors:a review[J]. Curr Med Chem,2011,18(11):1704-1722.
[26] 赵克蝉,葛正行,李霄.细胞增殖抑制基因 HSG与COPD中医证型的相关性[J].中国实验方剂学杂志,2016,22(11):152-155.
[27] 黄鹤. COPD患者血清Rho激酶水平测定的临床意义及参七化痰方对COPD模型大鼠肺组织Bax、Bcl-2、RhoA mRNA、RockⅠ/Ⅱ mRNA表达的影响[D].合肥:安徽中医药大学,2017.
[28] DAVID M,PETIT D,BERTOGLIO J. Cell cycle regulation of Rho signaling pathways[J]. Cell Cycle,2012,11(16):3003-3010.
[29] KIKUCHI A,YAMAMOTO H,KISHIDA S. Multiplicity of the interactions of Wnt proteins and their receptors[J].Cell Signal,2007,19(4):659-671.
(收稿日期:2021-05-27 修回日期:2021-09-15)
(编辑:林 静)
