红柄白鹃梅叶醇提物对糖尿病小鼠胰腺氧化应激的影响
2021-11-24彭华强蔡金玲梁文彬
彭华强,蔡金玲,梁文彬
(梧州市中医医院,广西 梧州 543000)
随着社会和经济的发展,全球的生活模式及饮食习惯已逐渐改变。我国的饮食习惯和生活方式已向高脂高糖饮食和轻型体力劳动模式转变,而这种转变使糖尿病患者数量急剧增加。目前,全球糖尿病患者已达到4.22亿,我国则是糖尿病患者最多的国家,且发病率逐年增长,并有年轻化的趋势[1-2]。糖尿病是一种胰岛素分泌功能障碍的代谢性疾病,目前对糖尿病的治疗手段以调控血糖为主,但无法进行根治,这也意味着糖尿病患者需终身接受治疗[3]。对普通家庭来说,糖尿病的治疗严重增加了家庭的负担,且影响患者的生存质量。故积极探索治疗糖尿病的药物,对于糖尿病的防治具有重要意义。红柄白鹃梅叶为蔷薇科白鹃梅属落叶灌木红柄白鹃梅(Exochorda giraldii Hesse)的干燥叶子,性味甘平,归肝、肾经,其根皮、树皮、叶子通常作为入药部位,具有通络止痛、清热解毒的功效,同时具有清除氧自由基的作用[4]。本课题组前期的预实验发现红柄白鹃梅叶醇提物具有调控糖尿病小鼠血糖的作用,但其降糖机制有待探究。故本研究以糖尿病小鼠为模型,探讨红柄白鹃梅叶醇提物对糖尿病小鼠胰腺氧化应激损伤的影响。
1 材料与方法
1.1 实验动物 4周龄SPF级雄性昆明种小鼠60只,体质量18~22 g,购自广西医科大学实验动物中心,生产许可证号:SCXK(桂)2019-0005。小鼠饲养于通风良好的环境,室温保持于18~25 ℃,相对湿度40%~70%,12 h/12 h光照昼夜循环。本研究严格按动物伦理要求进行实验。
1.2 药物与试剂 红柄白鹃梅叶购自玉林药材市场,由广西医科大学药学院朱丹教授鉴定为红柄白鹃梅(Exochorda giraldii Hesse)的干燥叶子。红柄白鹃梅叶醇提物由本实验室采用70%乙醇溶液,料液比为1 g∶30 mL,在50 ℃温度下回流提取2 h,过滤,收集滤液。重复提取3次,合并滤液,用HPDBJQH型大孔树脂,以70%乙醇洗脱后所得。盐酸二甲双胍片(中美上海施贵宝制药,批号:AAL7603);链脲佐菌素(STZ)(美国Sigma公司,批号:SLBB8324V);ROS试剂盒(上海杰美基因医药科技有限公司,批号:20191015);超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所,批号:20191112)、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物工程研究所,批号:20191114);氧化氢酶(CAT)试剂盒(上海杰美基因医药科技有限公司,批号:20191107);小鼠空腹胰岛素(FINS)ELISA试剂盒(江莱生物,批号:JL19252)。
1.3 主要仪器 DDL-5型高速冷冻离心机(上海安亭科学仪器厂);罗氏卓越型血糖仪(ACCU-CHEK Performa);MPI-B型化学反应发光多功能检测器(西安瑞迈公司);9602A-酶标仪(北京艾普生物设备有限公司)。
1.4 造模及分组 随机取50只昆明种雄性小鼠,实验前禁食不禁水12 h,尾静脉注射用4 ℃的枸橼酸缓冲液(pH=7.4)所溶解的STZ(50 mg/kg),1次/d,连续注射3 d,注射后予高脂高糖饲料喂养42 d。末次注射后42 d血糖仪检测小鼠空腹血糖(FBG),以FBG≥11.1 mmol/L的小鼠为糖尿病模型[4-5]。将造模成功的48只糖尿病模型小鼠随机分为模型组、二甲双胍组、红柄白鹃梅叶醇提物高剂量组、红柄白鹃梅叶醇提物低剂量组,每组10只;2只造模失败小鼠及未能随机入组的8只糖尿病小鼠排除入组。另取10只健康昆明种雄性小鼠作为正常对照组。
1.5 实验给药 二甲双胍组小鼠灌胃给予二甲双胍生理盐水混悬液,32 mg/kg;红柄白鹃梅叶醇提物高、低剂量组小鼠分别灌胃予高、低剂量红柄白鹃梅叶醇提物生理盐水混悬液,剂量分别为150、75 mg/kg;正常对照组和模型组小鼠灌胃等体积生理盐水,1次/d,连续灌胃4周。
1.6 观察指标
1.6.1 血糖、血清胰岛素含量测定[6]末次给药2 h后,取小鼠尾部末梢血,血糖仪检测血糖。摘眼球取血,离心分离血清,酶联免疫法(ELISA)检测血清中胰岛素(FINS)含量,按公式计算胰岛素敏感指数(ISI)和胰岛素抵抗指数(IRI)。ISI=ln(1/FBG×FINS);IRI=FBG×FINS/22.5。
1.6.2 胰腺组织病理学观察 取血后,颈椎脱臼处死小鼠,钝性分离胰腺,切取部分胰腺组织置于10%甲醛固定液中,制蜡块,病理切片,HE染色,观察胰腺病理学变化。
1.6.3 胰腺组织中氧化应激因子含量测定 切取部分胰腺组织,充分碾磨并经RIPA裂解液裂解后,3 500 r/min、4 ℃的高速低温条件下离心10 min,吸取上清液。ELISA试剂盒检测胰腺组织中氧化应激因子谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)的活性。
1.6.4 胰腺组织中活性氧(ROS)含量测定 采用鲁米诺化学发光法测定胰腺组织中ROS水平。切取部分胰腺组织,制备成10%的组织匀浆,稀释于pH值为7.4的Krebs-Hepes缓冲液中。加辣根过氧化物酶对其进行催化反应。使用MPI-B型多参数化学发光检测仪对催化反应溶液进行发光检测,溶液发光后加入0.1 mL鲁米诺(5 mmol/L)。Origin软件统计发光峰面积,计算发光强度表示ROS水平的高低。
1.7 统计学方法 采用SPSS 18.0软件进行统计学分析,计量资料以“均数±标准差”()表示。多组间比较采用单因素方差分析,若方差齐性,进一步采用Bonferroni法进行两两比较;若方差不齐,采用Kruska-WallisH秩和检验;P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠给药前后FBG比较 给药前,模型组、二甲双胍组、红柄白鹃梅叶醇提物高剂量组、红柄白鹃梅叶醇提物低剂量组小鼠FBG均明显高于正常对照组(P<0.05),证明造模成功。给药后,与正常对照组比较,模型组小鼠FBG明显升高(P<0.05);与模型组比较,二甲双胍组和红柄白鹃梅叶醇提物高、低剂量组小鼠FBG均明显降低(P<0.05);与二甲双胍组比较,红柄白鹃梅叶醇提物高、低剂量组小鼠FBG均升高(P<0.05),且红柄白鹃梅叶醇提物低剂量组小鼠FBG高于红柄白鹃梅叶醇提物高剂量组(P<0.05)。(见表1)
表1 各组小鼠给药前后FBG 比较(,mmol/L)
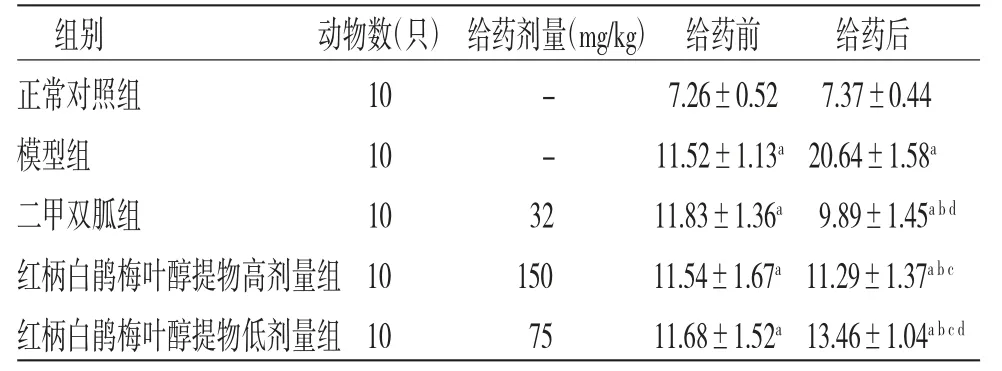
表1 各组小鼠给药前后FBG 比较(,mmol/L)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与红柄白鹃梅叶醇提物高剂量组比较,dP<0.05
2.2 各组小鼠胰腺组织病理学改变情况 正常对照组小鼠胰腺组织细胞完整、胰岛数量丰富,大小均匀;模型组小鼠胰岛排列紊乱且分布较散,其大小不一,皱缩变形,有大量空泡出现及炎症细胞浸润;二甲双胍组小鼠胰岛形状有所恢复,数量较模型组多,存在少量空泡及炎症细胞浸润;红柄白鹃梅叶醇提物高剂量组小鼠胰岛细胞皱缩得到明显改善,空泡数量少于模型组;红柄白鹃梅叶醇提物低剂量组小鼠胰岛细胞形状较紊乱,有明显皱缩现象,存在较多的空泡和炎症细胞浸润。(见图1)
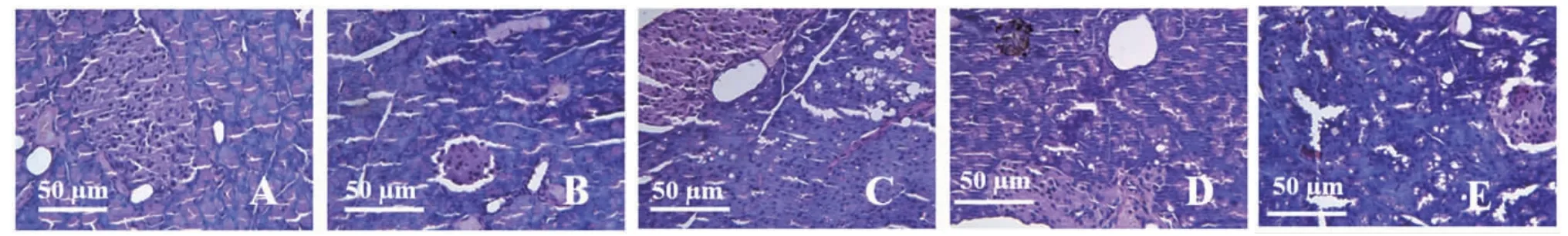
图1 各组小鼠胰腺的病理学改变情况(HE,×400)
2.3 各组小鼠FINS、ISI、IRI比较 与正常对照组比较,模型组小鼠FINS和ISI均降低,IRI升高(P<0.05);与模型组比较,二甲双胍组和红柄白鹃梅叶醇提物高、低剂量组小鼠FINS和ISI均升高,IRI均降低(P<0.05);与二甲双胍组比较,红柄白鹃梅叶醇提物高、低剂量组小鼠FINS和红柄白鹃梅叶醇提物低剂量组小鼠IRI均降低(P<0.05),而红柄白鹃梅叶醇提物高、低剂量组小鼠ISI与二甲双胍组比较,差异无统计学意义(P>0.05);红柄白鹃梅叶醇提物低剂量组小鼠FINS、ISI、IRI均低于红柄白鹃梅叶醇提物高剂量组(P<0.05)。(见表2)
表2 各组小鼠FINS、ISI、IRI 比较()
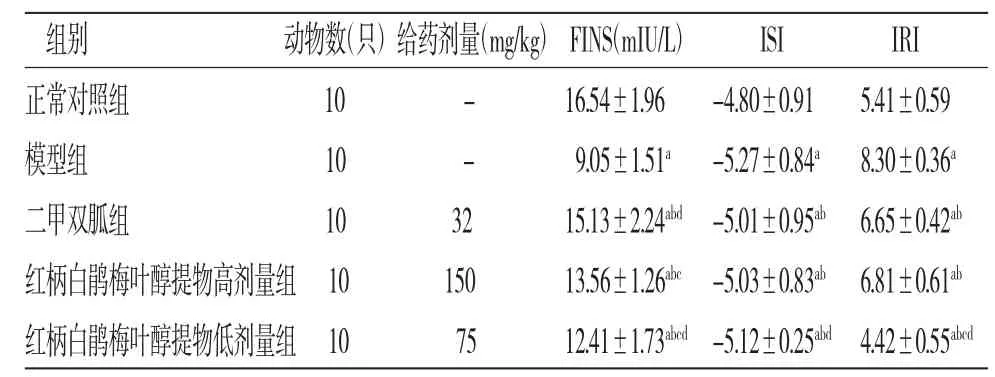
表2 各组小鼠FINS、ISI、IRI 比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与红柄白鹃梅叶醇提物高剂量组比较,dP<0.05
2.4 各组小鼠胰腺中氧化应激因子活性比较 与正常对照组比较,模型组小鼠胰腺中SOD、CAT、GSH-Px的活性均明显降低(P<0.05);与模型组比较,二甲双胍组和红柄白鹃梅叶醇提物高、低剂量组小鼠胰腺中SOD、CAT、GSH-Px的活性均升高(P<0.05);与二甲双胍组比较,红柄白鹃梅叶醇提物低剂量组小鼠胰腺中SOD、CAT、GSH-Px的活性和红柄白鹃梅叶醇提物高剂量组小鼠胰腺中SOD、CAT的活性均降低(P<0.05),而红柄白鹃梅叶醇提物高剂量组小鼠胰腺中GSH-Px的活性与二甲双胍组比较,差异无统计学意义(P>0.05);红柄白鹃梅叶醇提物高剂量组小鼠胰腺中SOD、GSH-Px的活性高于红柄白鹃梅叶醇提物低剂量组(P<0.05),而CAT的活性与红柄白鹃梅叶醇提物低剂量组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组小鼠胰腺中氧化应激因子活性比较(,U/mg)
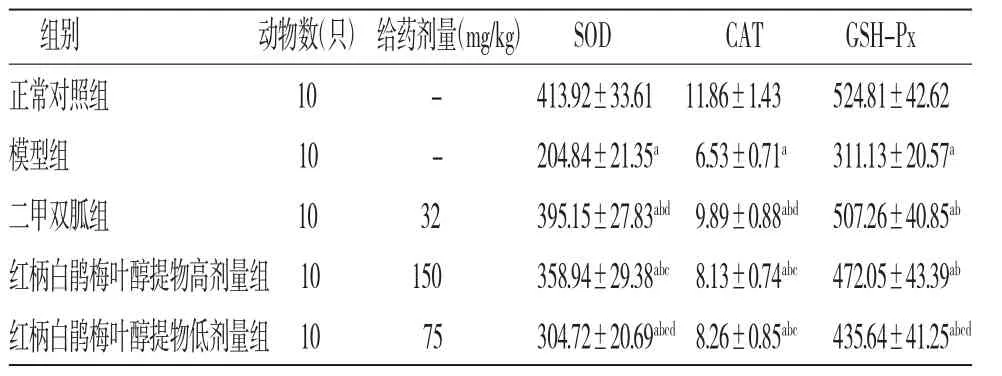
表3 各组小鼠胰腺中氧化应激因子活性比较(,U/mg)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与红柄白鹃梅叶醇提物高剂量组比较,dP<0.05
2.5 各组小鼠胰腺中ROS含量比较 与正常对照组比较,模型组小鼠胰腺中ROS含量明显升高(P<0.05);与模型组比较,二甲双胍组和红柄白鹃梅叶醇提物高、低剂量组小鼠胰腺中ROS含量均明显降低(P<0.05);红柄白鹃梅叶醇提物低剂量组小鼠胰腺中ROS含量高于二甲双胍组和红柄白鹃梅叶醇提物高剂量组(P<0.05);红柄白鹃梅叶醇提物高剂量组小鼠胰腺中ROS含量与二甲双胍组比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组小鼠胰腺中ROS 含量比较(,nmol/mg)

表4 各组小鼠胰腺中ROS 含量比较(,nmol/mg)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与二甲双胍组比较,cP<0.05;与红柄白鹃梅叶醇提物高剂量组比较,dP<0.05
3 讨 论
糖尿病的发病、发展及其并发症的出现与氧化应激的损伤作用有着密切的关系。持续的高糖内环境,可激活糖自氧化、多元醇代谢等反应及蛋白激酶C的活性增加,降低自身抗氧化能力,促使ROS的产生,造成机体氧化应激,氧化损伤多种蛋白分子,破坏细胞的正常功能和完整性,影响糖尿病及其并发症的发生[7-8]。糖尿病发病初期,持续的高血糖会使25%~50%的胰岛β细胞受损,随着病程的发展,β细胞受损数量会持续增加,甚至会完全丧失生理功能[9]。因此,缓解机体氧化应激状态,保护胰岛β细胞功能是预防或治疗糖尿病的关键。
糖尿病发病的基础是机体外周组织如肌肉和脂肪的胰岛素抵抗和其β细胞胰岛素分泌缺陷。而胰岛素抵抗程度、胰腺损伤和β细胞数量减少与ROS的异常有着密切的关系。正常情况下,胰岛素和胰岛素受体结合后会将信号向下游传递,正常作用于骨骼肌、肝脏和脂肪。而在ROS异常大量形成的情况下,会阻碍胰岛素受体底物1的磷酸化进程,降低胰岛素受体底物1与胰岛素受体的结合能力,影响胰岛素信号传导而引起IR的发生[10-12]。同时机体在氧化还原状态失衡时,ROS会影响葡萄糖转运体的正常转录,导致胰岛素抵抗发生[13]。本研究结果显示,红柄白鹃梅叶醇提物能降低糖尿病小鼠FBG和IRI,升高FINS、ISI,提示红柄白鹃梅叶醇提物有调节糖尿病模型小鼠血糖代谢紊乱的作用。
糖尿病病理状态下,胰岛β细胞中的GSH-Px、SOD、CAT等抗氧化酶活性低下,未能有效清除因高糖而产生的过量ROS和脂质过氧化产物,造成大量ROS及脂质过氧化产物在胰腺组织中的堆积,形成氧化应激反应,破坏胰腺组织线粒体内外膜的结构,影响线粒体能量代谢,进而抑制β细胞胰岛素的合成和分泌[14-15]。本研究结果显示,红柄白鹃梅叶醇提物能增加胰腺组织中CAT、SOD、GSH-Px的活性,减少胰腺组织中ROS的含量,提示红柄白鹃梅叶醇提物可减少胰腺中ROS的含量,改善机体氧化应激水平。
综上所述,红柄白鹃梅叶醇提物具有调节血糖、改善胰岛素抵抗的作用,其作用机理可能与其提高机体中抗氧化因子的活性,减少ROS的含量,以及调节机体氧化应激水平有关。
