黄芪甲苷通过RhoA/ROCK2通路对脑膜炎大鼠皮质神经元的保护作用
2021-11-24安喆妮
于 倩,安喆妮
(湖南省儿童医院,湖南 长沙 410007)
细菌性脑膜炎(bacterial meningitis,BM)多发于新生儿期,是由不同病原菌引起的中枢神经系统感染性疾病[1]。B族溶血性链球菌(group B hemolytic strepto coccus,GBS)是引起新生儿脑水肿、血脑屏障损伤、神经系统损伤及死亡的主要致病菌[2]。RAS同源基因家族成员A(RAS homologous gene family member A,RhoA)/Rho相关螺旋卷曲蛋白激酶2(Rhorelated spiral coiled protein kinase 2,ROCK2)通路可抑制神经元内信号转入、收敛细胞骨架网络、抑制轴突生长,从而参与神经元突起的延长和再生过程[3],且抑制RhoA/ROCK2通路对神经有保护作用[4]。但RhoA/ROCK2通路在BM神经系统损伤中的调控作用,还未见报道。黄芪甲苷是中药黄芪中的主要活性成分之一,现代药理研究发现黄芪甲苷能显著抑制中枢神经系统炎症损伤,并能够通过调控mTOR、炎症、氧化应激、线粒体自噬等多种途径,来抑制神经元凋亡、促进神经元再生及修复,并发挥神经保护作用[5]。但黄芪甲苷是否对BM引起的神经损伤有保护作用,还未见报道。本研究拟建立大鼠BM模型,对此进行验证,并探究其发挥神经保护作用是否与RhoA/ROCK途径有关,以期为黄芪甲苷的开发应用及BM的临床治疗提供实验依据。
1 材料和方法
1.1 实验动物 3周龄健康SPF级SD新生大鼠100只,体质量约50 g,雌雄不限,购自福州海王福药制药有限公司,生产许可证号:SCXK(闽)2020-0001,动物使用许可证号:SYXK(闽)2020-0006。所有大鼠于本院动物房中常规饲养,饲养条件:室温(23±2)℃,湿度(55±10)%,自然光照。本实验经本院动物伦理委员会批准同意,符合3R原则。
1.2 药物与试剂 黄芪甲苷钠标准品(上海宝曼生物科技有限公司,批号:20190413);肿瘤坏死因子(TNF-α)酶联免疫吸附(ELISA)试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:20190303);神经元特异性烯醇化酶(NSE)ELISA试剂盒(北京百奥莱博科技有限公司,批号:20190403);降钙素原(PCT)ELISA试剂盒(上海抚生实业有限公司,批号:20190523);兔抗大鼠RhoA抗体(美国abcam公司,货号:ab187027);ROCK抗体(美国abcam公司,货号:ab134181);勿动蛋白-A(Nogo-A)抗体(美国abcam公司,货号:ab62024);溶血磷脂酸(LPA)抗体(美国abcam公司,货号:ab23698);鸡抗大鼠微管相关蛋白2(MAP2)抗体(美国abcam公司,货号:ab5392);TUNEL染色试剂盒(北京伊塔生物科技有限公司,批号:20190304);鬼笔环肽染色液(广州宏新生物技术有限公司,批号:20190416)。
1.3 主要仪器 SMZ745型光学显微镜(日本尼康公司);GIS-500型化学发光成像仪(杭州米欧公司号);ASA-602S脑立体定向仪(深圳安科高技术股份有限公司);Mini-PROTEAN Tetra Cell蛋白电泳仪(美国伯乐公司);M-Blot快速转膜仪(南京中科通仪科技有限公司);JEM-F200透射电镜仪器(日本电子株式会社)。
1.4 造模与分组 取SD新生大鼠80只,参照文献[6]方法制备GBS菌液,将大鼠麻醉后,用脑立体定向仪向大鼠小脑延髓池注入浓度为1×108cfu/L的GBS菌液50 μL,建立BM模型。感染后24 h,抽取脑脊液并检测脑脊液中TNF-α水平,若TNF-α水平高于正常脑脊液10倍以上,视为造模成功。共80只大鼠造模成功,将造模成功的大鼠随机分为模型组、黄芪甲苷组、RhoA激动剂组、黄芪甲苷+RhoA激动剂组,每组20只。另取20只大鼠,于脑侧室相同部位注入等量生理盐水,作为正常对照组。
1.5 实验给药 参照文献[7]将黄芪甲苷用生理盐水稀释成浓度为4.00 mg/mL的混悬液,黄芪甲苷组大鼠按10 mL/kg的剂量经腹腔注射给药3 d,2次/d;RhoA激动剂参照文献[8]设置剂量,RhoA激动剂组大鼠用微量注射器于小脑延髓池注入浓度为50 μmoL/L的RhoA激动剂溶液(按1 mL/kg剂量,每只大鼠约50 μL)1次;黄芪甲苷+RhoA激动剂组大鼠腹腔注射黄芪甲苷溶液的同时经小脑延髓池注射RhoA激动剂溶液;模型组及正常对照组大鼠经腹腔注射及经小脑延髓池注射等量生理盐水。
1.6 观察指标
1.6.1 大鼠一般行为观察 给药期间观察各组大鼠毛色、行为活动及死亡状况。
1.6.2 大鼠脑脊液中TNF-α、NSE及PCT水平 0.3%戊巴比妥钠麻醉大鼠,用脑立体定向仪,从小脑延髓池穿刺进针后回抽脑脊液50 μL,取1 mL脑脊液,按ELISA试剂盒说明书检测TNF-α、NSE及PCT水平。
1.6.3 大鼠脑皮质组织神经元超微结构 将大鼠用0.3%戊巴比妥钠麻醉后,采用尾静脉空气栓塞法处死,开颅取脑,冰上分离脑皮质组织,剪取1 mm3脑皮质组织,用4%戊二醛固定后,送于电镜室处理后,电镜下观察脑皮质组织神经元结构变化。剩余脑皮质组织分成两部分,一部分置于-80 ℃冰箱保存备用,另一部分置于4%多聚甲醛中固定备用。
1.6.4 大鼠脑皮质神经元细胞凋亡率 取“1.6.3”项下4%多聚甲醛中固定的脑皮质组织,常规透明、浸蜡、包埋后,切成5 μm的间断连续切片。取部分切片,按TUNEL染色试剂盒说明书方法进行染色后,置于显微镜下观察神经元染色情况,凋亡细胞被染为红棕色,用Image J图像分析软件统计检测细胞凋亡率。
1.6.5 F-actin在神经元细胞中分布情况 取“1.6.4”项下部分切片石蜡切片,脱蜡及抗原修复后,加入曲拉通(Triton)透化30 min,滴加IgG标记的MAP2(1∶200)抗体,室温孵育过夜后,滴加相应二抗溶液,室温避光孵育1 h后,加入2 mg/mL FITC标记的鬼笔环肽溶液室温避光染色3 h后,用抗荧光淬灭剂封片,荧光共聚焦显微镜观察脑皮层神经元中F-actin分布情况。
1.6.6 MAP2与RhoA共表达水平 取“1.6.4”项下部分切片,脱蜡及抗原修复后,加入曲拉通(Triton)透化1 h,加入一抗(MAP2、RhoA,1∶200),4 ℃孵育过夜后,加入二抗[羊抗兔-FITC(绿)和山羊抗鸡IgG(红)]室温避光孵育2 h,DAPI显色,封片,用荧光显微镜观察并拍照,并通过Image Pro Plus 5.0图像分析系统测定阳性染色细胞数目。
1.6.7 大鼠脑皮质组织ROCK2阳性表达水平 取“1.6.4”项下部分切片石蜡切片,于37 ℃条件脱蜡、水化、抗原修复后,加入一抗(ROCK2,1∶500),4 ℃孵育过夜后,加入羊抗兔二抗(1∶1 000),4 ℃孵育3 h,后进行DAB显色及苏木精溶液复染、透明、封片,于光镜下观察拍照,用Image Pro Plus 5.0图像分析系统分析单位面积内棕褐色区域积分光密度值。
1.6.8 大鼠脑皮质组织Nogo-A、LPA蛋白相对表达水平 取“1.6.4”中-80 ℃保存的脑皮质组织,4 ℃解冻后,冰上匀浆分离提取蛋白,用BCA法检测蛋白总浓度。取50 μg蛋白进行电泳、转膜反应,并加入一抗(Nogo-A、LPA,1∶800,内参β-actin,1∶1 000),4 ℃孵育过夜,加入HRP羊抗兔二抗(1∶3 000)室温孵育2 h,用增强化学发光法显色,以化学发光成像仪观察条带并拍照,以Image-J软件分析各组蛋白相对表达。
1.7 统计学方法 采用SPSS 22.0软件进行分析,计量资料以“均数±标准差”()表示,单因素方差分析行多组间比较,SNK-q检验行进一步组间两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般行为观察 正常对照组大鼠无死亡,饮食及活动正常;模型组和黄芪甲苷+RhoA激动剂组大鼠有4只死亡,活动量减少;黄芪甲苷组大鼠无死亡,活动量稍有增加;RhoA激动剂组大鼠有8只死亡,活动量进一步减少。
2.2 各组大鼠脑脊液中TNF-α、NSE、PCT水平比较 与正常对照组比较,模型组大鼠脑脊液中TNF-α、NSE、PCT水平明显升高(P<0.05);与模型组比较,黄芪甲苷组大鼠脑脊液中TNF-α、NSE、PCT水平明显降低(P<0.05),RhoA激动剂组大鼠脑脊液中TNF-α、NSE、PCT水平明显升高(P<0.05);黄芪甲苷+RhoA激动剂组大鼠脑脊液中NSE、PCT水平明显高于黄芪甲苷组(P<0.05);黄芪甲苷+RhoA激动剂组大鼠脑脊液中NSE、PCT水平与模型组比较,差异无统计学意义(P>0.05)。(见表1)
表1 各组大鼠脑脊液中TNF-α、NSE、PCT 水平比较()

表1 各组大鼠脑脊液中TNF-α、NSE、PCT 水平比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄芪甲苷组比较,cP<0.05
2.3 各组大鼠脑皮质神经元细胞超微结构变化比较 正常对照组大鼠脑皮质神经元结构正常;模型组及黄芪甲苷+RhoA激动剂组大鼠脑皮质神经元损伤,可见线粒体肿胀、内质网扩张等细胞器坏死现象;黄芪甲苷组大鼠神经元较为规整,且细胞器坏死减少;RhoA激动剂组大鼠神经元损伤及细胞器变形坏死进一步加重。(见图1)

图1 各组大鼠脑皮质组织神经元超微结构图(×15 000)
2.4 各组大鼠脑皮质神经元细胞凋亡率比较 模型组大鼠脑皮质神经元细胞凋亡率明显高于正常对照组(P<0.05);黄芪甲苷组大鼠脑皮质神经元细胞凋亡率明显低于模型组(P<0.05);RhoA激动剂组大鼠脑皮质神经元细胞凋亡率明显高于模型组和黄芪甲苷组(P<0.05);黄芪甲苷+RhoA激动剂组大鼠脑皮质神经元细胞凋亡率明显高于黄芪甲苷组(P<0.05);黄芪甲苷+RhoA激动剂组大鼠脑皮质神经元细胞凋亡率与模型组比较,差异无统计学意义(P>0.05)。(见图2、表2)
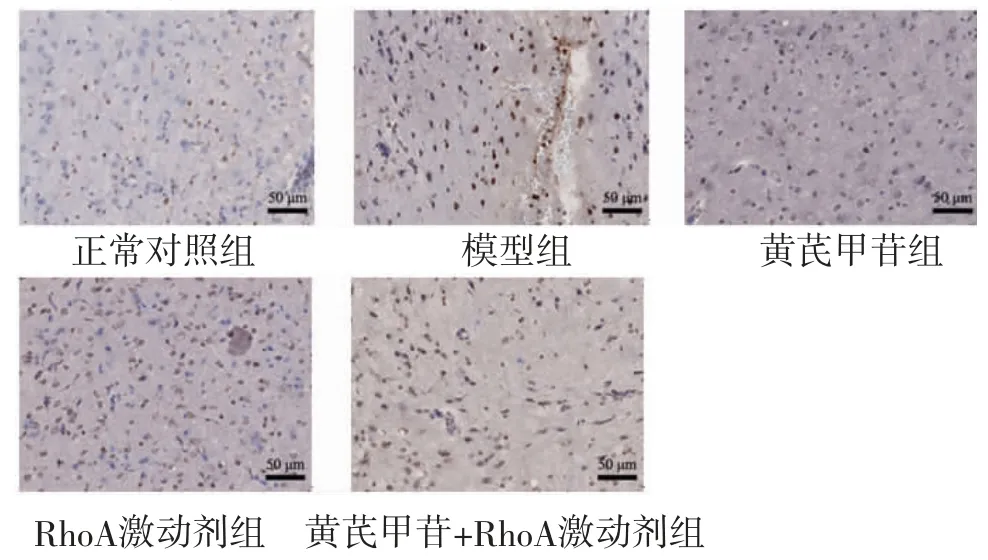
图2 大鼠脑皮质组织TUNEL 染色图(×400)
表2 各组大鼠脑皮质组织神经元细胞凋亡率比较(,%)

表2 各组大鼠脑皮质组织神经元细胞凋亡率比较(,%)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄芪甲苷组比较,cP<0.05
2.5 黄芪甲苷对大鼠脑皮质神经元细胞骨架重排的影响 F-actin为细胞骨架重排的标志分子,荧光染色显示:正常对照组大鼠脑皮质神经元细胞胞浆中F-actin荧光表达较弱;模型组和黄芪甲苷+RhoA激动剂组大鼠F-actin的纤维形态及排列异常,出现大量板状伪足和应力纤维;黄芪甲苷组大鼠神经元细胞浆中F-actin分布减少,神经元形态与正常对照组相近;RhoA激动剂组大鼠F-actin的纤维形态及排列异常现象进一步加重。(见图3)

图3 鬼笔环肽染色法检测F-actin在神经元中的分布图(×1000)
2.6 各组大鼠脑皮质组织RhoA与MAP2阳性表达比较 MAP2标记的神经元显红色荧光,RhoA可阳性表达于神经元细胞浆中。模型组大鼠RhoA+MAP2+阳性表达数目高于正常对照组(P<0.05);黄芪甲苷组大鼠RhoA+MAP2+阳性表达数目低于模型组(P<0.05);RhoA激动剂组大鼠RhoA+MAP2+阳性表达数目高于模型组和黄芪甲苷组(P<0.05);黄芪甲苷+RhoA激动剂组大鼠RhoA+MAP2+阳性表达数目高于黄芪甲苷组(P<0.05)。(见图4、表3)
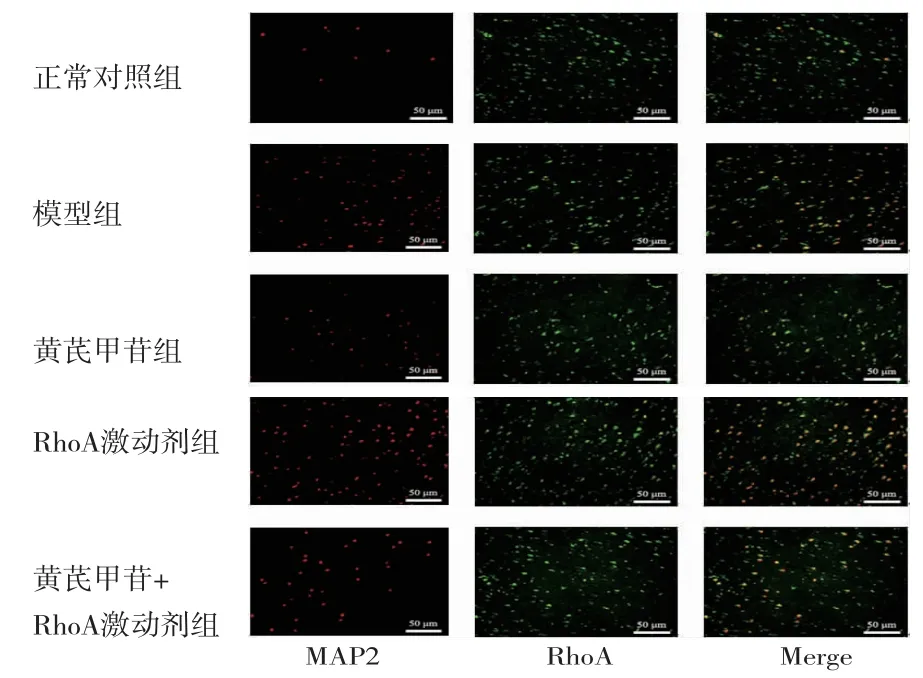
图4 各组大鼠脑皮质组织RhoA与MAP2免疫荧光双染图(×200)
表3 各组大鼠脑皮质组织RhoA 与MAP2 阳性表达水平比较()

表3 各组大鼠脑皮质组织RhoA 与MAP2 阳性表达水平比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄芪甲苷组比较,cP<0.05
2.7 各组大鼠脑皮质组织中ROCK2阳性表达比较 ROCK2在正常对照组大鼠脑皮质组织神经元中呈弱阳性表达;与正常对照组比较,模型组大鼠脑皮质组织中ROCK2阳性表达明显升高(P<0.05);与模型组比较,黄芪甲苷组大鼠脑皮质组织中ROCK2阳性表达明显降低(P<0.05);RhoA激动剂组大鼠脑皮质组织中ROCK2阳性表达明显高于模型组和黄芪甲苷组(P<0.05);黄芪甲苷+RhoA激动剂组大鼠脑皮质组织中ROCK2阳性表达明显高于黄芪甲苷组(P<0.05)。(见图5、表4)
表4 各组大鼠脑皮质组织ROCK2 阳性表达水平比较()

表4 各组大鼠脑皮质组织ROCK2 阳性表达水平比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄芪甲苷组比较,cP<0.05

图5 各组大鼠脑皮质组织ROCK 蛋白的免疫组化染色图(×200)
2.8 各组大鼠脑皮质组织Nogo-A、LPA蛋白表达比较 与正常对照组比较,模型组大鼠脑皮质组织中Nogo-A、LPA蛋白相对表达量明显升高(P<0.05);与模型组比较,黄芪甲苷组大鼠脑皮质组织中Nogo-A、LPA蛋白相对表达量明显降低(P<0.05);RhoA激动剂组大鼠脑皮质组织中Nogo-A、LPA蛋白相对表达量明显高于模型组和黄芪甲苷组(P<0.05);黄芪甲苷+RhoA激动剂组大鼠脑皮质组织中Nogo-A、LPA蛋白相对表达量明显高于黄芪甲苷组(P<0.05)。(见图6、表5)
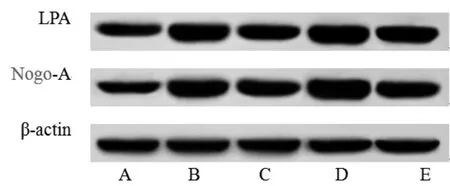
图6 各组大鼠脑皮质组织Nogo-A、LPA 蛋白免疫印迹图
表5 各组大鼠脑皮质组织Nogo-A、LPA 蛋白相对表达量比较()
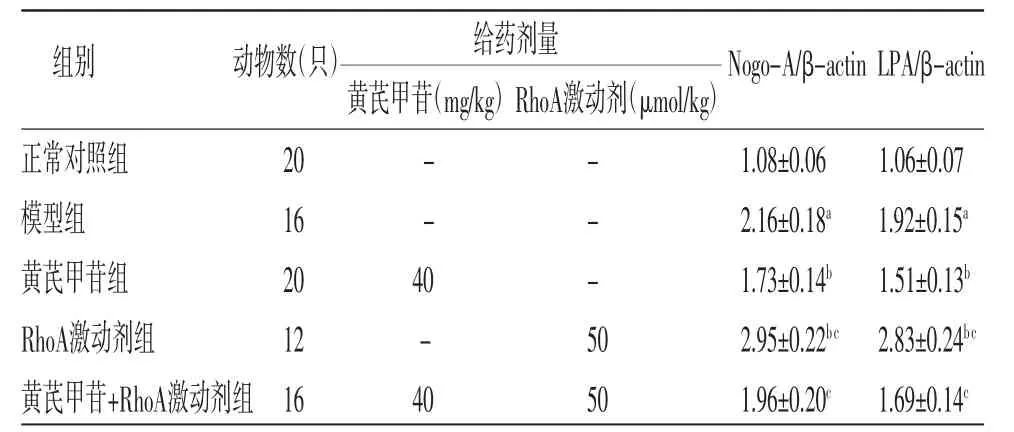
表5 各组大鼠脑皮质组织Nogo-A、LPA 蛋白相对表达量比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与黄芪甲苷组比较,cP<0.05
3 讨 论
BM病死率及病残率较高,据流行病学分析,GBS感染引起的BM,可导致约10%的患儿死亡,35%左右的患儿发生神经系统后遗症[1]。目前研究发现,BM不良预后,与GBS等致病菌感染脑膜及皮质组织后,引起的神经元损伤及凋亡有关[9]。胡婧婧等[10]认为细菌感染后引起的炎症刺激及中枢神经损伤是导致BM患儿死亡和伤残的主要原因,并认为BM患儿脑脊液中神经元损伤后释放物质——NSE水平及炎症敏感且特异的标志物——PCT等水平越高,预示BM预后及转归越差。TNF-α是细菌感染标志物,DINIZ A M M等[11]发现BM患者血清及脑脊液中TNF-α水平明显高于正常人群。本研究经新生大鼠侧脑室注射GBS后,大鼠脑脊液中TNF-α水平增多的同时,NSE及PCT水平也高于正常对照组,且大鼠死亡、神经元结构损伤及凋亡现象也显著增加,提示GBS感染后,大鼠出现神经元凋亡及损伤现象,表明造模成功。临床上常采用抗生素及糖皮质激素药物来改善BM神经并发症和延缓死亡进程,但随着致病菌进化、耐药菌增加等多种因素的产生,BM的诊治问题也日益突出[12]。现代药理发现,中药黄芪中的活性成分黄芪甲苷具有抗链球菌作用[13],且对神经元也有保护作用[5],预示黄芪甲苷也可能为治疗BM神经元感染性损伤的潜在药物。本研究结果显示,黄芪甲苷干预疗BM大鼠后,大鼠死亡减少,脑脊液中TNF-α、NSE及PCT水平明显降低,神经元结构损伤及凋亡也显著缓解,证实了黄芪甲苷对BM大鼠神经元损伤有改善作用,但其改善作用的具体机制还需进一步研究。
RhoA/ROCK2通路在神经元分化及神经系统疾病过程中发挥了重要作用。研究[14-15]发现RhoA及ROCK2是神经元细胞骨架的重要效应分子,其激活可抑制神经轴突生长发育,引起细胞骨架重构及异常收缩,导致神经元损伤、神经轴突生长锥塌陷丢失,而参与神经退行性病变过程;体内外实验证实RhoA/ROCK2激活可促进神经元细胞凋亡,阻断RhoA/ROCK2通路激活,抑制神经元凋亡,促进中枢神经系统内源性修复[16-17]。本研究发现BM大鼠RhoA与脑皮质神经元阳性共表达数目增多,且ROCK2在神经元中呈强阳性表达,大鼠神经元凋亡率也显著降低,提示BM大鼠脑皮质神经元中RhoA/ROCK2通路激活,可能是BM大鼠神经元结构损伤及凋亡的潜在影响因素。
另外,F-actin是细胞骨架重排的重要标志物,也是RhoA/ROCK2通路的下游效应分子。卢叶等[18]发现细菌感染后,TNF-α可激活RhoA/ROCK2通路,刺激F-actin在血管内皮细胞胞浆中聚集,从而促进细胞增粗、排列紊乱,引起细胞骨架重排,导致细胞通透性改变及损伤。本研究也检测到F-actin在BM大鼠神经元中分布增多,推测细菌感染后,RhoA/ROCK2通路激活,引起下游分子F-actin在神经元中聚集,导致神经元骨架改变、损伤及凋亡。LPA可与神经元内产生的髓鞘抑制性信号效应分子——Nogo-A相互作用,促进RhoA/ROCK2通路激活及细胞骨架重排[19]。本研究于BM大鼠侧脑室注射RhoA激动剂后,大鼠脑皮质神经元LPA及Nogo-A蛋白表达,RhoA/ROCK2通路激活,以及细胞F-actin分布进一步增加的同时,大鼠死亡、神经元结构损伤及凋亡也进一步加重,提示激活RhoA/ROCK2通路,可加剧BM大鼠神经元结构损伤和凋亡。XIE S H等[20]发现黄芪甲苷可通过抑制RhoA基因表达来改善肠屏障损伤,预示黄芪甲苷可能对RhoA相关通路表达有干预作用。本研究显示黄芪甲苷改善BM大鼠神经元结构损伤及凋亡的同时,大鼠脑皮质神经元LPA及Nogo-A蛋白表达,RhoA/ROCK2通路激活,以及细胞F-actin分布均受到抑制,而RhoA激动剂LPA可逆转黄芪甲苷的上述作用。
综上所述,黄芪甲苷可抑制BM大鼠脑皮质神经元中RhoA/ROCK2通路激活,抑制神经元骨架重构,缓解神经元结构损伤及凋亡。这可能为黄芪甲苷治疗BM的机制提供一定参考。但BM细菌迁移与神经元结构损伤的网络机制较为复杂,黄芪甲苷改善BM神经系统损伤的其他机制,还有待后续深入研究。
