短管兔耳草多糖的结构表征及其免疫调节活性研究
2021-11-24余蕊宏孙梦珂陈仕雄张浚文黄一帆
余蕊宏,孟 祯,孙梦珂,陈仕雄,张浚文,黄一帆,秦 韬,任 喆
(福建农林大学动物科学学院 福建省兽医中药与动物保健重点实验室,福州 350002)
短管兔耳草(LagotisbrevitubaMaxim)又名“洪连”,属玄参科(Scrophulariaceae)短管兔耳草属(LagotisGaertn)草本植物[1],主要分布于我国西藏、青海、甘肃等[2]地区。作为民间传统藏药,短管兔耳草在治疗全身发热、肺病、肾炎、高血压等[3]疾病中具有良好的疗效。大量药理研究和临床实践表明,短管兔耳草主要含有苯丙素苷类、酚类、环烯迷萜苷类和黄酮类等化学成分,这些成分具有抗肿瘤、抗菌、抗炎、免疫调节等[4-6]作用。多糖(polysaccharide)作为短管兔耳草中的活性成分之一,是一类具有多种生物活性的天然大分子物质,如抗肿瘤、抗氧化、抗炎、免疫调节活性等[7-9]。多糖作为一种天然的免疫调节剂,具有毒副作用小、安全性较高等[10]特点,已成为近年来研究的一大热点。
树突状细胞(dendritic cells,DC)是一种重要的专职抗原提呈细胞(antigen presenting cells,APC),在机体细胞免疫和体液免疫调控中具有重要作用[11]。未成熟的DC受到抗原刺激后变为成熟的DC,迁移至淋巴器官后,通过主要组织相容性复合物(major histocompatibility complex,MHC)分子提呈抗原多肽和共刺激分子来激活T细胞,从而启动特异性免疫应答[12-13]。研究表明[14],多糖可通过与DC表面的多种受体结合,激活不同的信号通路,从而诱导DC表型和功能的成熟,最终对机体起到免疫调节作用。目前,国内外关于短管兔耳草的报道只局限于其化学组成和提取工艺方面[15-17],尚未见有关短管兔耳草多糖(LagotisbrevitubaMaxim polysaccharide,LMP)的结构和免疫调节活性的报道。
因此,本试验从短管兔耳草中分离纯化得到成分均一的多糖LMP,通过高效凝胶色谱法(high performance gel permeation chromatography,HPGPC)、傅里叶变换-红外光谱法(Fourier transform infrared spectroscopy,FT-IR)、紫外光谱(ultraviolet spectroscopy)、扫描电镜(scanning electron microscope,SEM)、原子力显微镜(atomic force microscope,AFM)等方法对其结构进行分析,并进一步评价其对BMDCs的免疫调节活性,以期为短管兔耳草多糖的开发和利用提供理论基础。
1 材料与方法
1.1 主要材料和试剂
ICR雄性小鼠,6~8周龄,购于福州吴氏动物公司;短管兔耳草购自福州晴百旺公司;DEAE-52纤维素购于Whatman公司;蛋白含量检测试剂盒购自江苏凯基生物公司;RPMI 1640培养液、胎牛血清(FBS)购自Gibco公司;PBS、噻唑蓝(MTT)、红细胞裂解液、青霉素-链霉素购于Solarbio公司;anti-mouse CD16/CD32封闭抗体购自杭州联科生物公司;流式抗体anti-mouse FITC-CD80、CD86、MHC-Ⅰ、MHC-Ⅱ均购自eBioscience公司;丝裂霉素C购自合肥博美生物科技公司;脂多糖(LPS)、FITC-dextran购自Sigma公司;rm GM-CSF与rm IL-4均购自深圳欣博盛生物科技公司;小鼠TNF-α、IL-12试剂盒购自上海酶联生物科技公司;其余试剂均为分析纯,购于国药集团化学试剂公司。
1.2 主要仪器
ABT 320-4M电子天平系德国科恩公司产品;真空冷冻干燥机购自德国CHRiST公司;傅里叶红外光谱仪系美国Thermo公司产品;RE-52CS旋转蒸发仪系上海亚荣生化仪器厂产品;Nano Plus3激光粒度仪购自Malvern公司;MultiMode 8 SPM原子力显微镜系Bruker公司产品;台式高速离心机购自美国BECKMAN公司;NovoCyte流式细胞仪购自艾森生物有限公司;Infinite M200 Pro酶标仪购自TECAN公司;二氧化碳恒温培养箱购自西德Haraneus公司。
1.3 短管兔耳草多糖的分离和纯化
1.3.1 短管兔耳草多糖的提取 称取干燥的短管兔耳草500 g,置于3倍体积的95%乙醇中浸煮3 h,用以除去脂溶性物质。脱脂后的短管兔耳草按1∶20的固液比加入双蒸水,置于恒温电热套(110 ℃)中浸煮2 h。8 000 r·min-1离心10 min后,合并所有的上清液,经减压浓缩至原体积的1/3,再次加入95%乙醇进行醇沉,静置过夜。8 000 r·min-1离心10 min 后,收集沉淀,经冷冻干燥后得到短管兔耳草粗多糖。
1.3.2 除蛋白 采用Sevage液(正丁醇∶氯仿=1∶5)除去短管兔耳草粗多糖的蛋白,Sevage液与粗多糖溶液的比例为1∶5。重复上述步骤3~4次 后,合并所有的上清液,经浓缩、醇沉、离心后,收集沉淀,经冷冻干燥后得到除蛋白后的短管兔耳草粗多糖。
1.3.3 DEAE-52纤维素柱层析 采用DEAE-52纤维素柱层析法对短管兔耳草粗多糖进一步分离纯化,上样浓度为100 mg·mL-1,上样体积为10 mL,流速为1 mL·min-1,洗脱液为双蒸水。利用自动收集器收集洗脱液,每管收集5 min,并以苯酚-硫酸法测定每管洗脱液在490 nm处的吸光值,以管数为横坐标,吸光度值为纵坐标绘制洗脱曲线图。分别合并收集含多糖的洗脱液,减压浓缩后静水透析24 h(分子截留量为100~500 u),期间每12 h 换水1次。将透析后的溶液进行浓缩,冷冻干燥后即得短管兔耳草多糖(LMP)。
1.3.4 短管兔耳草的化学组成测定 采用苯酚-硫酸法在490 nm处测定LMP的糖含量,采用考马斯亮蓝法在595 nm处测定LMP的蛋白含量,采用鲎试剂法在545 nm处检测LMP中的内毒素含量。
1.4 短管兔耳草多糖的结构分析
1.4.1 平均分子量测定 将浓度为1 mg·mL-1的LMP溶液,采用HPGPC测定其平均分子量。色谱条件:检测器为安捷伦1260 Infinity液相色谱仪,配RID-1A示差折光检测器;色谱柱选用KS-805、KS-804和KS-802三根串联;流动相为双蒸水;流速为1 mL·min-1;柱温为70 ℃,检测器温度为50 ℃。
1.4.2 红外光谱分析 精密称取2 mg LMP,与200 mg KBr粉末混匀后,于玛瑙研钵中研磨成极细粉末,压片后用傅里叶红外光谱仪在4 000~500 cm-1进行扫描,并记录红外光谱。
1.4.3 紫外光谱分析 将LMP配制成0.5 mg·mL-1的多糖溶液,使用紫外分光光度计在200~800 nm测定多糖溶液的紫外吸收光谱。
1.4.4 粒径和Zeta电位 采用激光粒度仪测定LMP的平均粒径与Zeta电位,样品的浓度为0.1 mg·mL-1,测定温度为25 ℃。
1.4.5 扫描电镜分析 将少量LMP粉末均匀涂抹于导电胶表面,经喷金处理后,通过扫描电镜对LMP的微观结构进行观察。
1.4.6 原子力电镜分析 配制10 μg·mL-1的LMP溶液,经磁力搅拌1 h后,用滴管滴加1滴在云母表面,待其干燥后用原子力电镜在Tapping模式下成像,并对其形态和空间结构进行观察。
1.5 短管兔耳草多糖的体外免疫活性分析
1.5.1 小鼠骨髓源树突状细胞的体外诱导培养 取6~8周龄的ICR雄性小鼠,以颈椎脱臼法处死后,置于装有75%酒精的容器中。无菌取出股骨和胫骨,用纱布去除附着的肌肉和结缔组织后,剪掉骨的两端,用1 mL无菌注射器吸取PBS,反复冲洗骨髓腔,直到骨髓腔发白。收集细胞悬液,1 500 r·min-1离心10 min后弃上清。收集细胞沉淀,按1∶5体积加入红细胞裂解液,于冰上裂解2 min。加入RPMI 1640基础培养液终止反应,1 500 r·min-1离心10 min,弃上清。收集细胞沉淀,加入含20 ng·mL-1rm IL-4和20 ng·mL-1rm GM-CSF的RPMI 1640完全培养液(含10% FBS和1%青-链霉素),将细胞浓度调整为1×106cell·mL-1后接种于6孔板中,每孔4 mL,于37 ℃、5%CO2条件下培养6 d,隔天半量换液并补充刺激因子,培养期间用倒置显微镜观察细胞的形态变化。第7天,弃上清后获得BMDCs,用RPMI 1640完全培养液重悬,用于后续试验。
1.5.2 细胞增殖活性 采用MTT法检测LMP对BMDCs的增殖活性。将培养至第7天的BMDCs,用RPMI 1640完全培养液调整细胞的浓度为1×105cell·mL-1,加入96孔板中,每孔100 μL。37 ℃,5% CO2环境下培养24 h后,每孔加入100 μL 含LMP的RPMI 1640完全培养液(终浓度分别为0.78、1.56、3.13、6.25、12.50、25.00、50.00、100.00、200.00、400.00、800.00 μg·mL-1),另设空白对照组。24 h后,每孔加入10 μL MTT(5 mg·mL-1),继续培养4 h,弃上清,每孔加入150 μL DMSO,震荡10 min后,将96孔板于酶标仪570 nm处测定吸光度值,并以空白组的细胞活力为100%来分析各组的细胞活力。
1.5.3 试验分组 根据“1.5.2”中BMDCs增殖的试验结果,分为4组:Control组(RPMI 1640)、LPS组(1 μg·mL-1LPS)、LMP组(终浓度分别为3.13、6.25、12.50、25.00、50.00 μg·mL-1),每孔1 mL,置于37 ℃、5% CO2中培养24 h后用于后续试验。
1.5.4 细胞表面分子表达 BMDCs按“1.5.3”分组培养24 h后,弃上清,用预冷的PBS洗两遍,每孔各加入1 μL CD16/CD32封闭抗体封闭,冰浴10 min 后,分别加入FITC-CD80、CD86、MHC-Ⅰ和MHC-Ⅱ,4 ℃避光孵育30 min后,PBS清洗两遍,弃上清,用500 μL PBS重悬后,用NovoCyte流式细胞仪检测。
1.5.5 细胞吞噬活性 BMDCs按“1.5.3”分组培养24 h后,弃上清,用预冷的PBS洗两遍,加入丝裂霉素C(2 mg·mL-1)作用30 或90 min。PBS清洗两次后,每孔各加入100 μL FITC-dextran(1 mg·mL-1),4或37 ℃条件下避光染色1 h后,PBS清洗两遍,弃上清,用500 μL PBS重悬后,用NovoCyte流式细胞仪检测各个条件下的平均荧光强度(MFI),并按下式计算细胞吞噬率。
ΔMFI(%)=MFI(37 ℃)-MFI(4 ℃)。
1.6 统计分析
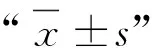
2 结 果
2.1 短管兔耳草多糖的制备
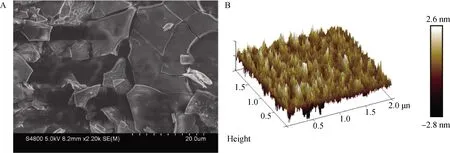
由图1A可知,经DEAE-52纤维素柱层析分离纯化得到的洗脱曲线为单一峰,表明组分均一,主要分布在20~60管,因此短管兔耳草多糖的DEAE-52 纤维素色谱柱出峰时间在100~300 min。收集100~300 min内的洗脱液,经冷冻干燥后得到白色粉末状的短管兔耳草多糖,命名为LMP。经测定,LMP的得率(18.5±1.7)%,糖含量(89.7±1.9)%,蛋白含量为(0.8±0.1)%,内毒素含量为0.011 7 EU·mL-1。
2.2 短管兔耳草多糖的结构分析
2.2.1 平均分子量 如图1B所示,LMP在凝胶色谱柱上展现出来为单一对称峰,峰型较宽,表明LMP的平均分子量分布较为均一。结合葡聚糖的标准曲线y=53.926 13-8.289 42x+0.529 17x2-0.015 43x3+0.000 17x4,将LMP在色谱柱的保留时间带入标准曲线中,得到LMP的平均分子量为3.18×103u。
2.2.2 红外光谱 如图1C所示,LMP在3 285.14 cm-1处的吸收峰型较宽,是由O-H的伸缩振动引起,在2 930.31 cm-1和1 398.14 cm-1处的吸收峰分别代表C-H的伸缩振动和变角振动特征吸收峰,这三种吸收峰均属于多糖的典型特征峰,表明LMP属于多糖类物质。在1 641.13 cm-1处有一吸收峰,代表多糖官能团中O-H键的伸缩振动。在1 200~1 000 cm-1的吸收峰代分别代表C-O-C 和C-O-H的伸缩振动,933.49 cm-1处的吸收峰是由呋喃环伸缩振动引起的,在823.46 cm-1的吸收峰显示其含有β-构型的糖苷键。
A.LMP在DEAE-52纤维素层析柱洗脱曲线;B.LMP在凝胶色谱柱上的平均分子量分布图;C.LMP的红外光谱图; D.LMP的紫外光谱图
2.2.3 紫外光谱扫描 LMP在200~800 nm的紫外扫描图如1D所示,LMP在260 和280 nm处没有明显的吸收峰,表明LMP不含核酸和蛋白质。
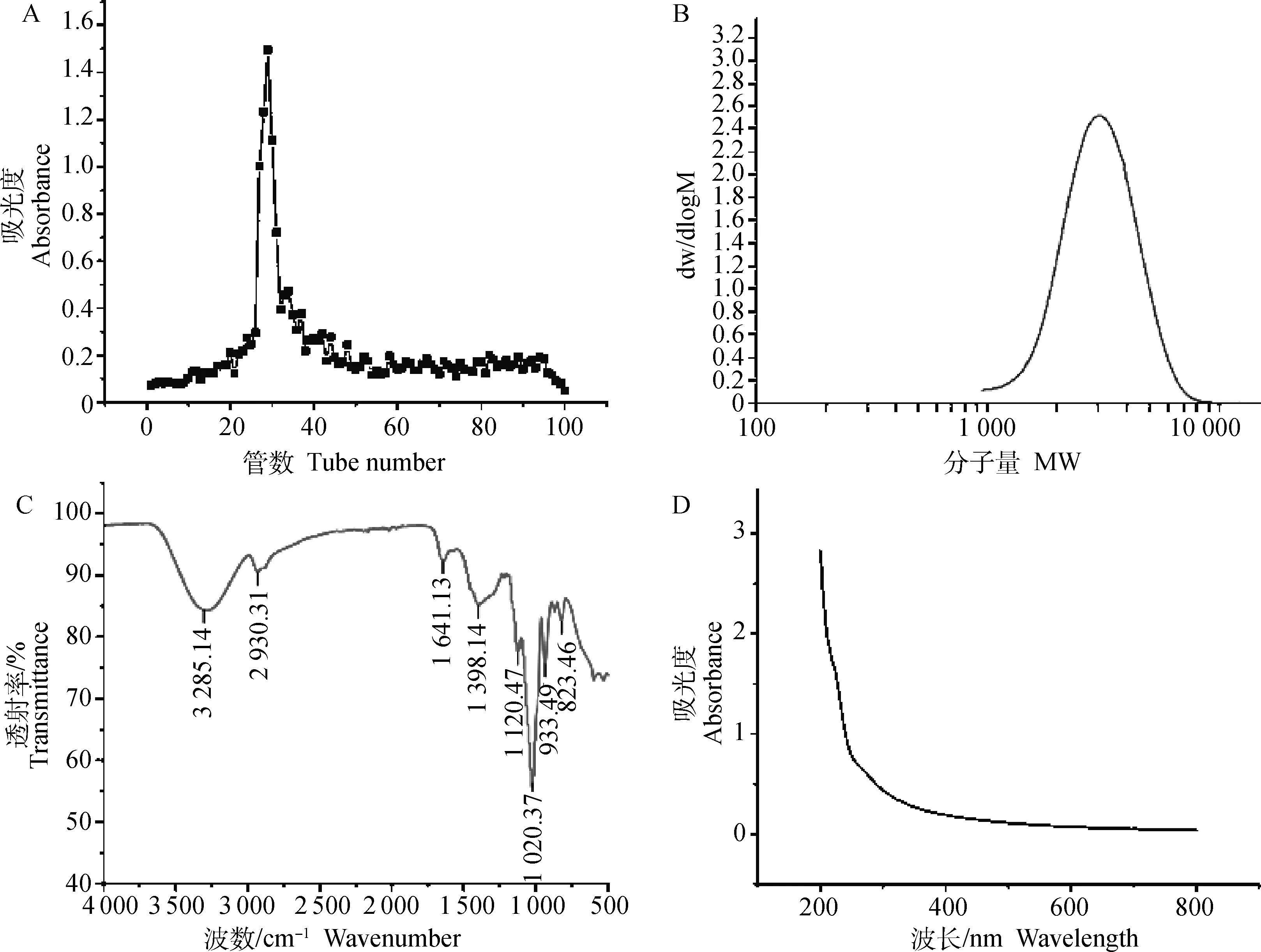
2.2.4 粒径与Zeta电位 由图2A可知,当LMP浓度为0.1 mg·mL-1时,平均粒径为1 483.89 nm。由图2B可知,当LMP浓度为0.1 mg·mL-1时,溶液带负电荷,电位值为-14.81 mV。
教育是什么?什么才是最好的教育?著名教育家陶行知从“教学做合一”出发,倡导教师与学生共学、共事、共修养,他认为这才是真正的最好的教育,即学校的存在本义是“学习共同体”。校长作为一个学校的灵魂,其思想观念、角色行为影响着一所学校。因此,在将学校打造成学习共同体的过程中,校长发挥作用和实现角色转换是至关重要的。校长作为学习共同体—学校的领导者,首要任务是发展出一种激励学习的“场”,必须是教师的教师,是学习共同体中的首席学习官。
A.粒径; B.Zeta电位
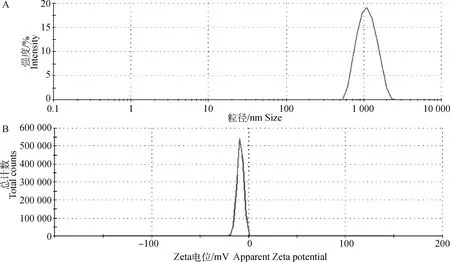
2.2.5 扫描电镜和原子力显微镜 图3A为LMP的扫描电镜图,结果表明,在2 200的放大倍数下,样品的表面形貌光滑,结构较为规整,呈片状且棱角分明。图3B为LMP的原子力显微镜图像,扫描范围为2.00 μm×2.00 μm,可看出LMP分布较均匀,其单链高度5.4 nm左右。
A.扫描电镜图;B.原子力电镜图
2.3 短管兔耳草多糖对BMDCs的免疫调节作用
2.3.1 BMDCs的形态学观察 倒置显微镜下BMDCs的细胞形态变化如图4所示,第1天,细胞的体积较小,呈圆形。第7天,细胞的体积变大,形态变为纤长的树枝样,具有较多突起,符合典型成熟DC的细胞形态。
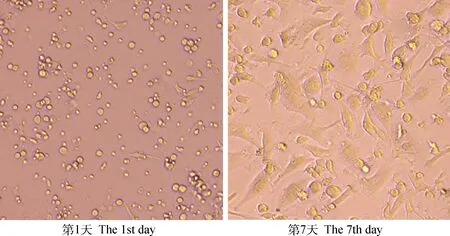
图4 倒置显微镜观察BMDCs的细胞形态(200×)
2.3.2 短管兔耳草多糖对BMDCs增殖活性的影响 LMP对BMDCs增殖活性的影响如图5所示,与空白组相比,0.78~100.00 μg·mL-1LMP能显著促进BMDCs增殖(P<0.05),以25.00 μg·mL-1LMP的增殖效果最强。当LMP的浓度为200.00~800.00 μg·mL-1时,LMP呈现一定的细胞毒性作用。因此,选择3.13、6.25、12.50、25.00、50.00 μg·mL-15个浓度用于后续的细胞活性评价。
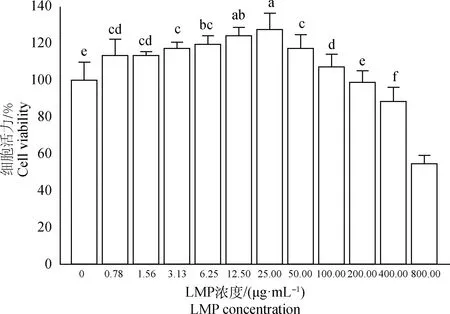
小写字母相同的表示差异不显著(P>0.05),不同的表示差异显著(P<0.05)。下图同
2.3.3 短管兔耳草多糖对BMDCs表面分子表达的影响 将不同浓度的LMP(3.13、6.25、12.50、25.00、50.00 μg·mL-1)作用BMDCs 24 h后,细胞表面分子CD80、CD86、MHC-Ⅰ和MHC-Ⅱ的表达情况如图6所示。3.13~50.00 μg·mL-1LMP的CD80表达率均显著高于空白组(P<0.05),且呈剂量依赖性。当LMP的浓度为12.50、25.00 μg·mL-1时,CD80的表达率与LPS组相比差异不显著(P>0.05),3.13~6.25 μg·mL-1LMP的CD80表达率均显著低于LPS组(P<0.05)。LMP在浓度为3.13~25.00 μg·mL-1时,CD86的表达率均显著高于空白组(P<0.05),以12.50 μg·mL-1LMP的CD86的表达率最高,为58.4%。3.13~50.00 μg·mL-1LMP的MHC-Ⅰ的表达率均显著高于空白组(P<0.05),且呈剂量依赖性。当LMP的浓度为12.50~50.00 μg·mL-1时,MHC-Ⅰ的表达率与LPS组相比差异不显著(P>0.05),3.13、6.25 μg·mL-1LMP的MHC-Ⅰ 表达率显著低于LPS组(P<0.05)。12.50~50.00 μg·mL-1LMP MHC-Ⅱ的表达率均显著高于空白组(P<0.05),且呈剂量依赖性增长,以50.00 μg·mL-1LMP的MHC-Ⅱ表达率最高,为54.3%。
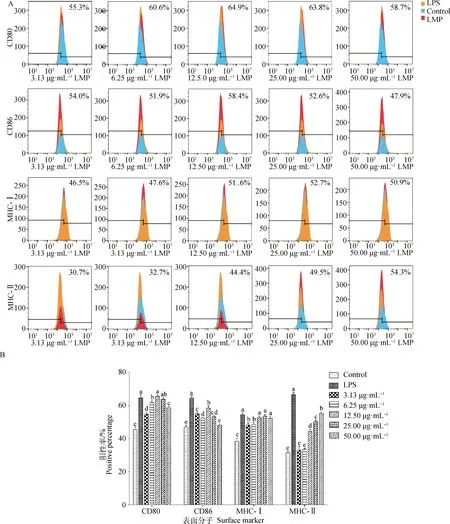
图6 LMP对BMDCs表达CD80、CD86、MHC-Ⅰ和MHC-Ⅱ分子的影响
2.3.4 短管兔耳草多糖对BMDCs吞噬功能的影响 由图7可知,与FITC-dextran作用30 或90 min 后,LPS组和LMP组的吞噬率均显著低于空白组(P<0.05)。与FITC-dextran作用30 min后,随着LMP浓度的增加,吞噬率呈剂量依赖性降低。当LMP浓度为6.25、12.5 μg·mL-1时,吞噬率与LPS组相比差异不显著(P>0.05)。当LMP浓度为25、50 μg·mL-1时,吞噬率显著低于LPS组(P<0.05),以50 μg·mL-1LMP的吞噬率最低,为6.1%。与FITC-dextran作用90 min后,3.13、6.25、12.50、50.00 μg·mL-1LMP的吞噬率均显著高于LPS组(P<0.05),而25.00 μg·mL-1LMP的吞噬率与LPS组相比差异不显著(P>0.05),吞噬率为10.1%。相比之下,与FITC-dextran作用30 min的吞噬率(6.1%)显著低于作用90 min的吞噬率(10.1%)(P<0.05)。
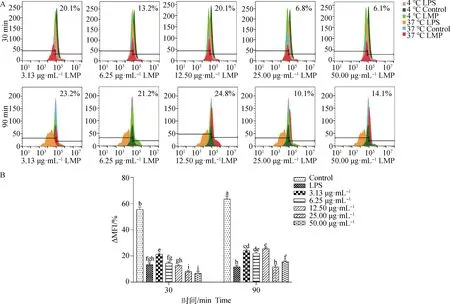
图7 LMP对BMDCs吞噬功能的影响
2.3.5 短管兔耳草多糖对BMDCs分泌TNF-α和IL-12的影响 LMP对BMDCs分泌细胞因子TNF-α和IL-12的影响如图8所示。由图8A所示,与空白组相比,3.13~50.00 μg·mL-1LMP可增加细胞因子TNF-α的分泌,以6.25 μg·mL-1LMP的TNF-α含量最高。由图8B所示,与空白组相比,3.13~50.00 μg·mL-1LMP可显著增加细胞因子IL-12的分泌(P<0.05),以6.25 μg·mL-1LMP的IL-12含量最高。
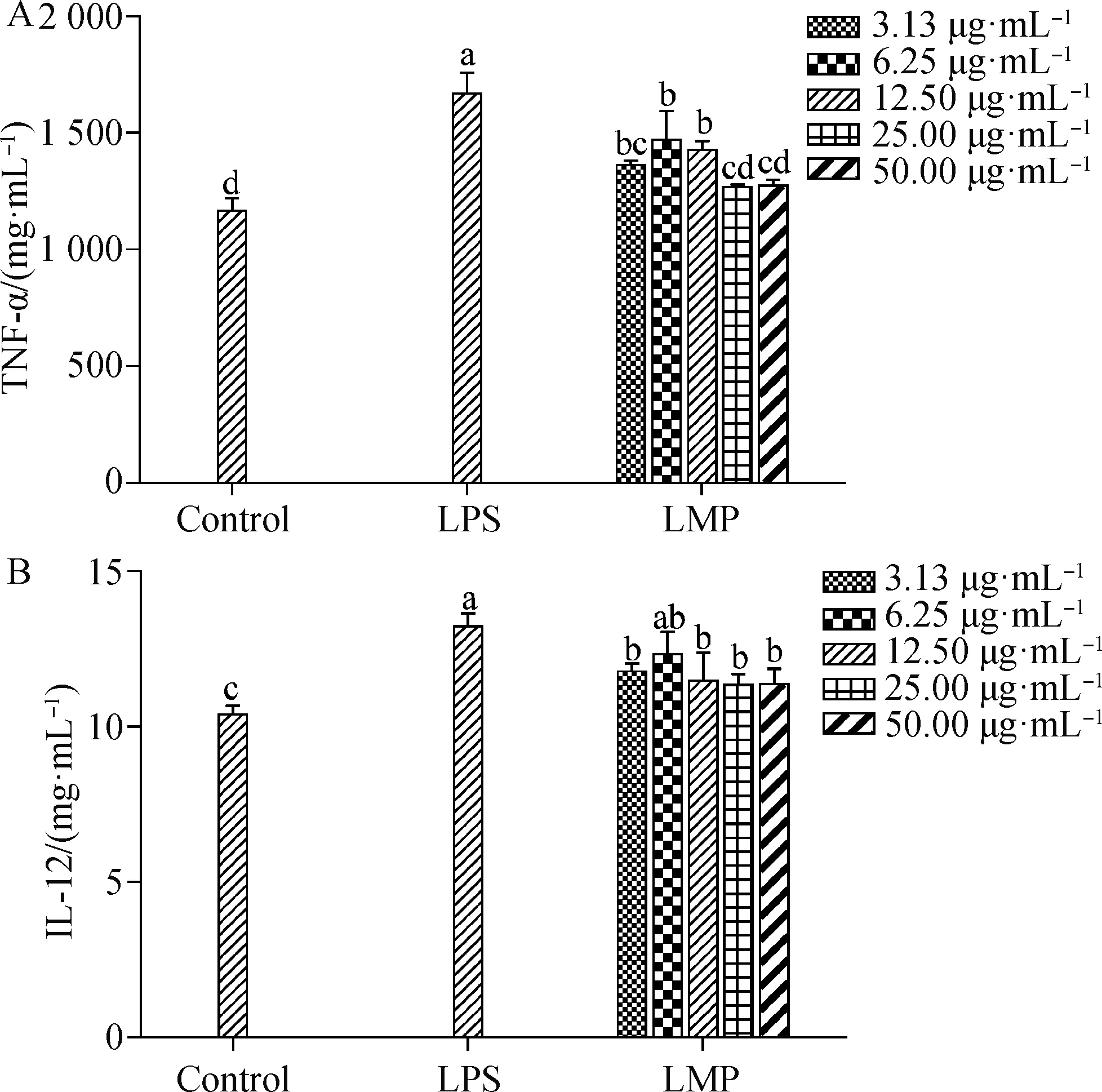
图8 LMP对BMDCs分泌TNF-α(A)和IL-12(B)的影响
3 讨 论
藏药短管兔耳草作为藏药的常用药材[18],已有悠久的历史。多糖是短管兔耳草的有效活性成分之一,具有抗氧化、抗炎、免疫调节等[19-20]作用。研究表明[21],多糖的生物活性与其结构和构像密切相关,如糖苷键的类型、分子量、空间构型等。不同的多糖具有不同的结构,其生物活性也具有较大差异,因此研究多糖的构效关系显得尤为重要。
本试验通过水提醇沉法从短管兔耳草中提取到LMP,经DEAE-52纤维素柱层析洗脱得到的洗脱曲线为单一峰,说明LMP的组分较为均一。理化性质结果显示LMP的得率为(18.5±1.7)%,糖含量为(89.7±1.9)%,蛋白含量为(0.8±0.1)%,内毒素含量为0.011 7 EU·mL-1,说明LMP的糖含量较高、蛋白含量较低且无内毒素污染[22],且UV光谱图显示在260~280 nm处未检测到吸收峰,表明LMP不含核酸和蛋白质,这与蛋白含量测定结果一致,因此可用于后续研究。多糖分子量的大小是影响其生物活性的主要因素之一[23],高分子量多糖因结构不均一导致活性不高,而低分子量的多糖因分子质量分布范围小,往往表现出更高的生物活性[24]。HPGPC结果显示,LMP的平均分子量为3.18×103u,属于低分子量多糖,表明LMP可能具有提高生物活性的效果,这与Chandrashekar等[25]的研究结果一致。红外谱图显示,LMP在多糖的特征吸收峰(3 700~3 000 cm-1和3 000~2 800 cm-1)处均有吸收峰,表明LMP属于多糖类物质。在933.49和823.46 cm-1两处的吸收峰分别代表是呋喃环的伸缩振动和β-构型的糖苷键,一般认为β构型的多糖具有较高的活性[26],说明LMP可能具有较高的生物活性,这与Yan等[27]的研究结果一致。
粒径的分布是反映多糖在水溶液中相互作用的重要指标之一,通常认为粒径越小越能被机体吸收利用,从而更好地发挥药理活性[28]。当LMP浓度为0.1 mg·mL-1时,平均粒径较大,为1 483.89 nm,这可能与多糖的浓度有关。Zeta电位能够通过粒子间静电排斥作用影响粒子在分散液中的稳定性,电位的绝对值越高表明分散粒子越稳定,体系更趋于稳定[29]。LMP的Zeta电位为-14.81 mV,表明体系较为稳定。SEM和AFM用于观察多糖的表面形貌,SEM结果显示,LMP的表面光滑,呈片状,棱角分明,AFM结果显示,其单链的高度为5.4 nm左右。多糖分子单链直径在0.1~1.0 nm[30],而LMP的高度远大于单链分子的估算值,这可能是多糖的主链为若干股形成或与探针的增宽效应有关。这与Li等[31]的研究结果一致。
DC是专职的APC,能够摄取、加工处理抗原,并将处理过的抗原递呈给T、B淋巴细胞,从而启动免疫反应[32]。本试验采用MTT法对BMDCs增殖活性进行了考察,3.13~50.00 μg·mL-1LMP能显著促进BMDCs增殖,表明3.13~50.00 μg·mL-1的LMP对BMDCs来说是一个安全的剂量范围,因此选择3.13、6.25、12.50、25.00、50.00 μg·mL-15个浓度用于后续试验。
未成熟的DC低表达共刺激因子(如CD80、CD86、CD83),但具有较强的摄取和吞噬抗原能力,成熟的DC则相反[33-34]。研究表明[35],最能反映DC免疫功能的是MHC-Ⅱ类分子和共刺激分子CD80、CD86的表达水平,它们是成熟DC的标志性分子,能识别、摄取抗原以及与它免疫细胞间信号传递的必要条件。在本试验中,与空白组相比,LMP在3.13~50.00 μg·mL-1浓度均可上调CD80、CD86、MHC-Ⅰ和MHC-Ⅱ的表达,且呈剂量依赖性,表明LMP可以促进BMDCs表型的成熟,以25.00 μg·mL-1LMP促进细胞表面分子(CD80、CD86、MHC-Ⅰ和MHC-Ⅱ)表达的效果最好。吞噬活性结果发现,经LMP刺激后的BMDCs,吞噬率显著低于空白组(P<0.05)。BMDCs与FITC-dextran作用30 min后,LMP在浓度为25.00、50.00 μg·mL-1时,降低BMDCs吞噬抗原的能力强于其他浓度组;与FITC-dextran作用90 min后,LMP在浓度为25.00 μg·mL-1时,降低BMDCs吞噬抗原的能力强于其他浓度组。因此,以25.00 μg·mL-1LMP吞噬FITC-dextran的效果最好,并以30 min的细胞吞噬率最低。
IL-12是由活化的DC、中性粒细胞和巨噬细胞产生,具有参与细胞免疫的作用[36]。IL-12和TNF-α可刺激T细胞的生长和功能的成熟,从而促进细胞免疫[37]。本研究发现,与空白组相比,3.13~50.00 μg·mL-1LMP能促进BMDCs分泌TNF-α和IL-12,说明LMP能上调BMDCs因子TNF-α和IL-12的分泌,促进BMDCs的成熟。
4 结 论
从短管兔耳草中提取得到的LMP,是一种含β-构型糖苷键的小分子量多糖,平均分子量为3.18×103u。该多糖能显著促进BMDCs细胞表面分子CD80、CD86、MHC-Ⅰ和MHC-Ⅱ的表达,提高细胞因子TNF-α和IL-12的含量,还能降低细胞吞噬活性,表明LMP的免疫调节效果显著。本研究可为短管兔耳草的开发及利用提供一定的理论基础。
