单细胞捕捉微流控芯片设计及流场分析*
2021-11-23饶成飞
饶成飞,杨 铎
(大连大学机械工程学院,辽宁大连 116622)
0 引言
在微流控芯片的众多应用中,研究者们更加关注其在生物医学研究方面特别是细胞分析领域中所发挥的作用,例如多细胞共同培养相互作用[1]、体外细胞微环境的构建与模拟[2]、单细胞分析[3]以及器官芯片[4]等。微流控芯片一直以成本低、稳定性好以及无毒等特点被广泛使用,其优点极大程度上符合生物医学对细胞等生物样品进行捕获、培养、实验、检测等操作。
在生物医学研究方面,细胞捕获和细胞培养一直以来是研究的热点,其是后续对细胞进行实验、分析、检测等操作的基础,因此芯片对细胞的捕获效率以及培养细胞的环境对细胞的危害程度是研究人员所关注的重点。由于芯片的特征尺寸与细胞和其他微生物实体的大小相近,因此更有利于对少量细胞甚至是单个细胞的操控和分析。根据单细胞捕获过程中细胞与表面有无接触可将单细胞捕获分为3类:(1)无表面接触捕获,例如磁力捕获[5]、电泳捕获[6];(2)表面接触捕获,主要包括化学法捕获[7]和流体动力学法捕获[8];(3)通过胶体(如水凝胶)的方式捕获[9]。基于流体动力学的单细胞捕获是根据细胞大小,在微流控芯片的微通道内设置与细胞大小相匹配的机械障碍,将细胞固定在某一区域内,从而达到分离细胞的目的。在微流控芯片内构建与细胞大小相近的单细胞捕获微阱阵列,然后通入含有大量细胞的悬浮液,细胞在流动过程中受到流体剪切力的作用会流向单细胞捕获微阱阵列中,在微阱阵列中的细胞由于受到微阱的阻挡作用从而实现单细胞捕获[10]。
本文设计了3种具有不同尺寸微坝的微流控芯片,由于流体流速会对细胞和芯片的捕获效率产生影响[11],故利用仿真软件分析比较了3种不同芯片中流体、流速的大小变化情况。通过流体流速的大小变化判断细胞的变形程度进而判断芯片的捕获效率,为之后的细胞捕获、细胞培养以及实验提供了参考。
1 微流控芯片设计
本文设计了一个集细胞捕获及细胞培养于一体的微流控芯片,细胞捕获区域即是细胞培养区域,加工芯片时更容易,操作更简单。从图1可以看出,带有细胞的悬浮液在注射泵的作用下从入口储液池以一定的流速进入芯片中,在压差作用下,流体进入捕获区域,在微坝的阻碍作用下,细胞会被固定住,与微坝尺寸不一的细胞则在流体的携带下流入出口通道,从出口通道流入出口储液池中排出。入口储液池设置深度为200μm,与细胞捕获区域连接的通道开在距其底部50μm,主要起到缓冲作用,让细胞悬浮液短暂停留,防止流体在进入细胞捕获区域时速度过快形成冲击,对细胞产生损坏。由于细胞捕获区即细胞培养区,细胞捕获完对细胞进行培养时,考虑到培养液在泵入细胞培养区时会产生冲击力,从而对细胞产生损害,为了尽量减少对细胞的损害,设计时选择将培养液从芯片侧面的入口储液池泵入,短暂停留,再流入细胞培养区,最后从出口储液池排出。为了使培养液均匀分布在细胞培养区,每一列微坝侧面都设置了培养液通道。因为培养液是从微坝侧面进入培养区,而被捕获的细胞停留在微坝内部,所以培养液对细胞所产生的冲击作用被降低了。

图1 芯片结构
由于细胞大小不一致,为了尽量防止细胞堵塞问题,微坝之间的距离应大于最大细胞尺寸[12],故根据成骨细胞被胰蛋白酶消化后的尺寸在10~40μm之间以及本身的形状,考虑选取微坝之间的间距为50μm,微坝下端口分别设置为10μm、20μm、30μm,微坝上端口均设置为50μm,如图2所示,排列方式如图3所示。

图2 3种微坝结构
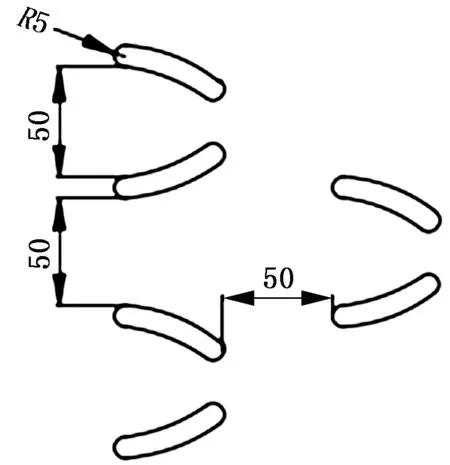
图3 微坝排列
2 细胞捕获和培养过程的流场仿真
2.1 几何模型
利用AutoCAD软件建立了微流控芯片中细胞捕获和培养过程二维简化几何模型,如图4~5所示。
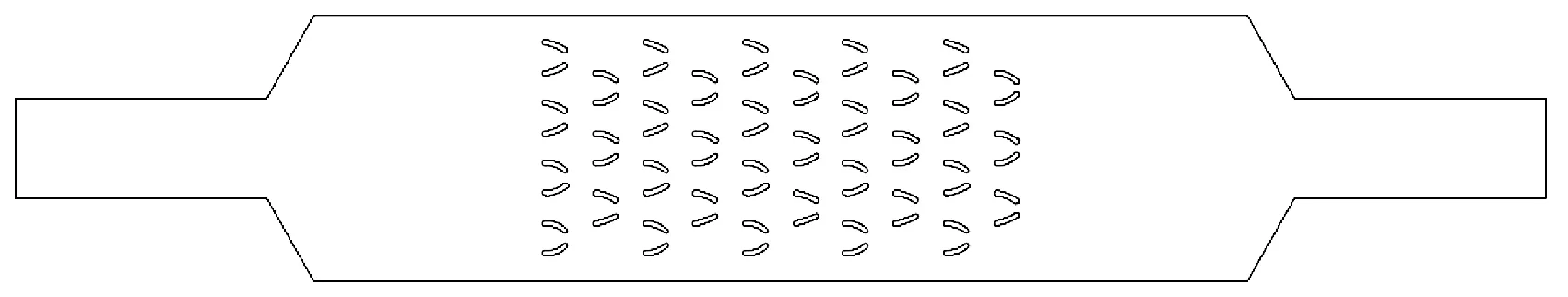
图4 细胞捕获过程二维简化几何模型
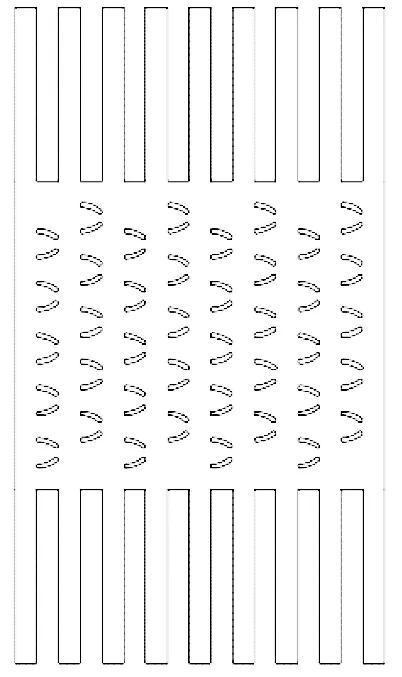
图5 细胞培养过程二维简化几何模型
2.2 流体动力学理论

2.3 细胞捕获和培养过程流场分析仿真初始条件设置
在Comsol中选择层流物理场,流体材料设置为水,壁面无滑移,入口流体流速设为0.01 m/s,出口处压强设为大气压强,即为0Pa。网格划分选择极细化,如图6所示。

图6 网格划分
2.4 仿真结果分析
2.4.1 细胞捕获过程仿真
仿真时,设置相同的初始条件,通过Comsol得到3种不同微坝芯片内部流场速度云图,如图7~9所示。

图7 下端开口10μm微坝芯片捕获过程内部流场速度云图

图8 下端开口20μm微坝芯片捕获过程内部流场速度云图
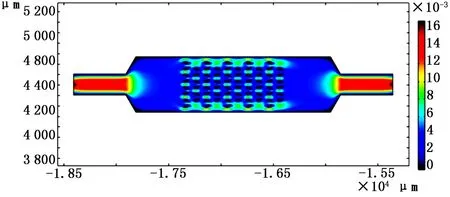
图9 下端开口30μm微坝芯片捕获过程内部流场速度云图
从图7~9中可以看出,3种芯片内部流场速度分布很均匀,微坝内部的速度明显低于周边的速度,利于细胞的捕获。从3种不同尺寸的微坝阵列中选取了前8列每列微坝的第2个(自下而上)微坝中的相同点,得到其在速度场中的数值,通过Origin将所得的数值整合成折线图,如图10所示,所选取的8个点在Comsol中的坐标如表1所示。微坝阵列中流体流速会影响单细胞完成捕获的时间和效率,也会影响流体对细胞产生的剪切力作用[16]。从图中可以得出:当初始条件相同时,在微坝阵列相同位置处,下端开口尺寸为10μm的微坝内部流速最低,流体对细胞产生的作用力最小,细胞变形程度最小,细胞最容易被留在微坝中,最有利于细胞捕获。

图10 3种不同尺寸微坝芯片捕获过程内部流场速度变化

相对位置a b c d坐标(-17 330,4 448.4)(-17 230,4 507.6)(-17 126,4 447.2)(-17 029,4 509.5)相对位置e f g h坐标(-16 928,4 446.4)(-16 829,4 507.6)(-16 729,4 446.2)(-16 630,4 506.5)
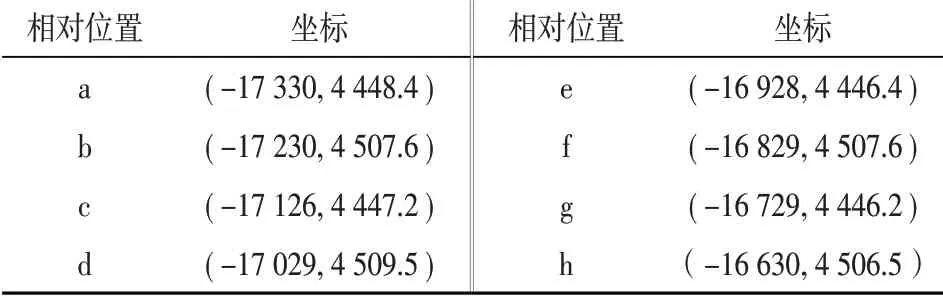
表1 捕获过程选取的坐标点
2.4.2 细胞培养过程仿真
仿真时,设置相同的初始条件,通过Comsol得到3种不同微坝芯片内部流场速度云图,如图11~13所示。
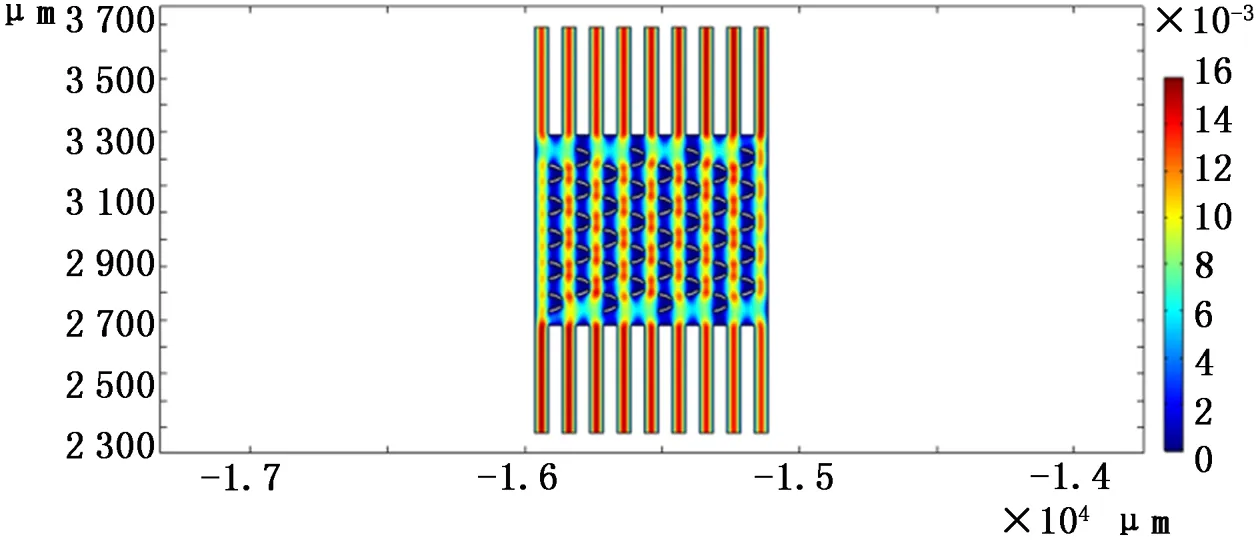
图11 下端开口10μm微坝芯片培养过程内部流场速度云图

图12 下端开口20μm微坝芯片培养过程内部流场速度云图
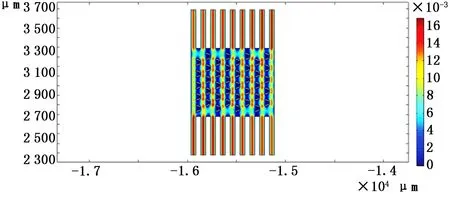
图13 下端开口30μm微坝芯片培养过程内部流场速度云图
从图11~13中可以看出,3种芯片内部流场分布很相似,微坝中的流速低于微坝周边的流速,利于细胞培养。从3种不同尺寸的微坝阵列中选取了每列微坝的第2个(自下而上)微坝中的相同点,得到其在速度场中的数值,通过Origin将所得的数值整合成折线图,如图14所示,所选取的8个点做Comsol中的坐标如表2所示。从图中可以看出:当初始条件相同时,在微坝阵列相同位置处,下端开口尺寸为10μm的微坝内部流速最低,流体对细胞产生的作用力最小,故流体对细胞的伤害程度最低,越有利于细胞培养。
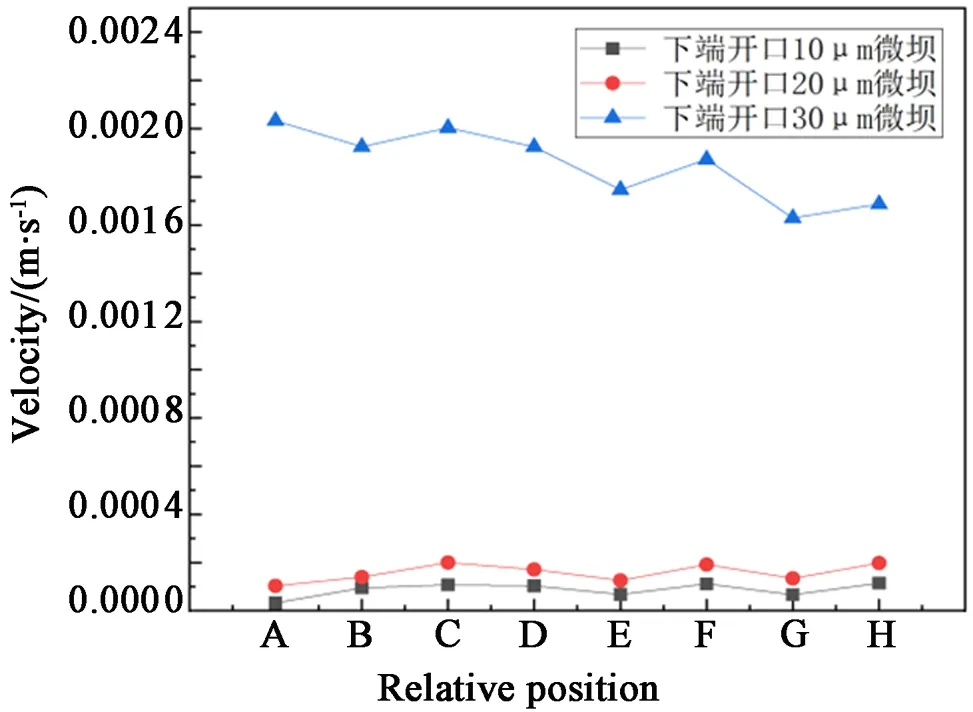
图14 3种不同尺寸微坝芯片培养过程内部流场速度变化
表2 培养过程所选取的坐标点
3 结束语
本文基于流体动力学设计了3种具有不同尺寸微坝结构的微流控芯片,用于对不同尺寸细胞的捕获与培养。着重通过Comsol软件对细胞捕获和培养过程中流场分布进行了模拟分析,得到芯片内部流场速度云图,比较分析了3种不同尺寸微坝阵列中相同位置点的流速,得出下端开口尺寸越小的微坝内部流速越低,流体对细胞产生的剪切力作用越小,更有利于细胞的捕获和培养,为之后的实验提供了参考条件,具有一定的指导意义。
