多发伤后脓毒症早期诊断生物标志物的研究进展
2021-11-23姬书青
姬书青,赵 伟
1.贵州医科大学,贵阳 550004;2.贵州医科大学附属医院急诊外科,贵阳 550004
创伤已经成为45岁以下青壮年死亡的主要原因[1-2],据世界卫生组织(WHO)的报告显示[3],创伤造成了全球10%的死亡和16%的伤残。在中国,每年因创伤死亡人数约70万人,占我国每年死亡人数的9%,创伤在死亡原因中已排至第三位[4]。多发伤作为严重创伤,是指由同一致伤因素造成的两个及以上解剖部位的创伤,且其中至少有一处危及生命。由于创伤部位组合差异,多发伤伤情危重且进展快,并发症多,易出现感染和器官功能障碍,临床病死率高[5-6]。尽管早期液体复苏、新型抗生素应用、重要器官功能支持等治疗取得显著进展,创伤即刻病死率显著下降,但院内感染发生率仍居高不下,而脓毒症作为创伤最常见并发症之一,是多发伤患者院内死亡的主要原因[7-8]。因此,对多发伤患者进行早期评估预测脓毒症的发生风险,并对筛选出的高危患者及早干预治疗,将有助于降低脓毒症的发生率和改善患者预后。
当前,生物标志物是针对创伤后脓毒症早期预警的重要手段之一[9]。近年来,随着多发伤后脓毒症预警诊断标志物的深入研究,大量新型的生物标志物被报道可应用于创伤后脓毒症的早期预测,但由于这些标志物缺乏较高的灵敏度或特异度,单独应用时诊断价值有限。目前多种生物标志物联合应用是创伤后脓毒症研究的热点及新方向。本文将对已研究的创伤后脓毒症预警生物标志物进展进行综述,以期为多发伤后脓毒症早期预测诊断提供应用参考。
1 急性期反应蛋白
1.1C-反应蛋白(CRP) CRP是由肝脏产生的一种非特异性急性时相反应蛋白,它通过在C1q复合物的补体激活中发挥作用;当发生炎症和感染时,CRP在2h内升高,并在48h内达到峰值,是临床广泛应用的炎症反应评价指标[10]。文大林等[11]研究显示,CRP对创伤患者脓毒症预警的曲线下面积(AUC)、灵敏度及特异度分别为0.766、44.55%和98.40%,说明血清CRP水平对创伤脓毒症发生风险有一定的预警价值,但其灵敏度有限。同时,由于CRP无法区分非感染性炎症和感染性炎症,在创伤时即有明显升高,因此它对创伤后脓毒症的诊断价值有限,需要联合其他指标提升预警效能[8,12]。
1.2降钙素原(PCT) PCT是由甲状腺滤泡旁C细胞生成和分泌的一种无激素活性糖蛋白,健康机体PCT水平处于极低状态(<0.1ng/mL),而在急性炎症反应时,其水平可在2~6h内迅速升高,并在6~24h达高峰。目前,PCT已成为脓毒症诊断中常用的生物标志物。近年来,国内外研究显示,PCT水平与创伤后脓毒症发生风险也存在相关性,对创伤后脓毒症的早期预警有一定价值[13]。一项回顾性分析显示[14],在预测创伤脓毒症发生风险中,当PCT临界值为0.47ng/mL时,诊断灵敏度为92.3%,特异度为68.7%。同时,动态监测PCT水平有助于创伤后脓毒症的早期诊断、评估病情[15]、判断预后[16]和指导抗生素应用[17]等。但也有研究指出,PCT水平和序贯器官衰竭评分(SOFA)、患者住院时间和病死率等方面没有较好的相关性,作为脓毒症诊断和预后的预测指标尚有不足,仍需结合其他指标综合应用[18-20]。
2 细胞因子及其趋化因子
2.1白细胞介素-6(IL-6) IL-6是多效细胞因子,由T/B淋巴细胞、内皮细胞等多种细胞合成、释放。它不仅对炎症细胞和血管内皮细胞有直接激活和毒性作用,还可诱导肝细胞合成急性期反应蛋白。当机体组织损伤和感染时,IL-6可迅速升高,并在2h内达到高峰,其水平可反映机体炎症和疾病严重程度。赵智刚等[21]研究发现,创伤患者血清IL-6水平在入院第1、4、7天时脓毒症组明显高于非脓毒症组,差异有统计学意义(P<0.05),证实IL-6水平在脓毒症的发生风险中有一定的预警效能。还有研究报道[22],IL-6对严重创伤并发脓毒症的预后有较好的预测价值,ROC曲线显示IL-6的AUC=0.62(0.45~0.92)。此外,动态监测IL-6水平也可用于评价抗生素治疗效果[23]。尽管当前研究显示IL-6在创伤后脓毒症患者的早期监测中有重要作用,而将其作为严重创伤患者并发脓毒症的早期预测标志物,仍需要大样本、多中心的研究佐证。
2.2白细胞介素-17(IL-17) IL-17是CD4+ T辅助细胞17(Th17)释放的标志性细胞因子,其表达受转录因子RAR相关的孤儿受体γ(RORγt)控制;它通过介导下游途径诱导炎症因子、趋化因子、抗菌肽(AMP)和重塑蛋白的产生。IL-17A在各种传染病、炎性和自身免疫性疾病中起着关键作用,最近研究表明,IL-17A也是脓毒症中的生物标志物和治疗靶标[24-25]。Ahmed等[26]在一项前瞻性队列研究中,通过对100例多发伤患者血清IL-17、IL-6及TNF-α的比较中发现,IL-17是唯一和脓毒症显著相关的生物标志物(脓毒症的血清IL-17中位数为72pg/mL,非脓毒症的IL-17中位数为37pg/mL,P=0.0001,调整后OR=3.2)。因此,血清IL-17水平的升高会增加多发伤患者感染并发症的易感性,是创伤后脓毒症早期预警的一种潜在生物标志物。
2.3高迁移率族蛋白B1(HMGB1) HMGB1是一种非组蛋白DNA结合蛋白,它在细胞核中调控DNA的转录、复制、修复和核小体的形成,在细胞外则具有细胞因子及趋化因子等生物学特性。当前,HMGB1已被证实是系统性炎症中重要的促炎细胞因子,在包括创伤、脓毒症及多器官功能障碍综合征的患者中表达均有升高,被认为是一种脓毒症早期诊断的潜在生物标志物[27-29]。一项将HMGB1作为预测创伤后脓毒症的前瞻性队列研究显示[30]:严重胸部创伤患者血清HMGB1显著升高,在创伤后第3、5、7天与非脓毒症和非多器官功能障碍综合征(MODS)相比,脓毒症和MODS组患者血清HMGB1水平差异均有统计学意义;多元回归分析显示HMGB1水平是严重创伤患者并发脓毒症和MODS的独立危险因素[95%CI:1.89(1.25~2.91),1.78(1.03~2.87)]。曾方政等[31]研究发现,动态监测创伤患者血清HMGB1水平对疾病危重程度和预后风险具有显著的临床意义,当创伤后第5天HMGB1表达量>8.43ng/mL、第7天表达量>7.11 ng/mL时具有良好的预测意义。
3 细胞表面标志物
3.1可溶性髓样细胞触发受体-1(sTREM-1) TREM-1是中性粒细胞和单核细胞上选择性表达的免疫球蛋白家族成员,在非感染性炎症中TREM-1低表达,而在细菌和真菌感染时TREM-1的表达显著上调。sTREM-1是分泌型TREM-1的亚型,由细胞表面脱落并释放到血液等体液中,其水平升高有助于脓毒症的诊断[32]。Chang等[33]在2020年发表的Meta分析发现,血清sTREM-1水平对脓毒症具有中等诊断价值,该分析纳入19项研究,共2 418例患者,合并的灵敏度和特异度分别为0.82(95%CI:0.73~0.89)和0.81(95%CI:0.75~0.86)。还有研究显示[34],当sTREM-1对脓毒症诊断的截断值为125.00pg/mL时,其灵敏度和特异度分别为86%和87%,诊断效能优于PCT和CRP。此外,还有研究表明:在多发伤患者中,血清sTREM-1水平和脓毒症的发生密切相关,可作为创伤后脓毒症的早期预警标志物[35-36]。
3.2可溶性CD14亚型(Presepsin) 可溶性CD14亚型(sCD14-ST)又称为Presepsin,是脂多糖-脂多糖结合蛋白(LPS-LBP)的特异性受体,属于单核细胞和巨噬细胞表面表达的一种多功能糖蛋白。Presepsin由LPS-LBP-CD14复合物从细胞膜CD14脱落释放,并经组织蛋白酶D等裂解后产生。正常情况下sCD14-ST水平很低,当感染发生时,Presepsin可在2h内特异性增加,3h达到峰值,4~8h下降。目前研究认为,Presepsin是脓毒症早期诊断、预后评估敏感且特异的生物标志物[37-39]。Chen和Zhu[34]研究显示,当Presepsin诊断脓毒症的横截值为1025.00pg/mL时,其诊断灵敏度为85%,特异度为83%,AUC为0.910,高于PCT和CRP。Koch等[40]研究发现,创伤早期的感染和创伤后1周内的延迟免疫反应均不影响Presepsin水平,因此在早期诊断创伤后脓毒症中它是一种很有前途的生物标志物。但Presepsin在创伤后脓毒症早期诊断是否仍具有较好的灵敏度和特异度,还需进行大样本、多中心前瞻性研究和临床验证。
3.3可溶性尿激酶型纤溶酶原激活物受体(suPAR) 尿激酶型纤溶酶原激活物受体(uPAR)是一种糖基磷脂酰肌醇锚定蛋白,主要在单核巨噬细胞、中性粒细胞和活化T淋巴细胞上表达,它通过结合尿激酶、整合素、低密度脂蛋白受体等多种配体参与细胞迁移黏附、免疫活化、信号转导、组织损伤修复等病理生理过程[41]。在生理条件下,uPAR水平较低,当机体受到炎症刺激时,uPAR表达迅速上调,并经蛋白酶水解后形成suPAR。脓毒症患者suPAR水平明显高于非脓毒症组,已被证实是脓毒症诊断的有效生物标志物[42-43]。Pregernig等[44]在2019年发表的Meta分析发现,suPAR在脓毒症存活患者中显著低于死亡患者,最佳临界值为5.2ng/mL(95%CI: 4.5~6.0),表明suPAR对脓毒症患者不良预后有较好的评估价值。Huang等[45]在2020年发表的另一项Meta分析显示,suPAR是用于脓毒症早期诊断和评判预后可靠的生物标志物,其中纳入30项研究共6 906例患者,suPAR诊断脓毒症的灵敏度为0.76,特异度为0.78,AUC为0.83;而在预测病死率的合并灵敏度、特异度及AUC分别为0.74、0.70、0.78;同时,该Meta分析还发现,suPAR不仅和PCT具有相似的临床指导价值,还具有更高的特异度。而在早前的研究中也发现,suPAR可以预测多发伤后的病程,是预测多发伤后脓毒症和多器官功能障碍发生风险的生物标志物[46]。
4 遗传生物标志物
4.1表观遗传学标志物 表观遗传机制在调节炎症和其他免疫过程中的作用越来越明显,最新证据表明,随着脓毒症的发生和进展,表观遗传机制受到广泛的干扰,尤其是在内皮功能障碍和免疫抑制中发挥了重要作用。表观遗传机制包括DNAm、组蛋白修饰(乙酰化、磷酸化、甲基化等)和非编码RNA,表观遗传修饰的重编辑性质与表观遗传酶对抑制剂治疗的反应性也为脓毒症治疗提供了具有巨大潜力的途径[47]。
DNAm是免疫系统的重要调节剂,它可能通过造血祖细胞的表观遗传重编程驱动脓毒症的免疫抑制[48]。Lorente-Sorolla等[49]研究发现,脓毒症患者中单核细胞异常的DNAm和IL-6、IL-10水平及SOFA评分相关。Binnie等[50]和Lorente-Pozo等[51]的研究均表明DNAm可以作为脓毒症的标志物。
循环游离细胞DNA(cf-DNA)是细胞坏死、凋亡后产生的无细胞状态的胞外DNA片段,主要包括线粒体DNA(mtDNA)和核DNA两种类型。近年来,cf-DNA已成为脓毒症研究中备受关注的生物标志物。孟强等[52]研究发现,脓毒症患者cf-DNA浓度显著高于非脓毒症患者,其水平和病情严重程度和病死率密切相关,对脓毒症的临床诊断和预后评估有较大价值。同时,Yan等[53]研究显示,脓毒症组的血浆mtDNA水平明显高于非脓毒症组,ROC曲线分析提示mtDNA的AUC为0.726,灵敏度和特异度分别为88.5%和53.6%,mtDNA是脓毒症诊断和预后的合适生物标志物。进一步深入研究cf-DNA释放机制和其在细胞外环境中的功能可能会为预防脓毒症进展及多器官功能障碍提供新的策略。
微小RNA(MicroRNA)是一类由20~25个核苷酸组成的内源性非编码RNA,它主要通过影响功能基因的表达,在炎症反应、免疫细胞分化与凋亡、免疫抑制等方面调控脓毒症的发生及进展[54]。当前研究已证实循环MicroRNA可以作为脓毒症诊断和预后评估的生物标志物[55]。同时,也有研究表明,MicroRNA-146a、MicroRNA-150、MicroRNA-233、MicroRNA-486、MicroRNA-182、MicroRNA-340、MicroRNA-324-3p、MicroRNA-16、MicroRNA-210、MicroRNA-15b、MicroRNA-484、MicroRNA-486-5p等在多发伤后脓毒症患者中的表达发生显著变化,可以作为创伤后脓毒症诊断和预后的生物标志物[56]。然而,由于MicorRNA在检测中缺乏标准化的样本收集和数据统计分析等,尚未在临床应用。如果未来能寻找到更加优化的检测手段,MicorRNA用于诊断、评估和优化创伤脓毒症治疗中将会是一个很好的生物标志物。
4.2基因多态性 基因多态性是机体对疾病易感性、疾病表型和药物治疗反应差异性的原因之一。创伤虽与机体遗传背景无关,但由创伤诱发的机体反应,尤其是决定脓毒症和多器官功能障碍的炎症级联反应却和遗传因素十分密切。当前涉及到的与创伤后脓毒症易感性的基因多态性主要有肿瘤坏死因子(TNF)、IL、HMGB1、Toll样受体(Toll)、脂多糖结合蛋白(LBP)、糖基磷脂酰肌醇锚定蛋白(CD14)、髓样分化蛋白2(MD2)、糖基化终末产物受体(RAGE)、核苷酸结合寡聚化结构域样受体(NLR)、糖皮质激素受体(GR)等[8]。近期一项涉及172个脓毒症易患性基因的405个基因多态性位点的Meta分析显示,这些基因多态性位点主要位于内含子区(36.79%)、外显子区(27.90%)、启动子区(20.49%)等基因的上游,其中位于外显子区的单核苷酸多态性位点(SNP)主要分为错译突变和同义编码突变;分析进一步指出,大多数基因多态性位点主要位于6号染色体[57]。Vivas等[58]报道称IL-10-1082G/A多态性的AA基因型患者发生脓毒症的风险明显增加(OR=4.8,95%CI=1.652~13.944;P=0.002),这与既往研究结果一致。尽管国内外关于创伤后脓毒症易感基因多态性的研究日渐增多,但这些研究大都存在着样本量较小、研究人群较单一等局限性,未来仍需在多中心、大样本的人群中进行重复和验证研究结果准确性[59]。
5 其他相关生物标志物
除上述已介绍的生物标志物外,当前还报道了血管内皮损伤相关标志[可溶性血管内皮生长因子受体-2(sVEGFR-2)[60]、多配体蛋白聚糖-1(Syndecan-1)[61]、中区域肾上腺髓质素原(MR-proADM)[62]]、凝血相关标志物[活化部分凝血酶原时间(APTT)[63]、抗凝血酶Ⅲ(AT-Ⅲ)[64]]、免疫生物标志物[调节性T细胞(Treg)[65]、B/T淋巴细胞衰减因子(BTLA)[66]]等与脓毒症早期诊断相关,是创伤后脓毒症的潜在生物标志物。同时也发现一些新的有望成为创伤后脓毒症的潜在预测生物标志物,如泛酰巯基乙胺酶(Vanin-1)[67]、可溶性纤维蛋白2(sFGL2)[68]、胰腺结石蛋白(PSP)[69]等。然而这些研究大多数当前仍缺乏大样本、多中心的验证(表1)。

表1 创伤脓毒症其他相关生物标志物研究概况
6 多种生物标志物联合
创伤脓毒症的发生是多种炎症介质、细胞因子、神经递质和激素等效应分子共同作用下的综合性病理生理过程,这也导致创伤脓毒症潜在的生物标志物种类极多,而成功的生物标志物应当具有“高灵敏度、特异度及便于检测等”条件,但目前发现多数生物标志物在临床诊断脓毒症中未能展现足够的准确性。先前的研究发现,标志物组合有利于提高脓毒症诊断和预后预测的准确性。此外,Logistic回归模型联合多指标建立新的预测因子在肿瘤、心血管疾病等领域的诊断得到广泛应用,这也为脓毒症的早期预警提供了新的思路。在创伤后脓毒症早期预警相关研究中,多因素联合使用均优于单独指标的诊断效能,但在联合指标的应用研究中,大多数局限于单中心、小样本,其预警效能受一定限制,当前仍需大样本、多中心的验证(表2)。
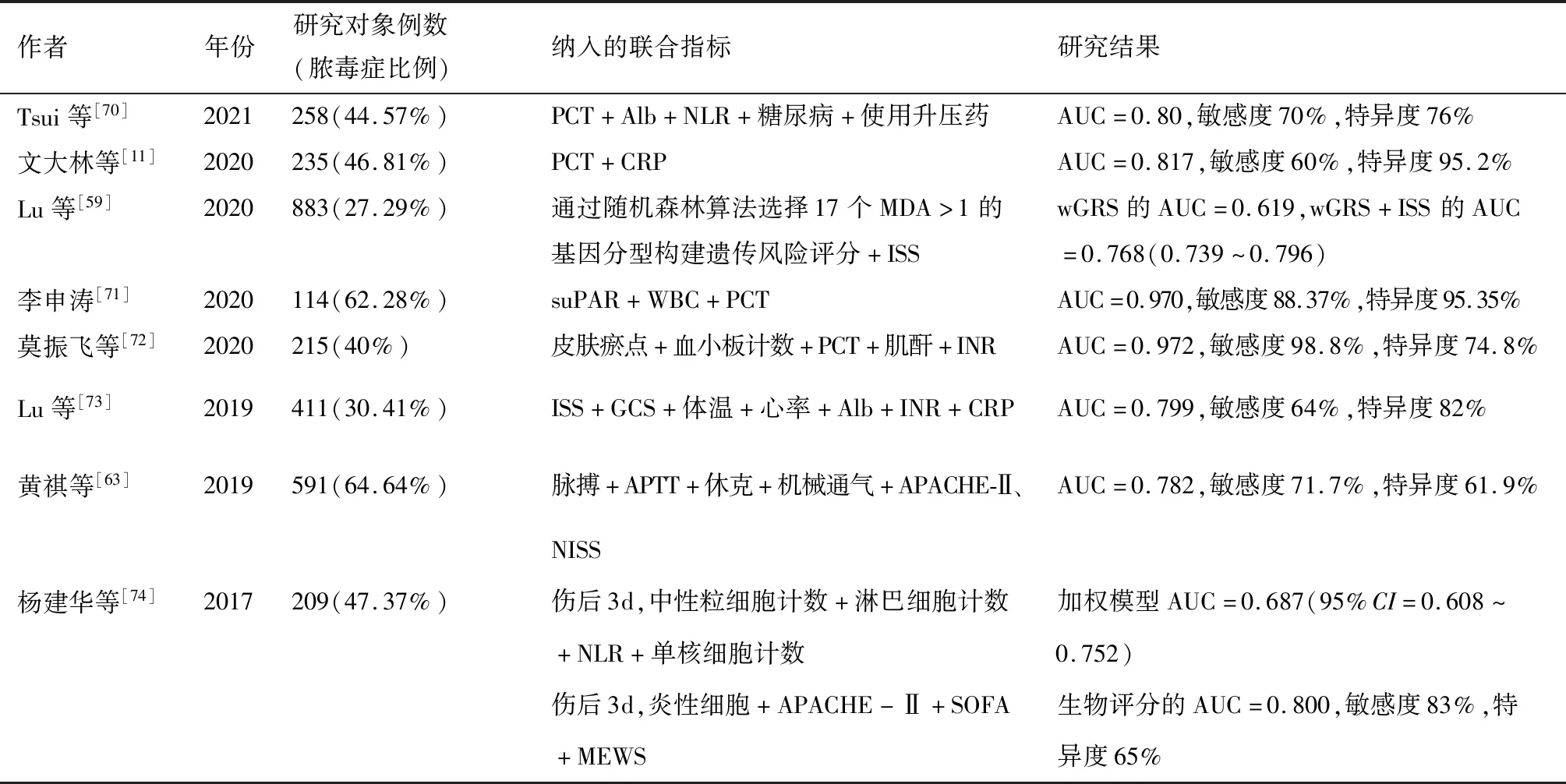
表2 多因素创伤后脓毒症早期预警模型研究概况
7 展望
目前多发伤后脓毒症的早期诊断仍面临着巨大的挑战,虽然大量新型生物标志物被发现可用于创伤后脓毒症的诊断,但在临床实践中,这些生物标志物仍存在诊断效能不高或检测复杂等不足,很难在临床广泛应用。此外,单一的生物标志物很难对脓毒症作出高效且精准的预警及预后预测。目前研究发现,多指标生物标志物联合应用可在多发伤后脓毒症的早期诊断中取得较好的预警价值,并且联合预测指标的诊断效能优于单一生物标志物。当前联合预测纳入的协变量大多集中于患者的人口基线信息、生化指标及创伤严重度评分等方面,且多为回顾性研究,在创伤人群适用性有待进一步的验证与提升。因此,多指标生物标志物作为当前和未来一段时间内应用和研究的热点,下一步需要挖掘更多的有效生物标志物,同时可以拟合患者自身遗传因素等极具特征性的标志物构建创伤后脓毒症多指标联合预警模型,以提升预测诊断的灵敏度和特异度等。同时,还需开展多中心、大样本、前瞻性的外部验证试验,并进一步调整和优化联合预警模型。基于大数据分析筛选出多发伤等严重创伤后并发脓毒症的高危患者,及时进行精准干预,改善患者预后。
