射频消融辅助保脾术治疗创伤性脾破裂的疗效
2021-11-23王威,夏辉
王 威,夏 辉
武汉市第一医院肝胆外科,武汉 430022
脾脏是人体最大的免疫器官,其实质主要包括白髓、红髓与边缘区三个部分,分别是机体发生特异性免疫反应、免疫细胞产生吞噬作用、脾内捕获与识别抗原并诱发免疫应答的主要场所。由于脾脏血管网络走行复杂,但其生物结构质地较为脆弱,在外力作用下极易损伤甚至破裂,如不及时救治可能发生出血性休克而致死[1]。文献报道,创伤性脾破裂占腹腔实质脏器损伤的26%~40%,且近年来有逐步上升趋势[2-3]。既往观点认为,脾脏属于非必须生命器官,故对创伤性脾破裂可考虑手术切除脾脏。近年来,越来越多的研究发现脾脏具有造血、储血及滤血等作用,在机体免疫调节、抗肿瘤及抗感染等生理功能中发挥着重要作用,脾脏切除不仅创伤大,且将导致术后免疫功能急剧下降,增加全脾切除术后凶险性感染(overwhelming post-splenectomy infection,OPSI)等并发症的发生风险[4]。因此,目前多主张对一般情况良好、血流动力学稳定患者谨慎采取保脾术治疗,但由于脾脏血运丰富,即便是保脾术也具有较高的出血及OPSI风险,影响术后免疫功能康复甚至危及生命[5]。射频消融术是一种物理凝固技术,可通过热效应固化组织而发挥止血目的,近年来其在外科领域取得了较大进展[6]。本研究2017年1月—2020年6月尝试在创伤性脾破裂患者的保脾术中应用射频消融技术,获得良好效果。
临床资料
1 一般资料
纳入标准:(1)年龄18~65岁,能够耐受麻醉及手术;(2)具有明确腹部创伤史,经超声和(或)CT检查证实为创伤性脾破裂;(3)闭合性腹部创伤;(4)受伤至手术时间≤72h;(5)经对症治疗后生命体征平稳,能够耐受手术。排除标准:(1)存在严重合并伤,如多发性肋骨骨折、血气胸、脊髓损伤;(2)合并其他腹腔脏器损伤、病理性脾脏而接受手术治疗及非创伤原因所致脾破裂;(3)迟发性脾破裂;(4)严重脾损伤,需行脾脏切除术;(5)合并严重腹腔感染;(6)合并严重心、脑、肝、肺、肾等器质性疾病、血液系统疾病;(7)既往腹部手术史;(8)长期使用免疫抑制剂。
本组80例患者,男性58例,女性22例;年龄22~49岁, 平均39.4岁;致伤原因:道路交通伤31例,高处坠落伤30例,击打伤19例。按术式不同分为两组:44例行射频消融辅助保脾术治疗为射频组,36例行传统保脾术为传统组。两组患者在性别构成、年龄、脾破裂CT分级[7]、致伤原因等方面经检验,差异无统计学意义(P>0.05)。见表1。
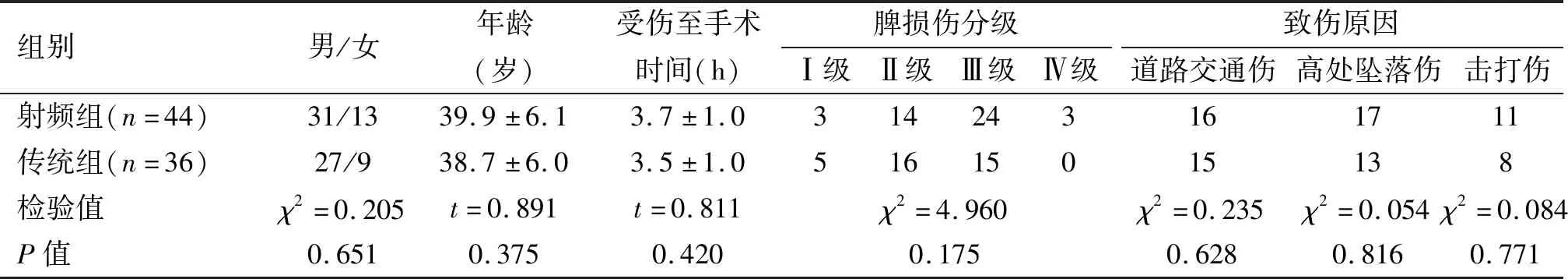
表1 两组患者一般资料比较
2 手术方法
术前均给予常规急救治疗,稳定生命体征。完善血常规、腹部超声及CT等检查,并探查腹腔情况,确定患者的脾损伤程度并明确是否具有保脾条件。常规胃肠减压,建立有效静脉通道,气管插管全身麻醉,术区消毒、铺巾,手术均由同一团队完成。
射频组行射频消融辅助下保脾术,射频消融仪为美国美敦力公司生产的cool tip RF system。患者取头高脚低30°、右侧倾斜30°体位,以充分暴露脾脏。经脐缘上及左中腹建立1~2cm切口,建立CO2气腹(12~14mmHg),分别置入10mm穿刺套管;再经剑突下与左腋前线肋缘建立戳孔分别置入5mm穿刺套管。腹腔镜下探查腹腔情况,将腹腔内积血清除。显露破损部位,采用多极射频消融仪浅插或靠近裂口0.5cm部位进行射频止血,必要时可在创面射频止血后以刀片修整创面后,再垂直插入创面内实施射频消融。Ⅰ、Ⅱ级损伤者,不予阻断脾蒂血管,直接在脾脏裂口处插入射频电极进行消融处理,插入深度超过裂口深度0.5cm,确认无渗血后拔除电极,裂口覆盖大网膜片修复;Ⅲ、Ⅳ级损伤者,如无大面积组织失活,则于受损周围正常脾组织垂直插入消融电极1~4cm进行射频消融,插针间隔控制为1~2cm,产生一条完整的凝固缺血带,经此缺血带以剪刀离断或切开以部分切除脾脏,将切除组织移出。放松脾脏,充分止血并确认无活动性出血点后,冲洗术区与腹腔,再次探查确认无其他脏器损伤,行脾部分切除者留置引流管,关闭腹腔。
传统组不予射频消融,腹部戳孔及探查方式等操作同射频组,腹腔镜下探查破损情况及解剖关系后,仅根据脾脏损伤程度给予保脾术治疗,脾损伤分级为Ⅰ、Ⅱ级者,先进行胰腺上缘解剖,充分显露脾动脉并予临时阻断,于采用止血材料给予黏合、压迫或缝合修补,缝合至脾脏裂口基底部,采用大网膜作为缝垫,注意避免过度牵拉;脾损伤Ⅲ、Ⅳ级患者给予脾部分切除,先于胰腺上缘解剖,充分显露脾动脉主干后予以结扎,再游离脾周韧带以充分显露脾门,采用直线切割闭合器自脾蒂离断后将脾脏部分切除。生理盐水冲洗术腔,检查确认无活动性出血点后,留置引流管,逐层关闭切口。两组术后常规给予抗生素抗感染治疗2d,积极纠正休克,维持水电解质及酸碱平衡。术后第1天开始进流质饮食,此后逐步恢复普食。
3 观察指标
观察记录两组的手术相关指标,包括手术时间、术中出血量、术后24h引流量、首次排气时间、住院时间及保脾成功率;统计住院期间并发症发生情况,包括感染、术后出血、血栓形成等;分别于术前及术后3、7、14、30d,晨取空腹静脉血采用全自动细胞计数仪检测血小板计数(platelet count,PLT);术前及术后30 d血液标本采用放射免疫分析法检测血清Tuftsin因子,采用血清蛋白醋酸纤维膜电泳法检测血清免疫球蛋白(immunoglobulin,Ig)A、IgG、IgM,由固定检验人员严格按照试剂说明书执行。正常参考值范围:IgA为0.71~3.35g/L,IgG为7.6~16.6g/L,IgM为 0.48~2.12g/L。
4 统计学分析
应用Excel 2016进行数据汇总,应用SPSS 22.0统计软件进行分析。研究资料中的计量数据,均通过正态性检验。两组间的比较为成组t检验或校正t’检验(统计量为t),组内前后比较为配对t检验(统计量为t)。重复观测资料行重复测量方差分析(统计量为F)+两两组间比较LSD-t检验(统计量为LSD-t)+两两时间比较差值t检验(统计量为t)。计数资料以例数及率描述,两组比较为卡方检验或校正卡方检验(统计量为χ2)或精确概率检验(无统计量)。统计检验水准α=0.05,均为双侧检验。重复测量分析的多次比较按Bonferroni校正法进行检验水准调整,α’=0.05/n,n为多次比较的次数。P<0.05为差异有统计学意义。
结 果
1 两组患者手术相关指标比较
射频组手术时间、术中出血量、术后24h引流量、首次排气时间、住院时间均少于传统组,保脾成功率高于传统组(P<0.05)。见表2。
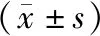
表2 两组手术相关指标比较
2 两组术后输血率及并发症发生情况比较
两组术后均无腹腔内感染、腹腔积液、胰漏及胃漏等严重并发症,无切口感染及切口脂肪液化。CT复查显示残脾无缺血性坏死,射频组未见脾热、脾静脉血栓形成、脾窝积液及脾动-静脉瘘,传统组2例脾静脉血栓形成。射频组术后输血率及总并发症发生率均低于传统组(P<0.05)。见表3。

表3 两组术后输血率及并发症发生情况比较[n(%)]
3 两组患者手术前后PLT比较
术前,两组PLT比较,差异无统计学意义(P>0.05);术后3d两组均显著升高,术后7d达峰,此后逐步下降,组间比较差异无统计学意义(P>0.05)。见表4。

表4 两组手术前后PLT比较
4 两组手术前后免疫球蛋白及Tuftsin因子水平比较
两组患者术前IgA、IgG、IgM及Tuftsin因子水平比较差异无统计学意义(P>0.05);术后,射频组下降不明显(P>0.05),传统组较术前显著降低(P<0.05)。见表5。
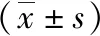
表5 两组手术前后免疫球蛋白及Tuftsin因子水平比较
讨 论
脾脏含淋巴组织约为全身淋巴组织总量的25%,不仅有丰富的淋巴、巨噬细胞,且具有丰富的血管网络,具备储存血液与血液虑过等功能,在机体应激情况下可迅速为外周器官供血,有“人体血库”之称,但在遭受外力时极易破裂出血[8]。创伤性脾破裂是腹部创伤中最常见的实质性脏器损伤,由于具有突发性,且病情凶险、进展迅速、并发症多,救治难度较大,患者死亡风险较高[9]。轻度脾破裂多考虑非手术治疗,但对伤情严重的脾破裂,手术仍是挽救患者生命的首选治疗手段[10]。全脾切除术曾是临床治疗创伤性脾破裂的唯一外科治疗手段,但全脾切除术后可能引起诸多并发症,如腹腔内出血、OPSI等[11]。文献报道显示,全脾切除术后OPSI发生率1.45%~4.4%,而一旦发生OPSI病死率可高达50%~80%[12-13]。另有研究显示,切除脾脏后血栓事件发生风险将明显升高,胃底食管曲张静脉破裂出血患者切除脾脏后门静脉血栓发生率高达31%,约为保脾患者的3.1倍[14]。随着人们对脾脏功能重要性及全脾切除术后并发症或危害等研究的深入,创伤性脾破裂的外科治疗策略已经逐步转变,越来越多外科医师主张对合适的创伤性脾破裂患者采取保脾术治疗,但目前仍缺乏统一标准[15]。因此,如何正确选择创伤性脾破裂的治疗方案已成为临床医师亟待解决的问题。
选择性保脾是当前创伤性脾破裂外科治疗的共识,强调在确保患者生命安全的前提下,对一般状态较好、年轻患者优先考虑保脾治疗手段,并预防延迟性脾破裂。目前,临床常用保脾技术较为多样,如使用生物胶黏合或缝合修补、选择性脾动脉栓塞或脾部分切除等,术者可根据患者的脾损伤程度开展一种或多种保脾手段,但术中如何彻底处理脾脏破口或创面再出血仍是临床治疗的难题[16]。尤其是对Ⅲ、Ⅳ级脾损伤患者,常规行脾部分切除前需先处理脾门血管,再以钳夹法将脾脏夹断,而脾脏解剖结构特殊,其血供丰富且存在广泛侧支循环,脾破裂后腹腔内积血较多,术中止血困难,可能因视野不清、辨别脾门血管困难等增加手术难度及风险,患者常因血管破裂大出血导致保脾失败[17]。射频消融术属于物理凝固止血技术,其射频功率可达250W,将电极针插入组织后即刻产生热凝固性效应,可使局部1.5cm范围内脏器实质组织凝固性坏死,从而达到彻底止血的效果[18]。目前,有研究将射频消融术应用于肝叶切除、脾部分切除术中,证实其可有效减少出血并发症[19-20]。
本研究中,射频组的手术时间及术后首次排气时间、住院时间均较传统组明显缩短,术中出血量及术后24h引流量较传统组明显降低(P<0.05),保脾成功率达97.73%,较传统组的83.33%明显提高(P<0.05)。与此同时,射频组的输血率仅为6.82%,较传统组的25.00%明显降低,而术后并发症发生率亦较传统组降低(4.54%vs.22.22%)。分析其原因为常规保脾术在脾脏缝合时需注意缝合宽度、深度以及打结力度,预防风险撕裂或切割伤所致新发出血,对术者操作技术要求较高,且术后再出血风险较高。而术中利用射频消融辅助可直接进行创面完全止血,几乎可避免术后再出血。同时,使用射频消融直接固化创面,无需离断脾脏周围韧带,并可减少对脾脏的反复牵拉、挤压,简化了断脾过程,可降低保脾术难度,节约手术时间并减少手术创伤。监测PLT显示,两组术后PLT水平均较术前升高,术后7d时达到峰值,考虑与脾损伤或脾部分切除后其侧支循环受损,血液储存、滤过功能下降有关,但术后14、30d时PLT逐步恢复,且两组间比较差异并无统计学意义(P>0.05),这与肖琳等[21]报道相符。提示射频消融辅助保脾术治疗创伤性脾破裂并不增加血栓形成风险。
手术创伤对机体免疫功能具有一定的干扰,而脾脏作为人体最大的免疫器官,其损伤势必影响机体免疫功能。同时,脾脏属于富血流脏器,其血循环量约占体循环血量的1/4,直接参与机体细胞免疫,并可通过调节免疫球蛋白的表达而参与体液免疫[22]。Tuftsin 因子是由脾脏生成的一种生物活性肽激素,可诱导促吞噬激素的生成而增强巨噬细胞的吞噬功能,且具有抗感染作用,被认为是反映脾脏功能状态的特异性指标[23]。本研究中,两组术后IgA、IgG、IgM及Tuftsin因子水平均有不同程度的下降,但射频组仍显著高于传统组(P<0.05)。证实射频消融术辅助保脾术治疗创伤性脾破裂可能更有利于保护患者的免疫功能,这与其脾脏功能保护更佳有关,免疫功能的维持更有利于预防感染相关并发症。本研究中,两组均未发生OPSI,但射频组肺部感染率仍有降低趋势,可能是由于射频消融术的应用降低了保脾术的难度,止血彻底,尽可能地保留了脾脏组织及其功能,术后康复更快,故术后感染等并发症发生风险降低。但本研究中,射频组的治疗费用较传统组高了0.6万元左右,考虑为射频消融术具有特殊设备要求,故可能导致医疗费用增加,其在基层医疗单位的推广可能仍有局限。
综上所述,对生命体征稳定且符合指征的创伤性脾破裂患者采用射频消融术辅助保脾术治疗效果确切,较常规保脾术可获得良好的术中及术后止血效果,有效减少手术时间与术中出血量,缩短术后康复时间,降低术后并发症发生风险,对PLT无明显干扰,且可能更有利于保护脾功能及免疫功能,降低术后并发症发生风险。但本研究样本较小且非前瞻性随机对照研究,其具体应用价值仍需进一步深入研究。
