不同温度条件下生鲜乳中嗜冷菌菌群结构多样性研究
2021-11-22曹慧慧闫艳华王磊庞学良董李学汤学英林田
曹慧慧,闫艳华,王磊,庞学良,董李学,汤学英,3,林田,3
(1.唐山市食品药品综合检验检测中心,河北省农产品质量安全检测技术创新中心,河北唐山 063000;2.唐山市功能性农产品产业技术研究院,河北 唐山 063000;3.唐山市功能性农产品产业技术研究院,河北 唐山 063000)
0 引言
生鲜乳质量是保障乳制品品质的关键环节[1],新鲜生乳通常被认为是无菌的[2-3]。冷藏贮运过程中嗜温菌大幅减少,但嗜冷菌仍能保持生长繁殖活力,进而造成原料乳中微生物菌群结构发生变化[4]。原料乳中的嗜冷菌菌群与牧场卫生环境包括基础设施、挤奶设备、挤奶方式等密切相关[5-6],另外,收奶过程中,运奶罐中的温度波动也会影响原料乳中嗜冷菌的多样性[7]。研究表明,贮存温度与时间是影响生鲜乳中嗜冷菌多样性的重要因素[8]。嗜冷菌是影响乳品品质的重要因素之一,其产生的胞外蛋白酶和脂肪酶具有一定的耐热性,即使高温灭菌后仍能保持部分活性,对长期保存的乳及乳制品持续破坏,造成巨大损失[9-13]。
1 实 验
1.1 样品采集与处理
样品采集于河北省唐山地区的规模化奶牛养殖场,新鲜采集的生鲜乳样品分为10 个部分进行不同处理,每个处理3 个生物学重复:直接冻存-80 ℃的生鲜乳(M.1,M.2,M.3);10 ℃储存1d 的生鲜乳(F1.1,F1.2,F1.3)、10 ℃储 存2 d 的生鲜乳(F2.1,F2.2,F2.3)、10 ℃储存3 d 的生鲜乳,(F3.1,F3.2,F3.3);4 ℃储存1 d的生鲜乳(T1.1,T1.2,T1.3)、4 ℃储存2 d的生鲜乳(T2.1,T2.2,T2.3)、4 ℃储存3 d 的生鲜乳(T3.1,T3.2,T3.3);15 ℃储存1 d 的生鲜乳(Y1.1,Y1.2,Y1.3)、15 ℃储存2 d 的生鲜乳(Y2.1,Y2.2,Y2.3)、15 ℃储存3 d 的生鲜乳(Y3.1,Y3.2,Y3.3);处理后的生鲜乳样品取15 mL 于样品采集管中,每个处理3个生物学重复,共计30个样品,液氮中保存送测序。
1.2 样本DNA 提取和PCR 扩增
使用细菌DNA 抽提试剂盒(E.Z.N.A.Stool DNA Kit,Omega),按照试剂盒说明书进行细菌总DNA 抽提,DNA 模板保存于-20 ℃冰箱备用。取质量合格的基因组DNA 样品30 ng及对应的融合引物配置PCR反应体系,设置PCR反应参数进行PCR扩增。
1.3 文库构建及测序
使用Agencourt AMPure XP 磁珠对PCR 扩增产物进行纯化并溶于洗脱缓冲液(Elution Buffer)中,贴上标签完成建库。使用Agilent 2100 Bioanalyzer 对文库的片段范围及浓度进行检测。设计合成引物,见表1。以检测合格的样本DNA 为模板,扩增16S rDNA 基因的V3~V4 区,磁珠筛选目的Amplicon 片段,最后用合格的文库进行Cluster 制备和Paired-end 测序。用下机得到的数据进行相应的生物信息学分析[14]。

表1 16S rDNA基因的V3~V4区域扩增引物
1.4 序列拼接及数据处理
Illumina 平台下机数据经过滤,滤除低质量的序列,剩余高质量的有效序列,有效序列可用于后续分析[15];使用FLASH(v1.2.11)软件将双末端测序得到的成对序列,利用Overlap 重叠关系组装成一条序列,得到高变区的标签序列(Tags),拼接条件为最小匹配长度15 bp 和重叠区域允许错配率为10%,去除没有重叠关系的序列[16];利用USEARCH(v9.1)在97%的相似度下对拼接好的有效序列进行聚类,然后通过RDP classifer(v2.2)软件将OTU 代表序列与Green⁃gene 数据库比对,对OTU 进行物种注释[17-19];基于OTU 和物种注释结果进行样品物种复杂度分析以及组间物种差异分析。
2 结果与分析
2.1 测序数据统计及OTU组成分析,序列的拼接与组装
测序数据统计结果如表2 所示。由表2 经计算可知,通过对生鲜乳10 个不同处理组的共30 个样本进行16s测序,总计测得原始序列条数为1 761 661条,获得有效序列1 330 548 条,一共产生1 259 个OTUs。其中M 样品中的OTUs 最多,达到了2 735 个OTUs,Y 样品中的OTUs最少,仅为155个OTUs。
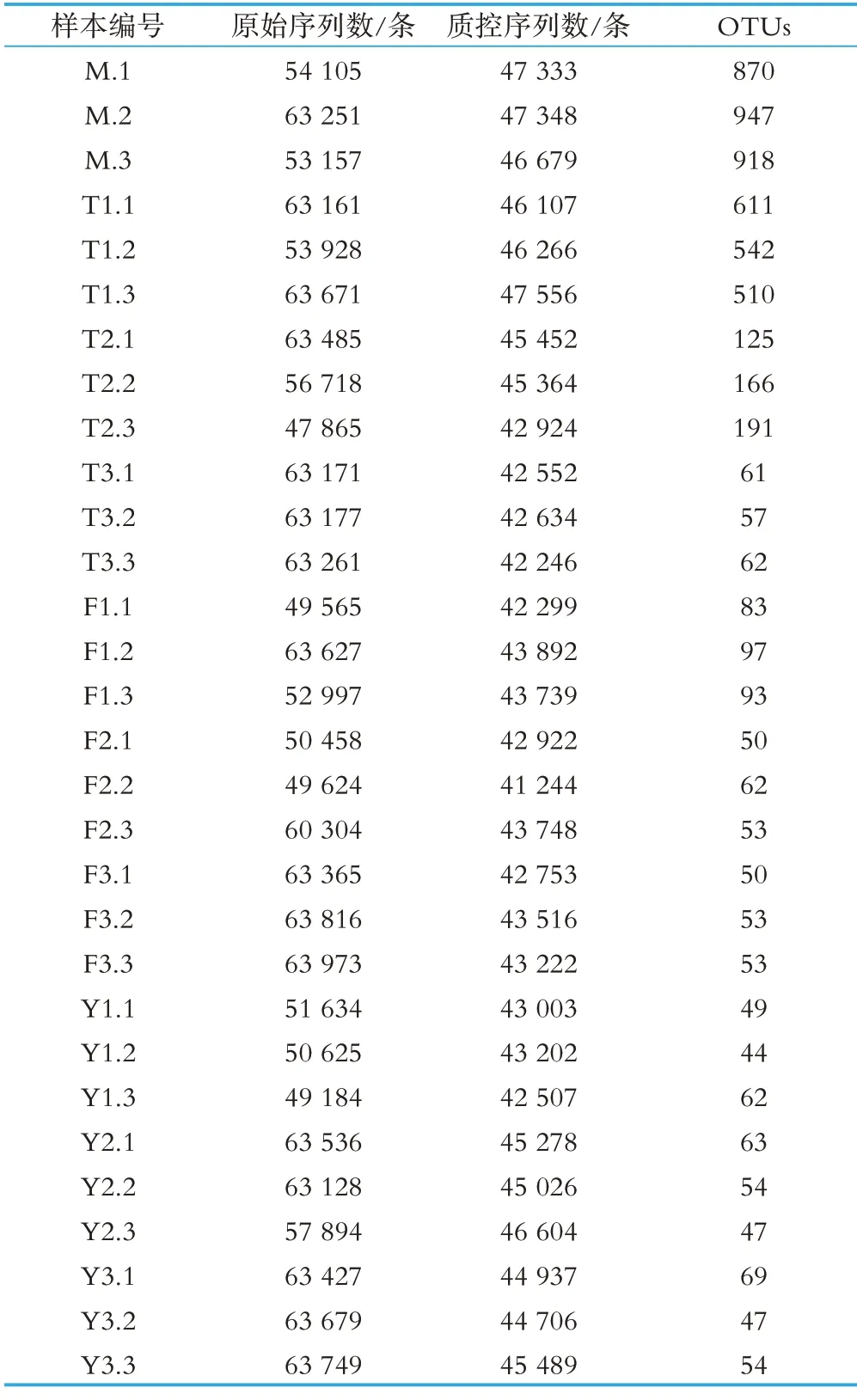
表2 样品间测序数据统计
不同处理条件下的菌群群落结构OUTs 如图1 所示。由图可以看出,30 个样本中共同含有的OTUs 为32 个,其中M 独有410 个OTUs,T1 独有9 个OTUs,Y3 独有1 个OTUs,经过4 ℃储存1 d 的生鲜乳中仅有9 个独有OTUs,15 ℃中储存3 d 的生鲜乳中仅有1 个特有的OTUs,而其他处理条件下的生鲜乳样品中没有自己特有的OTUs。以上结果表明新鲜采集的生鲜乳中细菌种群多样性最高,低温处理技术控制了一部分微生物的繁殖速度使大部分的细菌失去了活性,仅有少部分嗜冷菌存活下来并逐渐成为菌群中的优势菌。这一研究结果也提示我们冷藏运输过程是保证生鲜乳质量的关键环节。

图1 生鲜乳不同处理条件下的OTU Core-Pan图
2.2 不同处理组样品间Alpha多样性分析
生鲜乳10 个不同处理组的α-多样性指标如表3所示。由表3 可以看出,不同处理条件下细菌群落α-多样性统计中的Sobs 指数、Chao 指数、Shannon 指数和Simpson 指数差异显著(P<0.05);Shannon 指数显示,稀释曲线平缓并达到平台期,反映了测序深度已经基本覆盖到样品中所有物种,更大的测序量也不会引起物种多样性的增加,说明样本量足够,且现有数据量分析结果可靠,见图2。表3 中Sobs 指数和Chao指数反映样品中群落的丰富度即群落中物种的数量,而不考虑群落中每个物种的丰度情况;Shannon 和Simpson 指数反映群落的多样性(Species diversity),受样品群落中物种丰富度(species richness)和物种均匀度(species evenness)的影响。相同物种丰富度的情况下,群落中各物种具有越大的均匀度,则认为群落具有越大的多样性。综合分析表3 可知:新鲜采集后直接冻存-80 ℃的生鲜乳(M)的Shannon 指数明显高于其他处理组,说明新鲜采集的生鲜乳中所含的细菌种类最多,微生物复杂程度高于其他处理组,同时,Chao指数也显示了M 处理组中的细菌种群的总体丰富度较高;15 ℃中静置3 d 的生鲜乳(Y3)中的Shannon 指数明显低于其它处理组而Simpson 指数明显高于其他处理组,说明Y3 处理组的生鲜乳中群落优势度物种小,物种奇异度高。以上结果表明,低温处理是减低微生物丰富度的重要步骤,是保证生鲜乳质量和延长货架期的重要手段;与4 ℃和10 ℃相比,15 ℃低温条件是大部分嗜冷菌的最适生长温度,并随着存贮时间的延长,嗜冷菌种群结构的多样性逐渐增加。
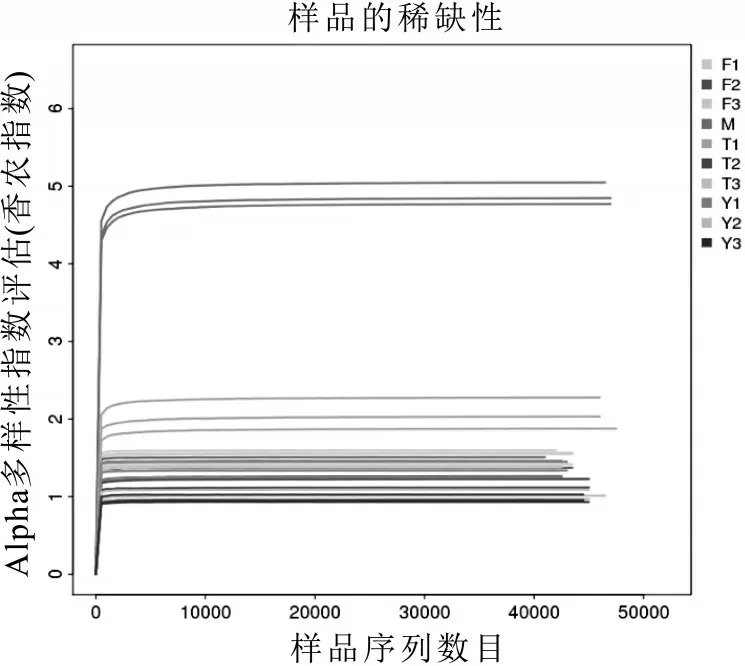
图2 生鲜乳不同处理条件下细菌群落测序的稀释曲线
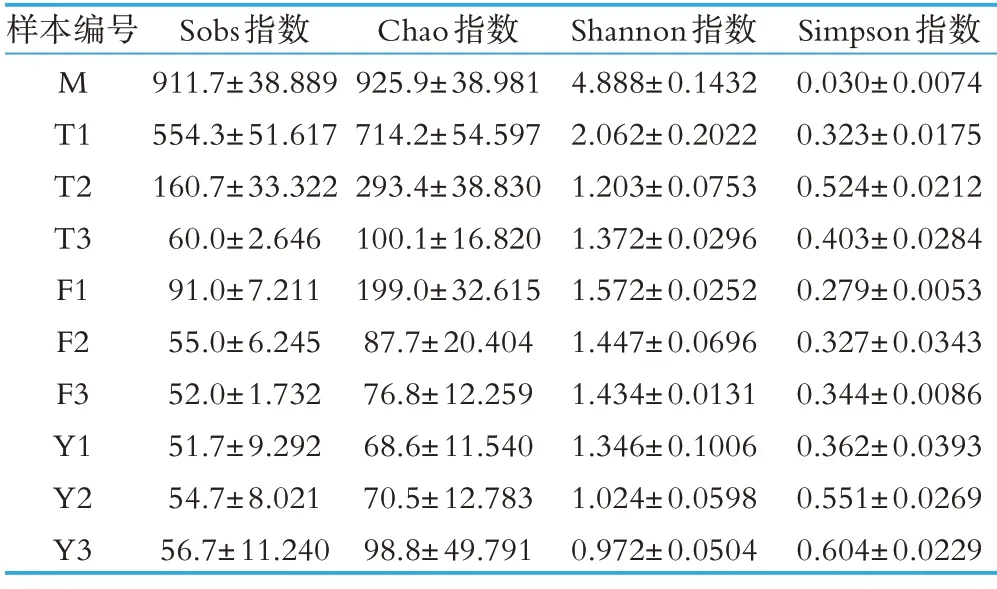
表3 不同处理条件下样品间Alpha多样性统计
2.3 属水平各处理组细菌群落分布情况
利用NGS 法通过与Greengene 数据库比对,基于OTU 的物种分类分析,在相似性为97%水平上,10 个不同处理组的30 个样本中的细菌种群共注释到20 个门、41 个纲、76 个目、162 个科、319 个属和364 个种的物种。由图3 分析可知,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)和酸杆菌门(Acidobacteria)是不同处理条件下的优势菌门,其中变形菌门、厚壁菌门和拟杆菌门是10 个不同处理条件下生鲜乳中的绝对优势菌门。变形菌门在不同处理组中的占比分别为M(31.67%)、T1(81.85%)、T2(91.99%)、T3(91.07%)、F1(66.39%)、F2(51.45%)、F3(47.33%)、Y1(44.29%)、Y2(26.68%)、Y3(21.18%),结果显示变形菌门在4 ℃条件下占比最高;厚壁菌门在不同处理组中的占比分别为M(32.57%)、T1(11.23%)、T2(6.57%)、T3(8.39%)、F1(33.00%)、F2(48.36%)、F3(52.46%)、Y1(55.04%)、Y2(72.81%)、3(78.34%),厚壁菌门在15 ℃条件下占比最高,并且随着储存时间的延长数量逐渐升高;拟杆菌门在不同处理组中的占比分别为M(24.52%)、T1(5.41%)、T2(1.18%)、T3(0.52%)、F1(0.55%)、F2(0.17%)、F3(0.14%)、Y1(0.55%)、Y2(0.42%)、Y3(0.38%),数据显示拟杆菌门在M 处理组中占比最高,并随着储存温度的降低占比逐渐减少;这与前人的研究结果具有一致性,Yamazi 在研究贮存时间对羊奶原料乳质量的影响时发现,贮存48 h 或更长时间后,原料乳中嗜温好氧菌、大肠杆菌群以及嗜冷菌的数量较贮存24 h 或更短显著增加,原料乳的保藏阶段,嗜冷菌的菌群结构也发生了变化[20]。Ratts 收集了来自多个牧场的原料乳样品,菌群结构分析表明,储存了24 h的样品中主要嗜冷菌为厚壁菌门,储存48 h后主要嗜冷菌为变形菌门[21]。
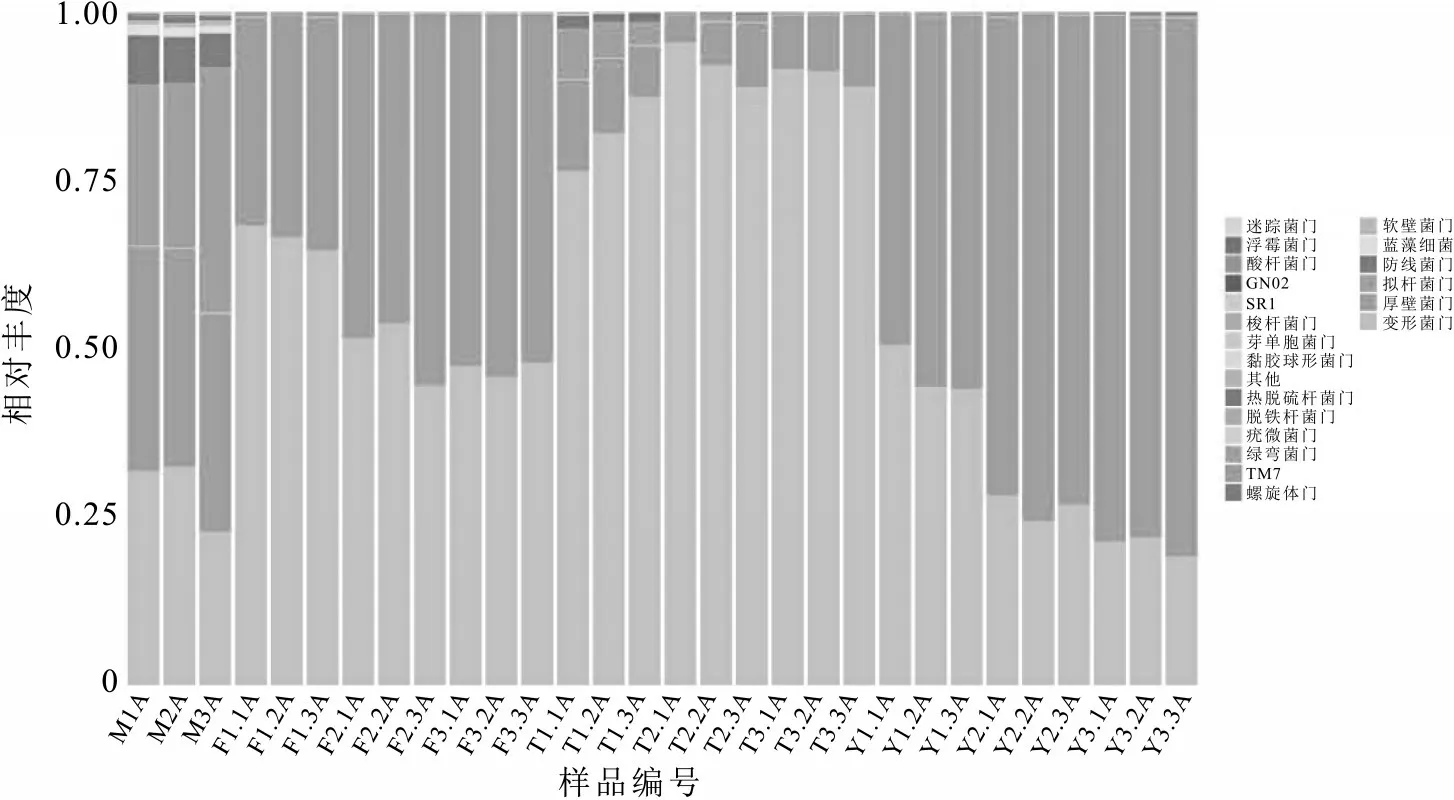
图3 门分类水平不同处理条件下细菌群落的相对丰度
各处理组属水平细菌种群分布见图4,在不同处理组M,T1,T2,T3,F1,F2,F3,Y1,Y2,Y3 中乳球菌属(Lactococcus)是绝对优势菌属,分别占不同处理组总细菌群落的M(6.23%),T1(8.17%)、T2(6.26%)、T3(8.33%)、F1(32.74%)、F2(48.15%)、F3(52.23%)、Y1(54.79%)、Y2(72.45%)、Y3(76.84%);其次为不动杆菌属(Acinetobacter)分别占不同处理组总细菌群落的M(18.67%)、T1(68.62%)、T2(82.21%)、T3(73.81%)、F1(48.37%)、F2(27.18%)、F3(21.63%)、Y1(18.67%)、Y2(10.27%)、Y3(7.82%);排名第三的优势菌属为柠檬酸杆菌属(Citrobacter),分别占不同处理组总细菌群落的M(1.73%)、T1(2.29%)、T2(1.37%)、T3(1.20%)、F1(14.97%)、F2(19.94%)、F3(20.42%)、Y1(23.19%)、Y2(13.49%)、Y3(10.56%);以上结果显示:乳球菌属和柠檬酸杆菌属是生鲜乳10 ℃(F)储存条件和15 ℃储存条件(Y)下的绝对优势菌属;不动杆菌属与假单胞菌属是4 ℃(T)中的优势菌属,并且结果显示不动杆菌属在4 ℃存放2 d时含量最高,假单胞菌属在4 ℃存放3 d 时含量最高;不动杆菌属和金黄杆菌属是未经低温处理生鲜乳中的优势菌属[22];以上研究结果表明不仅贮存温度会影响生鲜乳中嗜冷菌的多样性,贮存时间也是决定嗜冷菌多样性的重要因素;原料乳在4 ℃条件下贮存时间的延长会导致假单胞杆菌和芽孢杆菌数量的增加[23]。
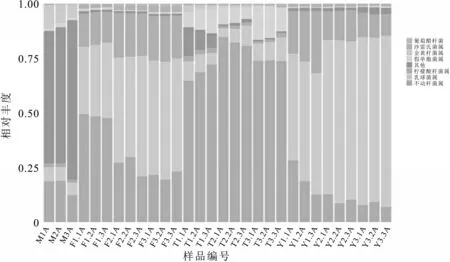
图4 属分类水平不同处理条件下细菌群落的相对丰度
乳球菌属在乳制品的生产中占有较重要的地位,它们的单一或混合培养物可产生不同类型的乳酪和发酵奶,培养黄油和生产酪蛋白。乳酸乳球菌的一些菌株可产生细菌素,如Nisin,lactococcin 和bacteriocin等。Nisin 这种乳球菌肽的抗菌物质作为一种无毒的天然食品防腐剂,已被50 多个国家和地区广泛应用与乳制品、罐头食品、鱼类制品和乙醇饮料等的防腐和保鲜。
2.4 不同处理组的细菌种群聚类分析
Heatmap 是以颜色梯度来代表数据矩阵中数值的大小,并根据物种或样品丰度相似性进行聚类。聚类结果加上样品的处理或取样环境分组信息,可以直观观察到相同处理或相似环境样品的聚类情况,并直接反映了样品的群落组成的相似性和差异性。图5 在属分类等级对生鲜乳10 个不同处理的30 个样本中的物种进行heatmap聚类分析。从图5可以看出,不同处理中细菌种群属分类组成存在差异,10 个处理中占比最大的TOP10 的细菌菌属为:乳球菌属(Lactococcus),不动杆菌属(Acinetobacter),柠檬酸杆菌属(Citrobacter),沙雷氏菌属(Serratia),假单胞菌属(Pseudomonas),金黄杆菌属(Chryseobacterium),葡糖醋杆菌属(Gluconacetobacter),埃希氏杆菌属(Escherichia),肠球菌属(Enterococcus),球菌属(Macrococcus)。不同温度储存条件下的生鲜乳菌群结构差异显著,相同温度储存条件下不同储存时间的生鲜乳的菌群结构显著不同。10~15 ℃储存的生鲜乳中嗜冷菌的增长较0~4 ℃储存的生鲜乳中增长显著。随着储存时间的延长,在10~15 ℃储存条件下乳球菌属所占比例逐渐提高,柠檬酸杆菌属在10 ℃储存条件下随储存时间延长所占比例逐渐提高,而在15 ℃储存条件下,随储存时间延长所占比例逐渐降低;而金黄杆菌属在4 ℃储存条件下随着储存时间的延长比例逐渐降低。
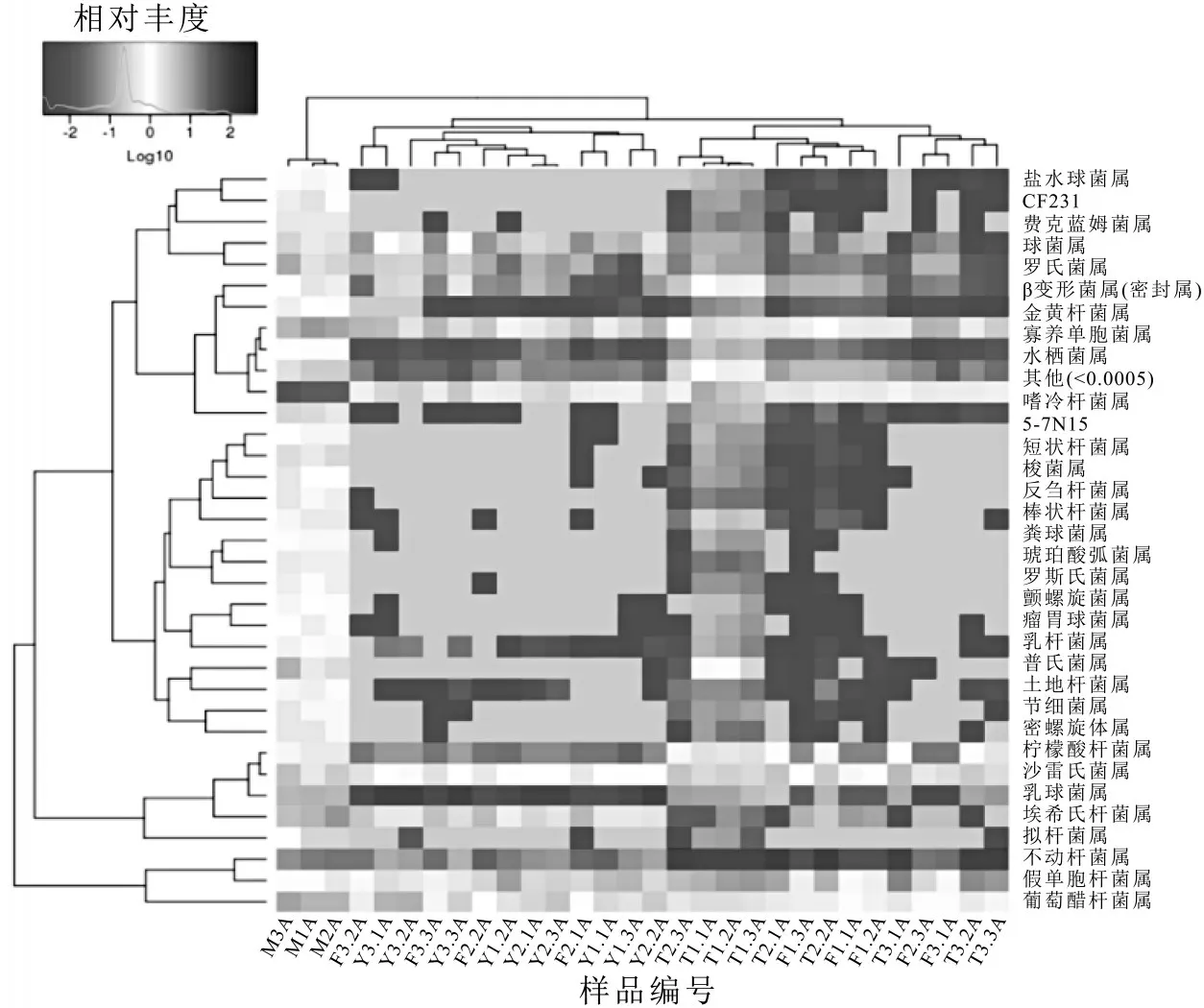
图5 属分类水平不同处理组细菌丰度
主成分分析(PCA)运用降维的思想,通过分析不同样品OTUs(97%相似性)组成反映样品的差异和距离,将多维数据的差异反映在二维坐标图上,坐标轴取对方差异贡献最大的前两个特征值。如果两个样品距离越近,则表示这两个样品的组成越相似,不同处理或不同环境间的样品可能表现出分散聚集的分布情况,从而可以判断相同条件的样品组成是否具有相似性。主成分分析结果见图6,图中每一个点代表一个样本,相同颜色相同形状的点来自于同一个处理条件,两点之间距离越近表明两者的群落结构组成差异性越小。反之,两点之间的距离越远表明两个处理之间的群落结构组成差异性越大。PCA 分析结果进一步显示不同温度处理条件下生鲜乳中的细菌种群很明显的聚集在左侧,10 ℃与15 ℃处理条件下细菌种群相似性较大,而新鲜采集的生鲜乳与4 ℃处理条件下生鲜乳中的细菌种群结构相似性较大。
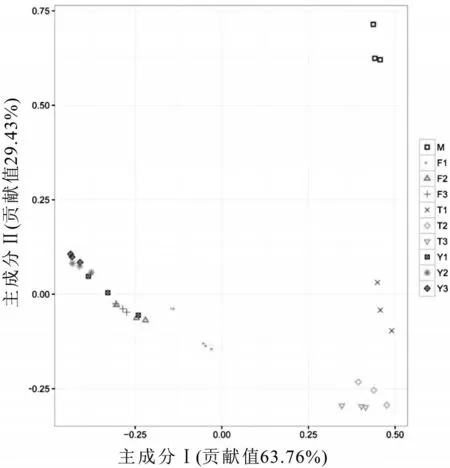
图6 不同处理条件下生鲜乳中细菌种群属分类水平主成分分析
3 结论
(1)不同低温(4、10、15 ℃)储存条件下生鲜乳和直接冻存于-80 ℃的生鲜乳中优势菌属为葡糖醋杆菌、沙雷氏菌属、金黄杆菌属、假单胞菌属、柠檬酸杆菌属、乳球菌属、不动杆菌属。优势菌门为变形菌门、厚壁菌门、拟杆菌门、放线菌门、蓝藻菌门、软壁菌门、和酸杆菌门。
(2)15 ℃与10 ℃储存条件下生鲜乳中的菌群种群结构相似性较大,与直接冻存于-80 ℃及储藏在4 ℃的生鲜乳样品相比,储存在10~15 ℃样品的菌群结构在储藏过程中变化较大,同时,在10~15 ℃储存的生鲜乳中嗜冷菌的增长较直接冻存于-80 ℃和4 ℃储存的显著。
(3)不同低温处理条件下生鲜乳中细菌种群结构呈现显著不同,相同温度条件下不同储存时间的生鲜乳中菌群结构差异显著,而且多样性指数也各不相同,说明储存温度和储存时间对生鲜乳中微生物菌群结构具有重要影响。
(4)嗜冷菌污染是影响现代乳品工业中常见的问题,生鲜乳冷藏储运中应尽量缩短时间,长时间的低温储藏或温度波动会使嗜冷菌菌群结构急剧增加,其产生耐热的酶类影响乳品质和乳风味,降低乳产品货架期。
