紫花苜蓿CCoAOMT 基因家族的鉴定、进化及表达分析
2021-11-22马倩闫启张正社吴凡张吉宇
马倩,闫启,张正社,吴凡,张吉宇
(兰州大学草地农业生态系统国家重点实验室,兰州大学农业农村部草牧业创新重点实验室,兰州大学草地农业教育部工程研究中心,兰州大学草地农业科技学院,甘肃 兰州730020)
畜牧业的可持续发展离不开优质饲料资源的供给。享有“牧草之王”赞誉的豆科(Leguminosae)牧草——紫花苜蓿(Medicago sativa),茎叶中富含营养物质,粗蛋白含量高是其成为畜牧业发展中重要蛋白饲料的原因[1]。它可制作成青贮饲料,又可以收割制作成优质干草,是目前世界上栽培最广泛的一种豆科牧草[2]。木质素是一种苯基丙烷络合物,紫花苜蓿主要包含S 和G 型木质素,是构成紫花苜蓿细胞壁的主要成分,使其有一定的机械强度[3]。然而,紫花苜蓿中的高木质素含量直接影响牲畜的消化和吸收,给畜牧业生产带来负面影响。培育低木质素紫花苜蓿可以有效地提高其消化率,相应地提高动物的生产性能,促进畜牧业可持续发展。
目前,降低木质素含量主要是通过下调表达木质素生物合成途径中的某种或多种关键酶基因,从而显著降低转基因植物中的木质素合成效率[4−6]。木质素生物合成途径大致分为3 种——莽草酸途径、苯丙烷途径和木质素的特异合成途径。咖啡酰辅酶A 氧甲基转移酶(caffeoyl CoAO-methyltransferase,CCoAOMT)是苯丙烷途径中调控G 木质素合成的关键酶之一[7−9]。CCoAOMT基因首先在欧芹(Petroselinum crispum)中克隆到[10],随后被证实参与木质素的生物合成[11]。对拟南芥(Arabidopsis thaliana)中的CCoAOMT进行突变,通过分析木质素的含量表明,突变体植株中的木质素含量比野生型明显减少,且G 木质素的含量也相对下降[12]。反义CCoAOMT基因调控的转基因烟草(Nicotiana tabacum)与野生型对照相比,木质素平均含量降低了16. 8%,并且植株表型正常[13]。在烟草中下调CCoAOMT基因的表达,使转基因植物的木质素含量明显下降,木质素S/G 的比例增加且植株矮化[14]。在CCoAOMT反义抑制的转基因苜蓿中也发现类似研究结果[15]。刘惠荣等[16]通过农杆菌介导法将毛白杨(Populus tomentosa)CCoAOMTcDNA 反向导入烟草抑制CCoAOMT表达,使转基因植物的木质素含量明显下降。利用RNAi 对玉米(Zea mays)和丹参(Salvia miltiorrhiza)的CCoAOMT下调后导致木质素含量显著降低[17−18]。另一方面,能源作物中过表达CCoAOMT基因,可以增加其木质素的生物合成,提高生物量[19]。与木质素合成的其他相关酶类情形类似,CCoAOMT基因也存在着多基因家族现象,在拟南芥[20]、烟草[21]和水稻(Oryza sativa)[22]等植物中均有报道。尽管在一些其他植物中已经鉴定分析了CCoAOMT基因家族,但紫花苜蓿CCoAOMT基因家族的鉴定分析研究尚未见报道。
本研究利用生物信息学手段,从基因组水平对紫花苜蓿CCoAOMT(简称MsCCoAOMT)基因家族的理化性质、结构特征、进化关系、染色体定位等进行系统分析。并采用qRT−PCR 技术检测在不同生长发育阶段该家族基因在不同组织中的表达情况。本研究对低木质素紫花苜蓿新品种选育具有重要意义。
1 材料与方法
1. 1 试验材料
紫花苜蓿‘中苜一号’种子保存于兰州大学草地农业科技学院,以蛭石作为培养基质,于2019 年10 月盆栽培养置于培养室内,保持基质湿润。试验过程中,每隔15 d 浇一次霍格兰氏营养液(每次浇1 L),防止苜蓿生长营养不良。在相同栽培管理条件下,分别在幼苗期、营养期和开花期进行取样,取样部位为叶、茎和花,每个样3 次重复,所采鲜样液氮速冻后于−80 ℃超低温冰箱保存。样品收集完成后使用UNIQ-10 柱式Trizol 总RNA 抽提试剂盒(生工生物工程股份有限公司,上海)提取总RNA,使用TIANScript II RT Kit(天根生化科技有限公司,北京)反转录成cDNA,用于基因表达分析。
1. 2 MsCCoAOMT 基因的鉴定
从Phytozome12(https://phytozome. jgi. doe. gov/pz/portal. html)获得水稻和拟南芥CCoAOMT 蛋白和基因序列。 紫花苜蓿基因组序列、CDS 序列、蛋白质序列均下载自https://figshare. com/projects/whole_genome_sequencing_and_assembly_of_Medicago_sativa/66380[23]。 以水稻和拟南芥CCoAOMT序列作为查询序列,利用BLAST 鉴定紫花苜蓿基因组中的候选CCoAOMT基因。然后,利用Pfam(http://pfam. xfam. org/)和SMART网站(http://smart. embl-heidelberg. de/)将上一步所得序列进行结构预测,剔除不含CCoAOMT 蛋白典型结构域的序列,剩余的蛋白序列视为MsCCoAOMT 家族成员。
1. 3 蛋白质的理化性质及染色体定位分析
利用ExPaSy 蛋白质服务器(https://web. expasy. org/protparam/)分析MsCCoAOMT 氨基酸残基、亲水性总平均值、等电点和分子量。WoLF PSORT(https://wolfpsort. hgc. jp/)用于预测MsCCoAOMT 蛋白的亚细胞位置。提取所有MsCCoAOMT基因在紫花苜蓿基因组中的位置信息,利用在线工具MapGene2Choromosome v2(http://mg2c. iask. in/mg2c_v2. 0/)将MsCCoAOMT基因定位到对应染色体上。
1. 4 基因结构、保守基序和启动子元件分析
利用在线工具GSDS 2. 0(http://gsds. cbi. pku. edu. cn/)分析MsCCoAOMT家族基因结构。蛋白保守结构域由MEME(http://meme-suite. org/tools/meme;最佳宽度在6~50 之间)预测,最大基序数为10。启动子元件分析利用在线工具PlantCARE(http://bioinformatics. psb. ugent. be/webtools/plantcare/html/)完成。
1. 5 系统发育分类分析
利用MEGA 7(http://www. megasoftware. net)软件通过邻接法(neighbor-joining,NJ)构建系统进化树,包括4 个物种,分别为紫花苜蓿,水稻,蒺藜苜蓿(Medicago truncatula)和拟南芥,遗传距离为泊松距离(poisson correction),校验参数Bootstrap 重复1000 次,其他参数使用系统默认值。
1. 6 MsCCoAOMT 基因家族的表达分析
从数据库Alfalfa Breeder’s Toolbox(https://www. alfalfatoolbox. org/)下载紫花苜蓿的转录组(RNA-seq)数据。利用BLAST 比对获取鉴定的MsCCoAOMT基因同源转录组序列,进而获取MsCCoAOMT基因在不同组织中的表达量,热图利用OmicShare 在线数据分析平台(http://www. omicshare. com/)绘制。
采用qRT−PCR 分析MsCCoAOMT家族11 个基因在紫花苜蓿幼苗期、营养期茎和叶以及花期茎、叶和花中的表达模式。使用软件PerlPrimer 设计定量引物(序列见表1),扩增片段在100~200 bp 左右,使用2X SG Fast qPCR Master Mix 试剂盒(生工生物工程股份有限公司,上海),使用仪器为伯乐CFX96(BIO-RAD,美国)。选用紫花苜蓿Actin基因(AA660796)为内参[24],反应程序为:95 ℃30 s;95 ℃5 s,60 ℃30 s,共40 个循环。采用2−ΔΔCT法计算各基因的相对表达量[25]。试验设置3 次生物学重复。

表1 qRT-PCR 引物信息Table 1 Primers used for qRT-PCR analysis
2 结果与分析
2. 1 MsCCoAOMT 基因家族的鉴定
44 个预测的MsCCoAOMT基因从紫花苜蓿基因组中被鉴定出来,根据它们在染色体上的分布情况,命名为MsCCoAOMT1至MsCCoAOMT44。 除MsCCoAOMT44 含有2 个结构保守域UDP-glucoronosyl and UDPglucosyl transferase 和O-methyltransferase(PF01596. 17),其余MsCCoAOMT 只有O-methyltransferase 一个结构域。此外,还分析了MsCCoAOMT 的氨基酸长度、亲水性的总平均值、等电点、分子量和基因序列长度(表2)。结果表明,序列最长的MsCCoAOMT 蛋白(MsCCoAOMT24)包含568 个氨基酸残基,其余43 条序列的氨基酸残基数目均在200 个左右;MsCCoAOMTs基因序列长度差异较大,其中MsCCoAOMT4基因序列最长(7396 bp),MsCCoAOMT1次之(5315 bp),基因序列长度在3000~4500 bp 之间的MsCCoAOMT共计12 个,2000~3000 bp 之间的MsCCoAOMT共计11 个,其余MsCCoAOMT基因序列长度在2000 bp 以下;MsCCoAOMT24 预测分子量63. 5 kDa,其余蛋白均在40 kDa 以内;蛋白质理论等电点介于4. 89(MsCCoAOMT24)和8. 58(MsCCoAOMT2/3/4)之间。除了3 个MsCCoAOMT 蛋白(MsCCoAOMT5、MsCCoAOMT8 和MsCCoAOMT32)外,其余MsCCoAOMT 蛋白疏水性指数(GRAVY)均小于0,表明这些均为亲水性蛋白。亚细胞定位预测结果表明,33 个MsCCoAOMT 蛋白定位于细胞质,11 个定位于叶绿体。同时,与模式植物拟南芥CCoAOMT基因进行同源比对,得到其在拟南芥中的同源基因及基因名称(表2)。

表2 紫花苜蓿CCoAOMT 基因家族信息Table 2 The information of CCoAOMT gene family in M. sativa
2. 2 染色体定位分析
MsCCoAOMT家族成员分布于紫花苜蓿的16 条染色体上,呈现不均匀性分布(图1)。其中chr 4. 3、chr 8. 1和chr 8. 4 染色体上均有6 个MsCCoAOMT基因,chr 8. 2 和chr 8. 3 染色体上均有5 个MsCCoAOMT基因,chr 4. 1 染色体上有2 个MsCCoAOMT基因,chr 4. 2 和chr 4. 4 染色体上均有3 个MsCCoAOMT基因,chr 2. 1、chr 2. 2、chr 2. 3、chr 2. 4、chr 6. 1、chr 6. 2、chr 6. 3 和chr 6. 4 染色体上均有1 个MsCCoAOMT基因。 另外,MsCCoAOMT基因存在明显的串联重复现象,并在染色体上呈现6 个串联重复基因簇。其中,MsCCoAOMT23、MsCCoAOMT24、MsCCoAOMT25、MsCCoAOMT26和MsCCoAOMT27在chr 8. 1 染色体上形成一个较大的串联重复基因簇;MsCCoAOMT39、MsCCoAOMT40、MsCCoAOMT41、MsCCoAOMT42和MsCCoAOMT43在chr 8. 4 染色体上形成一个较大的串联重复基因簇。
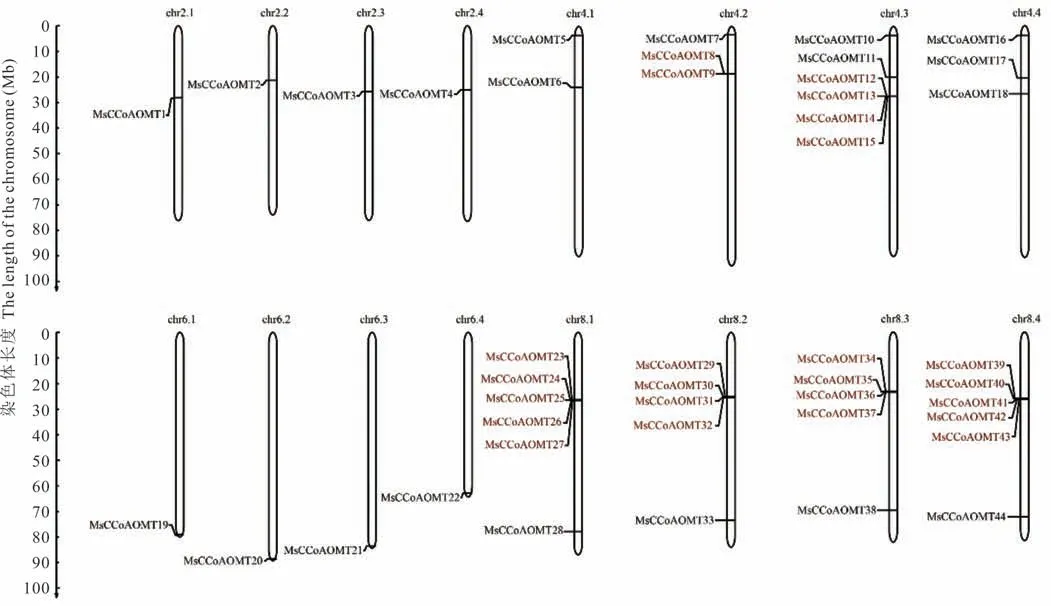
图1 紫花苜蓿CCoAOMT 基因的染色体定位Fig. 1 Location of MsCCoAOMT genes on chromosome
2. 3 MsCCoAOMT 基因家族蛋白结构域及基因结构分析
为了进一步研究不同MsCCoAOMT 蛋白中基序的相似性和多样性,利用MEME 软件进行蛋白结构域预测。结果表明,MsCCoAOMT 蛋白结构比较保守,共鉴定到了10 个比较保守的motif(分别命名为Motif1~10),其中Motif1、Motif2、Motif4 和Motif5 最为保守,是各组共有基序(图2a)。除共有基序外,各组基序还具有一定特异性,如Motif6 和Motif10 仅在D 亚组中存在,Motif7 和Motif9 只在C 和D 亚组中存在,此类motif 可能与CCoAOMT基因功能的多样性有关。
为明确MsCCoAOMT基因结构,根据紫花苜蓿基因组信息获取了每一个MsCCoAOMT基因的基因组序列和CDS 序列信息并绘制外显子−内含子结构图(图2b),结果表明MsCCoAOMT家族各成员外显子和内含子数目相对保守,大部分MsCCoAOMT基因(82%)都含有5 个外显子和4 个内含子。 说明4 个内含子是MsCCoAOMT基因主要结构形式。
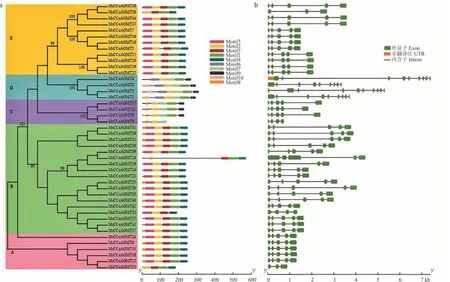
图2 紫花苜蓿CCoAOMT 基因家族的保守基序及基因结构分析Fig. 2 Analysis of conserved motifs and gene structure of the MsCCoAOMT gene family
2. 4 MsCCoAOMT 基因启动子顺式作用元件分析
为了探讨MsCCoAOMT基因在胁迫应答和发育过程中的作用机制,使用PlantCARE 在线工具分析MsCCoAOMT基因的2000 bp 上游启动子序列。 发现其启动子含有基本的顺式作用元件,如CAAT-box、TATA-box(表3)。此外还有与光响应、激素响应、生长发育调节、胁迫响应等相关的作用元件(表3)。说明这些基因不仅参与木质素的生物合成,可能还在紫花苜蓿的生物及非生物胁迫中具有重要作用。

表3 启动子序列顺式作用元件分析Table 3 Analysis of promoter sequence cis-acting

续表Continued Table
2. 5 MsCCoAOMT 家族成员系统进化分析
为了确定MsCCoAOMT 和其他模式植物CCoAOMT 的进化关系,利用来自4 种植物物种的59 个CCoAOMT(紫花苜蓿44 个,拟南芥7 个,水稻和蒺藜苜蓿各4 个)构建系统进化树(图3)。 结果表明,44 个MsCCoAOMT 可以分为5 个亚家族,命名为亚家族A 至E(图3),同一亚族内成员亲缘关系较近,分别包含6,18,4,4,12 个MsCCoAOMT成员。其中MsCCoAOMT1、MsCCoAOMT2、MsCCoAOMT3和MsCCoAOMT4基因与蒺藜苜蓿Medtr2g070410. 1被归为一类;MsCCoAOMT8、MsCCoAOMT9、MsCCoAOMT11和MsCCoAOMT17基因与蒺藜苜蓿Medtr4g094368. 1被归为一类。相比于蒺藜苜蓿,紫花苜蓿含有数目较大的CCoAOMT基因家族,说明其木质素合成较蒺藜苜蓿复杂。这也说明MsCCoAOMT基因在植物中保守性较强,可以通过拟南芥的分类信息鉴定MsCCoAOMT基因家族的分类情况。

图3 紫花苜蓿CCoAOMT 基因家族系统进化树Fig. 3 The phylogenetic tree of the MsCCoAOMT gene family
2. 6 MsCCoAOMT 基因家族的表达分析
利用紫花苜蓿的RNA-seq 数据,分析得到MsCCoAOMT基因家族成员在6 种组织中的表达谱(图4)。表达谱中用蓝−白−红3 色代表基因表达的强度,红色越亮代表信号越强,蓝色越亮代表信号越弱,白色代表中间水平。 结果显示,每个MsCCoAOMT基因至少在一个组织中显示高表达水平。 其中MsCCoAOMT23、MsCCoAOMT24、MsCCoAOMT25、MsCCoAOMT26、MsCCoAOMT29、MsCCoAOMT30、MsCCoAOMT31、MsCCoAOMT34、MsCCoAOMT35、MsCCoAOMT36、MsCCoAOMT39、MsCCoAOMT40和MsCCoAOMT41主要在根中表达;MsCCoAOMT1、MsCCoAOMT2、MsCCoAOMT3、MsCCoAOMT4、MsCCoAOMT8、MsCCoAOMT9、MsCCoAOMT11和MsCCoAOMT17在根瘤中特异性表达;MsCCoAOMT6、MsCCoAOMT12、MsCCoAOMT13、MsCCoAOMT14、MsCCoAOMT15 与MsCCoAOMT18 主要在茎中表达;MsCCoAOMT5、MsCCoAOMT7、MsCCoAOMT10、MsCCoAOMT16、MsCCoAOMT19、MsCCoAOMT20、MsCCoAOMT21、MsCCoAOMT22、MsCCoAOMT27、MsCCoAOMT32、MsCCoAOMT37、MsCCoAOMT42 和MsCCoAOMT43 在叶中表达量高;MsCCoAOMT28、MsCCoAOMT33、MsCCoAOMT38 和MsCCoAOMT44 在花中特异性表达。

图4 紫花苜蓿CCoAOMT 基因表达模式Fig. 4 The expression profile of the MsCCoAOMT genes
利用qRT−PCR 分析发现,MsCCoAOMT1、MsCCoAOMT10、MsCCoAOMT12、MsCCoAOMT17、MsCCoAOMT21、MsCCoAOMT23、MsCCoAOMT25、MsCCoAOMT32、MsCCoAOMT41、MsCCoAOMT43和MsCCoAOMT44在紫花苜蓿不同生长发育时期的不同组织中均有表达。其中,MsCCoAOMT1在幼苗期和营养期各组织中相对表达量较高;MsCCoAOMT10、MsCCoAOMT32、MsCCoAOMT41和MsCCoAOMT43在花期叶片中表达量最高;MsCCoAOMT12在花期茎中相对高表达;MsCCoAOMT17在花期花和叶片中相对高表达;MsCCoAOMT21在幼苗期叶片中表达量最高;MsCCoAOMT23和MsCCoAOMT25在营养期茎中表达量最高;MsCCoAOMT44仅在紫花苜蓿开花期花中高表达(图5)。

图5 不同生长发育阶段紫花苜蓿‘中苜1 号’不同组织中MsCCoAOMT 基因相对表达量Fig. 5 Relative expression of MsCCoAOMT gene in different tissues of M. sativa‘Zhongmu No. 1’at different growth and development stages
3 讨论
加强饲草饲料行业管理,改善牧草饲料品质和产量,是我国畜牧业振兴与发展的方向。我国甘肃、内蒙古、陕西等地是苜蓿主要种植区,其中甘肃省的苜蓿种植面积居于全国第1,已达到66. 27 万hm2。内蒙古以59. 2 万hm2位居于全国第2 位。目前,虽然国内苜蓿的产量和品质已经有所提高,但是与美国等畜牧业发达国家还是一直存在很大的差距,导致我国优质的苜蓿始终处于完全依赖国外进口的尴尬状态。木质素为紫花苜蓿生长发育所必须,但是其含量过高会降低紫花苜蓿品质,研究表明,苜蓿干物质的消化率与木质素的含量极显著负相关[26]。因为植物木质素和纤维素的含量直接影响蛋白质的利用率。木质素合成过程十分复杂,涉及许多酶。主要有苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、香豆酰辅酶A 连接酶(4-coumarate:CoA ligase,4CL)、咖啡酰辅酶A 氧甲基转移酶、肉桂酸-4- 羧化酶(cinnamate-4-hydroxylase,C4H)、香豆酸-3- 羧化酶(p-coumarate-3-hydroxylase,C3H)、阿魏酸-5-羧化酶(ferulate-5-hydroxylase,F5H)、香豆酰CoA-3-羧化酶(coumaroyl-CoA-3-hydroxylase,CCH)、肉桂酰辅酶A 还原酶(cinnamoyl-CoA reductase,CCR)、咖啡酸-3-O-甲基转移酶(caffeic acid-3-O-methyltransferase,COMT)、肉桂酰乙醇脱氢酶(cinnamoyl alcohol dehydrogenase,CAD)等[27−29]。
咖啡酰辅酶A 氧甲基转移酶(CCoAOMT)催化咖啡酰辅酶A(caffeoyl-CoA)生成阿魏酰辅酶A(feruloyl-CoA),在木质素生物合成中发挥重要作用。本研究采用生物信息学的方法对紫花苜蓿全基因组数据库进行检索,共鉴定出了44 个MsCCoAOMT家族基因。蛋白质的结构决定其功能,基因结构的差异可能引起蛋白质结合构象的改变,因此对基因功能有巨大的影响。通常含有多个内含子的基因一般比较保守,而不含有内含子的基因保守性较差。基因结构分析表明MsCCoAOMT基因最少由3 个外显子和2 个内含子组成,大部分由5 个外显子和4 个内含子组成,表明MsCCoAOMT家族结构较为保守。同样的,在水稻中,CCoAOMT基因类似地作为基因家族存在,表现出高度的序列保守性[22]。 MsCCoAOMT 蛋白结构分析表明,Motif1 和Motif2 出现在MsCCoAOMT 蛋白中的频率最高,不同亚组MsCCoAOMT 蛋白保守基序有差异,同一亚组内有更多相似的基序。这些基因内部的差异可能会影响它们的功能。紫花苜蓿是优质的豆科牧草,在世界上具有广阔的发展前景,目前利用转基因技术在提高其品质方面取得了相关进展[30]。延迟牧草开花,降低木质素水平,以增加饲料产量,提高牧草质量,是未来牧草育种的主要方向[31]。研究表明,抑制CCoAOMT 活性能有效降低毛白杨木质素含量,但对植物生长发育及其机械运输系统无明显影响[32]。可见,利用遗传工程手段对植物中CCoAOMT基因进行调节,在不影响植物正常生长的条件下,结合研究目标对木质素含量和质量进行调控具有重要意义。qRT−PCR检测结果表明:MsCCoAOMT基因的表达存在明显的组织特异性,在不同的生长发育时期其相对表达量也存在明显差异,在紫花苜蓿不同生长发育时期持续高表达和开花期相对表达量显著提高的MsCCoAOMT基因可能与紫花苜蓿收获期木质素含量升高、叶片和茎秆老化有关,可以用来调控木质素含量和牧草质量。
4 结论
本研究对紫花苜蓿CCoAOMT基因家族进行分析,共鉴定了44 个MsCCoAOMT家族基因,预测33 个MsCCoAOMT 蛋白定位于细胞质,11 个定位于叶绿体。系统进化树分析表明其分布在5 个进化枝,与蒺藜苜蓿、拟南芥、水稻的CCoAOMT基因有很高的相似性。qRT−PCR 分析表明,MsCCoAOMT家族11 个基因在紫花苜蓿幼苗期、营养期茎和叶以及花期茎、叶和花中均有表达,但存在明显的组织特异性。本研究对紫花苜蓿木质素含量的分子调控研究具有参考价值。
