冷季型绿肥对锥栗园土壤生化性质及微生物群落的影响
2021-11-22程分生尤龙辉余锦林徐惠昌游惠明聂森李建民叶功富
程分生,尤龙辉,余锦林,徐惠昌,游惠明,聂森,李建民,叶功富
(1. 福建农林大学林学院,福建 福州350002;2. 福州市林业局自然保护地规划发展中心,福建 福州350007;3. 福建省林业科学研究院,福建 福州350012)
壳斗科(Fagaceae)栗属(Castanea)中的锥栗(Castanea henryi)在我国分布广泛,其果实香甜,并以高维生素和高热量等营养价值优点,成为重要的木本粮食树种之一[1],在丘陵山地欠发达地区,还是地方重要的财政收入和农民增收的重要经济来源[2]。长期以来,我国锥栗园的地面管理模式以高强度集约经营如清除林下灌草、翻耕、施用化肥和除草剂等为主[1−2]。高强度经营会导致林地生物多样性降低、水土流失、土壤质量下降等一系列问题[3],使树体生长势衰退,锥栗产量和品质下降,严重制约着锥栗产业的可持续和高质量发展。
果园生草法源于欧美与日本,采用全园或带状人工覆植绿肥,或是除去园内部分不适宜的自然生长的杂草种类,逐渐达到免耕目的的新型低强度果园地面经营方式[4]。大量研究表明,果园绿肥可以改善土壤理化性质[5],提高土壤有机质和养分含量[6],调节果园微域环境和小气候,提升果实的产量和品质[7]。目前,已有少数研究者开展了锥栗园的生草栽培试验,探讨了生草对锥栗园坡面水土流失[8]、土壤理化性质及锥栗产量和品质的影响[9],但有关绿肥对土壤微生物群落的影响及其土壤恢复机制仍未深入研究。
土壤理化性质及养分含量动态可用来反映经营干扰对土壤质量演化规律的影响,但土壤长期大量施用化肥和除草剂会削弱这类指标的敏感度[10],因而一些具有指示预警作用的生物指标逐渐被重视和应用。土壤微生物是土壤生态系统的重要组分之一,几乎所有的土壤生物化学过程都直接或间接与土壤微生物有关,被认为是表征土壤质量变化最敏感、最有潜力的生物指标之一[11]。有研究指出,森林土壤高强度集约经营会降低土壤微生物多样性[12]。生草栽培是否有利于提升锥栗园土壤微生物多样性,不同生草对土壤微生物群落结构和功能的影响是否有差异,这种差异与土壤质量有什么内在关联等问题尚未见报道。鉴于此,本试验利用高通量测序技术,分析红壤丘陵山地锥栗园分别种植鼠茅草(Vulpia myuros)、黑麦草(Lolium perenne)和光叶紫花苕(Vicia villosa)等冷季型绿肥后林地土壤微生物群落组成和多样性的差异,并以传统清耕和喷施草甘膦等经营模式为对照,探讨锥栗园土壤质量绿肥恢复机制,以期为锥栗果园生草制度的科学制定和高品质生态锥栗产业的可持续发展提供参考。
1 材料与方法
1. 1 研究区概况
研究区位于武夷山脉东南麓福建省建瓯市龙村乡(27°12. 24′−27°20. 03′N,118°23. 44′−118°38. 25′E),属低山丘陵区,海拔670~750 m,平均坡度20~23°,年均气温18. 7 ℃,年降水量1670 mm,年均蒸发量1250~1530 mm,无霜期274~291 d,昼夜温差较大,光照充足,雨量充沛,属亚热带季风气候。土壤类型以红壤为主,土壤平均厚度在1 m。当地锥栗栽植的品种以白露仔、长芒仔、油榛和圆蒂仔等为主,林下自然散生草本植物主要有杠板归(Polygonum perfoliatum)、悬钩子(Rubus corchorifolius)、狗尾草(Setaria viridis)、积雪草(Centella asiatica)、铁芒萁(Dicranopteris linearis)、芒草(Miscanthus)、星宿菜(Lysimachia fortunei)等。
1. 2 样地设置与研究方法
2018 年,在龙村乡锥栗生产示范区选取集中连片、面积较大、立地条件基本一致的样地(地理位置为27°13′55″N,118°32′5″E,园区总面积>10. 0 hm2),将其划分成若干面积大小为0. 3~0. 5 hm2的试验小区,进行生草栽培管理,每个小区随机选取一种绿肥草种,栽培方式具体为:撒播草种前,整平整细地面,树干基部周围(半径约30 cm)采用行间旋耕土起垄后不覆草。采用撒播方式进行全园播种,首次在冬末10−12 月,翌年早春3−5 月续播,每个小区播种量均为30 kg·hm−2,并覆盖薄膜;苗长至5 cm 左右及时撤掉薄膜,每年追肥2 次,早春及早秋,采用复合肥(NPK 配比N−P2O5−K2O=15∶15∶15)追肥,追肥量120 kg·hm−2,并采取人工除杂草、刈割、压青、防治病虫害等抚育措施。另外选取两块试验小区作为对照组,一组采用清耕法进行管理,每年4 和6 月各人工锄草一次;另一组则每年4 和6 月,用10% 草甘膦水剂1.5 kg,均匀兑水30 kg,向杂草茎叶处喷雾除草。为了保证可比性,对照组的水肥管理与生草栽培处理保持一致。供试样地林分基本情况见表1。
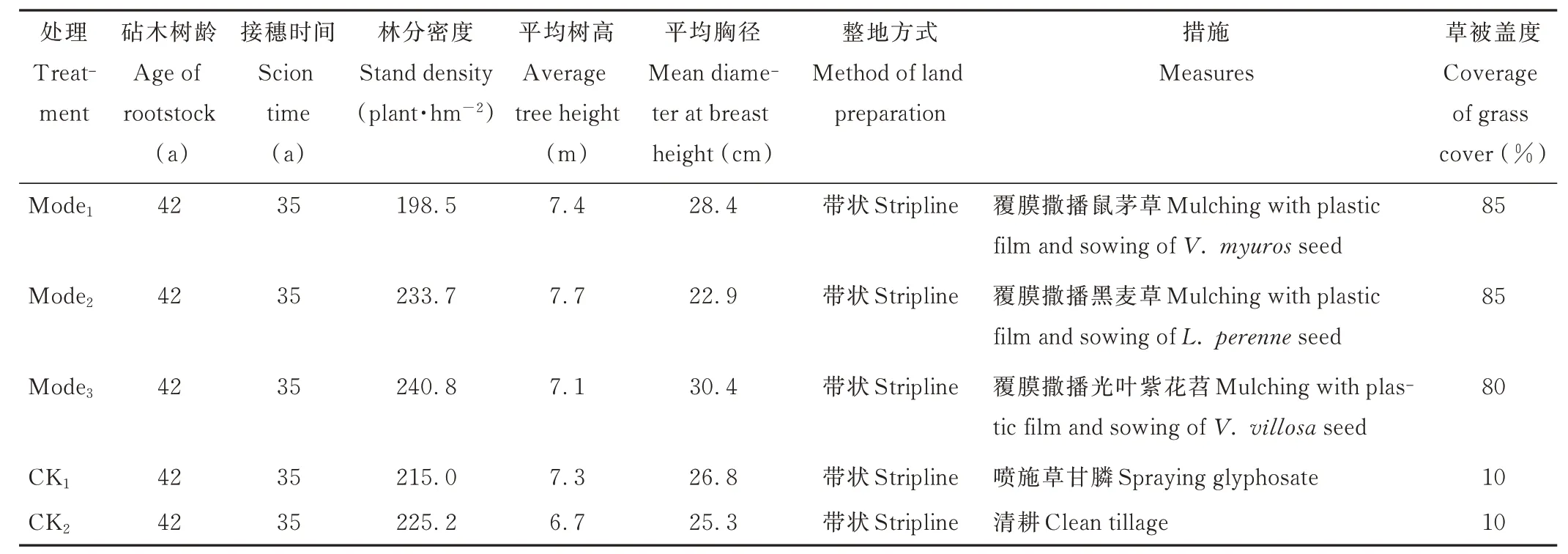
表1 供试林分基本情况Table 1 Basic information of tested stands
2020 年10 月,对各生草栽培模式和对照组,分别设置3 个垂直投影为20 m×20 m 的调查样地,样地间隔20 m 以上,共计15 个样地,总面积6000 m2。在各样地选取3 株砧木为毛榛(Corylus mandshurica),接穗为白露仔且树体生长健康、树高和胸径基本一致的锥栗,距树干基部1 m 处,区分东西南北4 个方向,清除表层凋落物,手持土钻采集4 个方向表层(0~10 cm)土壤,放入自封袋混合均匀后采用四分法得到土壤鲜样,去除根系、石砾等杂质后等分成2 份,一份土壤鲜样用干冰保存,用于土壤微生物群落高通量分析,另一份土壤放入自封袋,风干后研磨过2. 000 和0. 147 mm 筛备用,测定其土壤养分含量和酶活性。钻取土壤的同时,利用环刀取邻近钻点的土壤,用于测定土壤容重、孔隙度和自然含水率。
1. 3 土壤理化性质和酶活性测定
土壤容重、孔隙率、含水率采用环刀法测定,pH 值采用电位法测定(水∶土=2. 5∶1. 0),土壤全碳、氮采用元素分析仪(Vario EL Ⅲ,Elementar Analysensysteme GmbH,Hanau,Germany)测定,碱解氮采用碱解扩散法测定,采用碳酸氢钠浸提−钼锑抗分光光度法测定土壤有效磷含量,醋酸铵−火焰光度计法测定土壤速效钾含量,土壤酶活性参照杨露等[6]和井赵斌等[13]的方法:脲酶活性测定采用苯酚钠比色法,酸性磷酸酶活性测定采用磷酸苯二钠比色法,过氧化氢酶活性测定采用高锰酸钾滴定法,用3,5-二硝基水杨酸比色法测定蔗糖酶和纤维素酶活性,采用邻苯三酚比色法测定多酚氧化酶活性,α-葡萄糖苷酶采用S-α-GC 法测定、β-葡萄糖苷酶采用硝基酚比色法测定。
1. 4 土壤微生物多样性测定
1. 4. 1 土壤DNA 的提取 采用南京集思慧远生物科技有限公司提供的总DNA 提取试剂盒。称取0. 5 g 保存于−20 ℃冰箱中的土壤样品,参照试剂盒所述方法提取土壤样品总DNA,随后DNA 总溶液分别通过1% 琼脂糖凝胶电泳和NanoDrop-2000(Thermo Scientific,USA)检测DNA 溶液的纯度和浓度,提取DNA 的土壤样品保存于−20 ℃冰箱中备用。
1. 4. 2 PCR 扩增和基因测序 将提取后的土壤DNA 样品送南京集思慧远生物科技有限公司进行PCR 及高通量测序,分别以16S rRNA V3~V4 区通用引物对338F/806R(ACTCCTACGGGAGGCAGCA/GGACTA CHVGGGTWTCTAAT)[14]和ITS1-F/ITS2(CTTGGTCATTTAGAGAGAGTAA/GCTGCGTTCTTCAT CGATGC)[15]进行PCR 扩增。使用的PCR 程序为98 ℃2 min,98 ℃15 s,55 ℃30 s,72 ℃30 s,30 个循环,然后72 ℃5 min。PCR 扩增产物通过2% 琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,纯化PCR 产物,采用TruSeq Nano DNA LT Library Prep Kit 进行文库构建。
上机测序前,需质检文库。对合格的测序文库梯度稀释后,按所需测序量一定比例混合,并经NaOH 变性为单链进行上机测序。本实验采用Illumina MiSeq PE300 测序仪进行2×300 bp 的双端测序。通过QIIME 软件分析原始细菌和真菌的读数,并调用USEARCH 检查并剔除低质量和嵌合体序列。通过Barcode 序列找回每个样品对应的序列。 将前述高质量序列以97% 的相似性聚类为可操作的分类单位(operational taxonomic units,OTU)。最后,依据细菌的Greengenes 数据库和真菌的UNITE Fungal ITS 数据库对每个OTU 的代表性序列进行了分类。再对OTUs 进行丰度、Chao1、Shannon、Goods_coverage 多样性指数等分析,同时对物种注释在各个分类水平上进行群落结构的统计分析。
1. 5 数据处理
采用Microsoft Excel 2016 和SPSS 22. 0 进行数据统计分析,表中数据均为平均值±标准差,并采用Duncan多重比较进行显著性检验(α=0. 05);基于OTUs 操作分类单元,使用R 软件vegan 包进行非计量多维尺度转换排序(non-metric multidimensional scaling,NMDS),采用Origin 9. 4 对排序结果作图;使用R 软件pheatmap 包对优势门和土壤环境因子进行热图分析;采用Canoco 5. 0 对土壤理化性质和酶活性与微生物群落结构进行冗余分析(redundancy analysis,RDA)。
2 结果与分析
2. 1 5 种土壤管理模式对锥栗土壤环境因子的影响
由表2 可知,5 种模式中生草处理占有较高的土壤养分含量,其中Mode1土壤养分含量最高,其碱解氮、有效磷和速效钾含量分别为74. 14、156. 87 和234. 76 mg·kg−1。多重比较显示,CK1和CK2碱解氮、有效磷、速效钾显著低于Mode1、Mode2和Mode3(P<0. 05,下同),但CK1土壤全碳/氮则显著高于其他处理。在土壤物理性质方面,Mode2土壤容重显著低于其他模式,但其土壤孔隙度最高;CK2土壤自然含水率最低。另外,Mode1、Mode2、Mode3和CK1土壤pH 值均高于CK2。
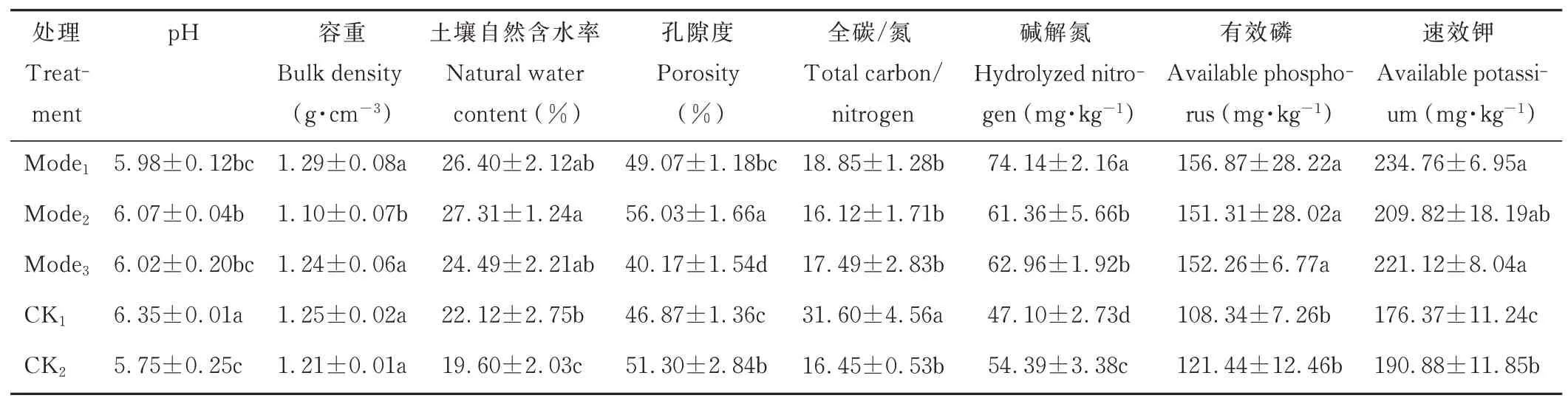
表2 5 种土壤管理模式对锥栗园土壤理化性质的影响Table 2 Effects of five soil management modes on soil physicochemical properties of C. henryi orchard
土壤酶来源于植物根系分泌、动植物残体分解和土壤微生物进行的代谢活动,是土壤营养转化的重要催化剂,其活性的大小是指示土壤生物活性和生化反应强度的重要指标[16]。由表3 可知,土壤过氧化氢酶、蔗糖酶活性均表现为Mode1最高,分别为42. 64、32. 29 U·g−1,而Mode3最低,分别为15. 40、14. 37 U·g−1,脲酶活性则表现为Mode1和CK2较高,分别为2. 23、2. 35 U·g−1;α-葡萄糖苷酶则表现为3 种生草处理均显著高于两组对照,纤维素酶活性则表现为CK2最小,β-葡萄糖苷酶则表现为Mode3最低。5 种模式土壤酸性磷酸酶、多酚氧化酶活性均无显著差异。

表3 5 种土壤管理模式对锥栗园土壤酶活性的影响Table 3 Effects of five soil management modes on soil enzyme activities of C. henryi orchard(U·g-1)
2. 2 5 种土壤管理模式对锥栗土壤微生物多样性的影响
2. 2. 1 5 种土壤管理模式对锥栗土壤细菌门水平主要丰度的影响 在门水平上(图1),5 种模式土壤共有优势细菌群落从高到低分别为放线菌门(Actinobacteria,24. 9%~28. 9%)、变形菌门(Proteobacteria,20. 9%~28. 8%)、绿弯菌门(Chloroflexi,13. 7%~18. 6%)、酸杆菌门(Acidobacteria,10. 8%~12. 9%)、拟杆菌门(Bacteroidetes,4. 6%~6. 9%)、浮霉菌门(Planctomycetes,3. 2%~4. 2%)、芽单胞菌门(Gemmatimonadetes,1. 8%~2. 3%)、厚壁菌门(Firmicutes,1. 4%~1. 9%)。其中,放线菌门细菌相对丰度较高为Mode1(28. 9%)、Mode2(28. 4%)和CK1(28. 9%),变形菌门细菌相对丰度较高为CK2(28. 8%),绿弯菌门细菌相对丰度较高为3 种生草处理(16. 8%~18. 6%),拟杆菌门细菌相对丰度较高为CK1(6. 9%),Mode2酸杆菌门细菌相对丰度(10. 8%)显著降低;5 种模式土壤浮霉菌门、芽单胞菌门、厚壁菌门细菌无显著差异。总体来讲,与CK1和CK2相比,3 种人工生草处理土壤变形菌门、拟杆菌门和厚壁菌门细菌相对丰度均有所下降,绿弯菌门和浮酶菌门细菌则有所增加。
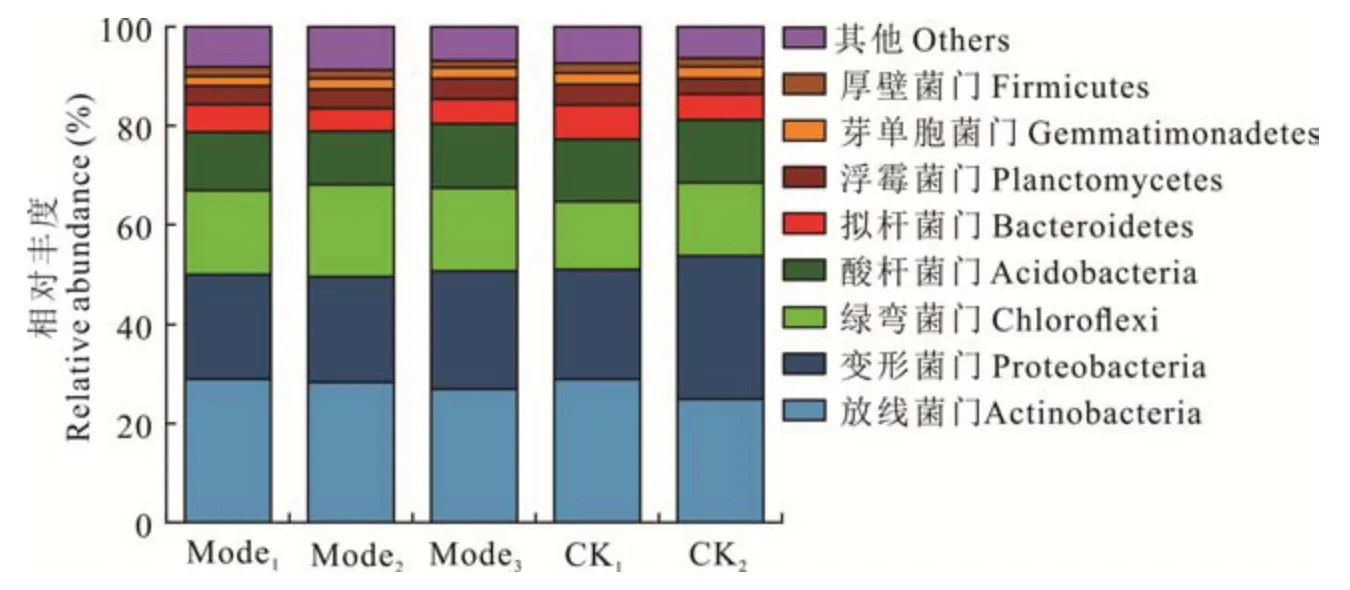
图1 5 种土壤管理模式下锥栗园土壤细菌门水平的相对丰度Fig. 1 Effects of five soil management models on relative abundance of soil bacteria in C. henryi orchard
2. 2. 2 5 种土壤管理模式对锥栗土壤真菌门水平主要丰度的影响 在门水平上(图2),5 种模式土壤共有优势真菌群落从高到低分别为子囊菌门(Ascomycota,37. 4%~73. 7%)、担子菌门(Basidiomycota,15. 3%~54. 4%)、被孢霉门(Mortierellomycota,2. 1%~4. 3%)、壶菌门(Chytridiomycota,0. 2%~0. 5%)、罗兹菌门(Rozellomycota,0. 16%~0. 36%)、球囊菌门(Glomeromycota,0. 01%~0. 23%)、丝足虫门(Cercozoa,0. 04%~0. 10%)、毛霉门(Mucoromycota,0. 01%~0. 08%)。其中,子囊菌门真菌相对丰度最高为Mode3(73. 7%);担子菌门真菌相对丰度较高为Mode1(49. 7%)、Mode2(54. 4%)和对照处理CK2(54. 9%),CK1(36. 9%)次之,Mode3(15. 3%)最低;被孢霉门真菌则表现为Mode3(4. 3%)>CK2(3. 3%)>Mode2(2. 7%)>Mode1(2. 5%)>CK1(2. 1%);毛霉门真菌表现为3 种生草处理大于两组对照。
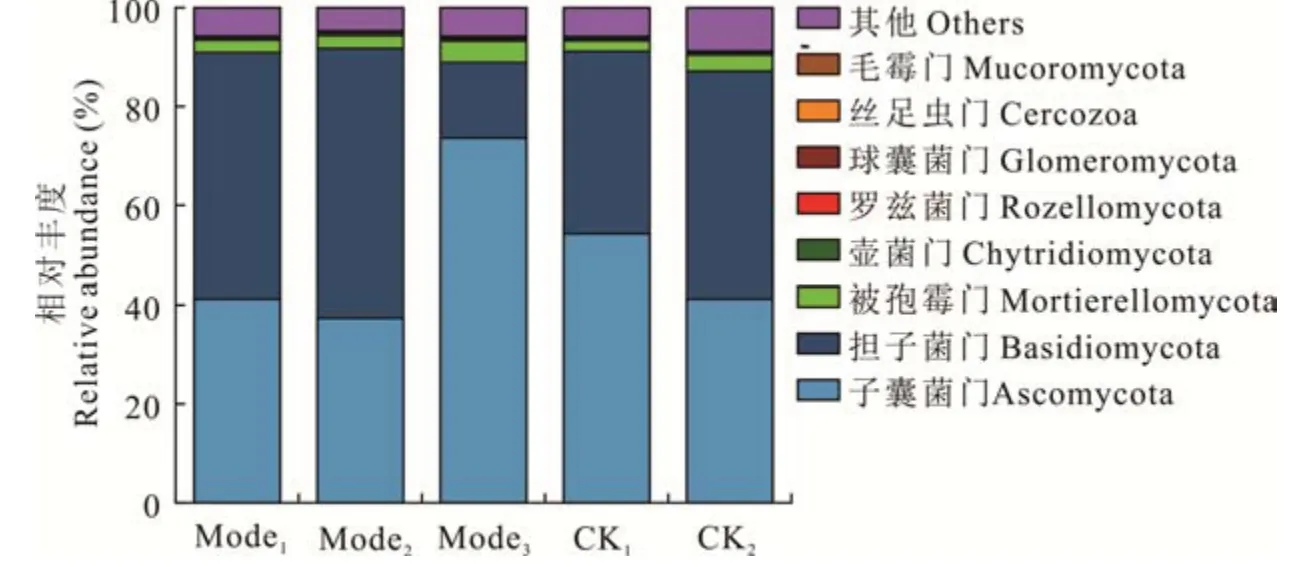
图2 5 种土壤管理模式下锥栗园土壤真菌门水平的相对丰度Fig. 2 Effects of five soil management models on relative abundance of soil fungi in C. henryi orchard
基于OTU 分类操作单元对5 种模式的土壤细菌、真菌群落组分进行NMDS 分析,结果表明(图3),5 种模式土壤细菌群落分布较为集中,且各模式间未明显分开,表明5 种模式细菌群落结构无显著差异。而5 种模式土壤真菌群落均较分散,且各模式间均能独立分开,表明5 种模式真菌群落结构有显著差异。

图3 土壤细菌、真菌群落结构的非计量多维尺度转换排序(NMDS)分析Fig. 3 Non quantitative multidimensional scaling ordination(NMDS)analysis of soil bacterial and fungal community structure
2. 3 5 种土壤管理模式土壤微生物多样性指数
由表4 可知,5 种模式的Goods_coverage 指数均接近于1,表明土壤微生物测序深度基本达到全覆盖水平,能够较为全面地揭示土壤样品的微生物组成。Chao1 指数用以反映微生物群落的丰富度,即指群落中物种的数量,而不考虑群落中每个物种的丰度情况。Shannon 指数用以反映微生物群落的多样性,受样品中微生物群落物种丰富度和均匀度的协同影响。3 种生草处理土壤细菌群落多样性指数与两组对照模式相比均有所提升,土壤真菌群落多样性指数则相反;与其他处理相比,CK2真菌群落的OTUs、Chao1 和Shannon 指数最大,分别为1876,1982 和7. 31。

表4 锥栗园5 种土壤管理模式土壤微生物多样性指数Table 4 Soil microbial diversity index of five soil management models in C. henryi orchard
2. 4 微生物群落结构与土壤环境因子的响应关系
2. 4. 1 细菌群落结构与土壤环境因子的响应关系 相关系数热力图(correlation coefficient heatmap)能够直观展现出不同土壤环境因子与细菌、真菌群落的相关性。由图4 可知,细菌群落结构门分类水平中拟杆菌门与自然含水率(WC)、多酚氧化酶(PPo)呈显著负相关关系,多酚氧化酶与厚壁菌门显著负相关,浮霉菌门与纤维素酶(Cel)显著正相关,芽单胞菌门与α-葡萄糖苷酶显著负相关。

图4 土壤环境因子与细菌门水平相对丰度相关系数热力图Fig. 4 Thermodynamic diagram of correlation coefficient between soil environmental factors and relative abundance of bacteria at phylum level
2. 4. 2 真菌群落结构与土壤环境因子的相关关系 由图5 可知,土壤养分含量和酶活性与真菌群落结构均呈现较强的相关关系,其中子囊菌门与土壤孔隙度(PO)、蔗糖酶(Suc)呈显著负相关关系,与土壤容重(BD)呈显著正相关关系;担子菌门与土壤孔隙度、蔗糖酶显著正相关,与土壤容重呈显著负相关关系;被孢霉门与蔗糖酶显著负相关,壶菌门与纤维素酶(Cel)显著负相关;球囊菌门与多酚氧化酶(PPo)、α-葡萄糖苷酶显著负相关,与过氧化氢酶(Cat)显著正相关;毛霉门和碱解氮(HN)、有效磷(AP)、速效钾(AK)和α-葡萄糖苷酶均呈显著正相关关系。

图5 土壤环境因子与真菌门水平相对丰度相关系数热力图Fig. 5 Thermodynamic diagram of correlation coefficient between soil environmental factors and relative abundance of fungi at phylum level
2. 5 微生物群落影响因子分析
为进一步探究人工生草法和喷施草甘膦相较于传统清耕法的锥栗林土壤微生物群落变化的影响机制,以及确定能够引起这种变化所要改变的首要土壤环境因子,揭示人工生草−土壤−微生物间的相互作用关系,以土壤理化性质和酶活性为解释变量,微生物群落为响应变量,对供试样地中影响细菌群落和真菌群落的土壤环境因子分别进行冗余分析(RDA),结果显示如下:细菌群落的RDA 分析结果表明(图6a),第一排序轴解释贡献度为38. 25%,第二排序轴为29. 47%,前两轴总方差解释度为67. 72%,降维后信息保留相对较高,但无显著变量因子影响细菌群落组成;真菌群落的RDA 分析结果表明(图6b),第一排序轴解释贡献度69. 72%,第二排序轴为20. 12%,前两轴总方差解释度为89. 84%,降维后信息保留完整,且土壤蔗糖酶活性(贡献度为32. 4%,F=6. 2,P=0. 012)、土壤自然含水率(贡献度为12. 5%,F=3. 2,P=0. 036)、土壤过氧化氢酶活性(贡献度为9. 9%,F=3. 0,P=0. 050)、土壤全碳/氮(贡献度为12. 1%,F=5. 3,P=0. 016)、土壤碱解氮含量(贡献度为7. 4%,F=4. 5,P=0. 012)等土壤显著性变量因子对于样方沿着第一轴、第二轴的分布起到关键作用,是影响土壤真菌群落的主要因子。
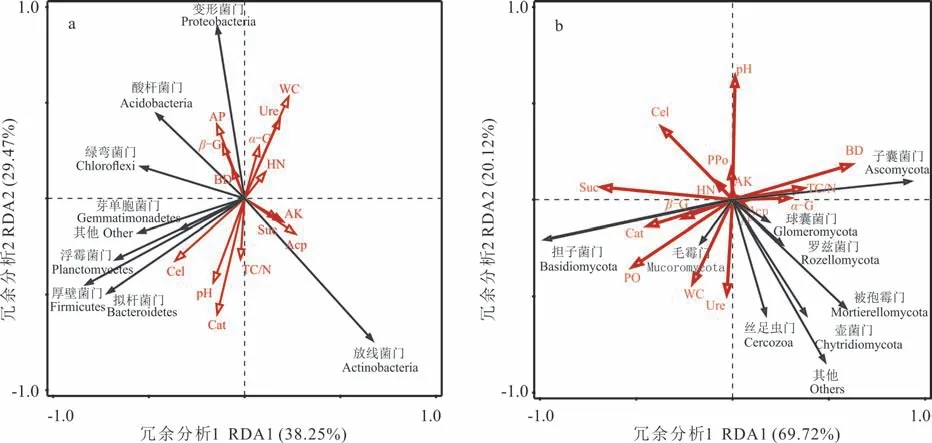
图6 土壤环境因子和土壤微生物群落结构冗余分析Fig. 6 Redundancy analysis of soil environmental factors and soil microbial community structure
3 讨论
3. 1 5 种土壤管理模式对锥栗土壤理化性质和酶活性的影响
本研究中,3 种生草处理土壤总孔隙度、自然含水率相比清耕模式均有所升高,一方面是由于绿肥生长迅速、茎叶茂盛、对地表遮蔽度高,可以明显地抑制根际表土水分的蒸发[6,10],另一方面绿肥根系的穿插作用,增大了土壤空隙,再者绿肥根茎周转及茎叶周期性干枯腐解产生的CO2和腐殖质降低了土壤的紧实度,有利于土壤团粒结构的形成和土壤通透度的改善[6]。Abdulaki 等[17]研究表明,绿肥通过根系的吸收富集作用可以将土壤深层的营养物质转移到土壤表层,增加表层土壤养分含量。王亚麒等[18]和杨叶华等[19]则指出,生草有利于活化土壤中的元素,提高土壤中有机质含量,增加土壤中有效态养分的含量。本研究也发现,3 种生草模式土壤有效态氮磷钾养分含量均高于清耕模式和喷施草甘膦模式。另外,丘陵山地锥栗园采用清耕或喷施草甘膦除草的方式管理地面,形成的裸露表土在雨季易发生水土流失,也会导致土壤养分含量下降[8−9]。
绿肥根系的胞外分泌物不仅直接增加了土壤有关酶种类,且根系分泌物和植被有机残体还提供了多种容易为微生物利用的营养和能源物质,从而增加了土壤微生物和相关酶类的活性[20]。井赵斌等[13]研究发现,猕猴桃(Actinidia Chinensis)园生草处理后,土壤过氧化氢酶、脲酶、蔗糖酶和磷酸酶活性分别较清耕处理高出35. 5%、24. 7%、47. 9% 和19. 2%。与前人研究结果相似,本研究鼠茅草和黑麦草处理土壤过氧化氢酶、蔗糖酶、酸性磷酸酶、纤维素酶和α-葡萄糖苷酶活性也高于清耕处理。但光叶紫花苕处理土壤过氧化氢酶、蔗糖酶、脲酶和β-葡萄糖苷酶活性则低于清耕处理,这可能与光叶紫花苕根茎生长和死亡分解过程释放的化感物质影响锥栗细根的正常生长,抑制相关酶类活性有关[21]。喷施草甘膦模式土壤蔗糖酶、脲酶、多酚氧化酶、α-葡萄糖苷酶和β-葡萄糖苷酶活性均较低,可能是由于枯死杂草腐解的茎叶中残存的草甘膦随雨水进入土壤,被锥栗根系吸收富集,络合对根尖分生组织有丝分裂有关键作用的营养元素而阻碍根系的生长,甚至阻断根系蛋白质的合成而致其死亡,导致根系分泌物急剧减少[9,22],土壤微生物由于底物减少,生长繁殖受到影响,胞外酶分泌减少,活性降低。
3. 2 5 种土壤管理模式对锥栗土壤细菌群落结构的影响
细菌作为土壤微生物的主要类群,约占其总体数量的70%~90%,对土壤生态功能的作用至关重要,是土壤质量优劣的敏感指标[23]。本研究利用高通量测序技术,对供试锥栗园不同生草模式、清耕和喷施草甘膦处理的土壤细菌群落进行分析,结果表明放线菌门、变形菌门、绿弯菌门和酸杆菌门细菌为优势类群。放线菌门和变形菌门细菌是陆地生态系统的主要优势类群,生态幅宽广,环境适应能力较强[24],因此,锥栗园土壤管理方式的改变对其优势种群地位的影响较小;绿弯菌门细菌是一类兼性厌氧型菌群,虽在养分匮乏的条件下,能表现出一定的光能自养型特征,但仍以无光或有光且缺氧的条件下的化能或光能异养生长为主[25]。3 种人工生草处理由于生草覆盖使锥栗园表层土壤光照降低,对绿弯菌门细菌的生长更有利,因此其相对丰度均高于清耕和喷施草甘膦处理。酸杆菌门是新近被分出的一门细菌,主要为嗜酸菌,大多数研究表明其相对丰度与土壤pH 呈负相关关系[26],但本研究中,供试锥栗园的酸杆菌门细菌与pH 无显著相关关系,可能与研究区酸杆菌门亚群及土壤环境因子不同有关[27],这有待进一步研究验证。另外,有研究指出,变形菌门、拟杆菌门、硝化螺旋菌门以及厚壁菌门细菌为快速生长型菌群,而酸杆菌门、绿弯菌门、浮霉菌门和疣微菌门细菌为缓慢生长型菌群[28]。本研究中,与清耕和喷施草甘膦相比,3 种人工生草处理土壤变形菌门、拟杆菌门和厚壁菌门细菌相对丰度均有所下降,绿弯菌门和浮酶菌门细菌则有所增加,细菌类群有从快速生长型向缓慢生长型转变的趋势,这与张胜男等[29]对榆树(Ulmus pumila)疏林封育自然生草后,土壤微生物从缓慢生长型向快速生长型转变的结论相反,这是由于清耕和喷施草甘膦处理虽去除了园内杂草,但锥栗园裸露的坡面在雨季易造成水土养分流失,而快速生长型细菌类群由于其嗜营养特性,能快速吸收锥栗园每年为增加锥栗产量而追施的肥料,进而保障其生存繁殖[30];锥栗园人工生草后,土壤蓄水保肥能力变强,土壤环境相对稳定,土壤微生物种类趋于多元,缓慢生长型细菌类群也能逐渐生存定殖。
本研究发现,3 种锥栗园人工生草处理与喷施草甘膦和清耕相比,细菌类群的丰富度和多样性均有所增加,这是因为生草根系分泌物、细根周转及枯死茎叶腐解为土壤细菌分解输入大量有机底物[10],激发其快速增殖,又因为生草种类的不同,输入底物的碳氮比有所不同,使各模式间细菌优势种群表现出一定的差异性,但未达到显著性水平,这可能与人工生草年限较短有关[7]。本研究NMDS 和RDA 分析也表明,锥栗园5 种土壤管理模式细菌群落组分未发生统计学意义上的显著变化,说明供试锥栗园土壤细菌群落较为稳定,生草措施短时间内的影响作用有限。
3. 3 5 种土壤管理模式对锥栗土壤真菌群落结构的影响
真菌作为一种种类繁多、分布广泛的真核微生物,在维持各类生态系统的生态平衡中均扮演重要角色[31]。本研究中,5 种锥栗园土壤管理模式土壤真菌的优势类群均为子囊菌门和担子菌门,约占总真菌数量的90% 以上,这与前人的研究结果一致[32]。子囊菌门大多为腐生菌,承担着分解木质素、角质素等难降解有机质的任务,在土壤养分循环中起关键作用[33]。子囊菌门和担子菌门能够快速代谢植物根际沉积的有机底物,加快土壤碳循环[29]。而毛霉门真菌大多腐生于土壤动物粪便、动植物残体等基物中,或寄生于动植物甚至其他真菌中[34]。本研究中,3种锥栗园人工生草处理毛霉门相对丰度均显著高于两种对照,这可能与人工生草增加土壤腐殖质和土壤小动物,促进毛霉门真菌的生长有关。另外,被孢霉门某些特定被孢霉菌对土壤养分转化和有效性具有重要贡献,有可以在土壤中释放多种有机酸来溶解土壤磷的潜力,也可影响矿质土壤养分的转化和促进植物生长[35]。本研究中,锥栗园种植光叶紫花苕处理被孢霉门真菌含量最高,可能与被孢霉菌易与光叶紫花苕根系共生,形成根系共生真菌有关,但还需进一步研究验证。
本研究发现,3 种锥栗园人工生草处理和喷施草甘膦土壤真菌群落的Chao1 和Shannon 指数与清耕相比,均有所下降,这可能与生草内生真菌代谢物有关[36],有研究指出,果园生草后,不同草种的内生真菌会分泌多种毒素和生物碱,通过根系沉积物、凋落物和根组织分泌物等形式,抑制病原菌的侵染和群落组成[37]。而喷施草甘膦则会降低部分外生菌根真菌如牛肝菌属的丰度,破坏根际外生菌根真菌的微生态平衡,进而降低土壤真菌多样性和丰富度[38]。
NMDS 分析表明,供试锥栗园5 种土壤管理模式间的真菌群落结构存在显著差异,是因为相较于土壤细菌,真菌在土壤微生物中的数量较少,个体较大,生长速度相对缓慢,对环境变化的响应较敏感[38]。RDA 分析表明,驱动锥栗园土壤真菌群落结构变化的主要土壤因子为蔗糖酶、土壤含水率、过氧化氢酶、土壤全碳/氮和碱解氮含量。鼠茅草和黑麦草处理与其他处理的真菌群落结构差异,主要由土壤蔗糖酶、过氧化氢酶和土壤碱解氮含量等因素主导。其中,鼠茅草属冷季型牧草,夏季高温倒伏枯死,不仅抑制了果园杂草生长,而且腐解的茎叶向土壤输入大量有机物[39],增加了土壤担子菌门、毛霉门、壶菌门和球囊菌门真菌的数量,提高了土壤蔗糖酶和过氧化氢酶活性,使土壤碱解氮含量升高,有利于满足处于坐果期锥栗的氮素需求。黑麦草根系发达,细根周转快,根系分泌物丰富[5,13],同样有利于前述真菌类群的生长繁殖,提高土壤蔗糖酶和过氧化氢酶活性,但由于调查期间,处于生长盛期的黑麦草与锥栗存在一定的水肥竞争,因此土壤碱解氮含量较鼠茅草处理低。光叶紫花苕系豆科野豌豆属草本,具固氮根瘤,调查期间由于完成生命周期开始干枯腐解,会显著提升分解有机含氮化合物能力强的毛霉门真菌的相对丰度[40],增加土壤氮素含量,但是腐解的茎叶和根系同时也会释放萜类、生物碱类化感物质,抑制土壤过氧化氢酶、蔗糖酶的活性[21],改变相关真菌优势门相对丰度。草甘膦则通过抑制丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)孢子活力和定殖能力,降低AMF 和植物根系对土壤氮素的有效吸附和保留能力[41],使土壤全碳/氮上升。清耕模式由于地表草被覆盖低,夏季蒸发散强烈,土壤含水率显著低于其他模式,有研究指出,亚热带地区土壤微生物活性对土壤湿度的敏感度高于土壤温度[42],因此土壤含水率成为该模式土壤真菌群落结构的主要限制因子。相应地,3 种生草处理较低的全碳/氮和较高的土壤含水率,两组对照较低的土壤蔗糖酶、过氧化氢酶活性、碱解氮含量也是驱动锥栗园不同模式土壤真菌群落分异的重要因素。
4 结论
与传统清耕法和喷施草甘膦相比,生草法管理锥栗园,一定程度上改变了林地的土壤环境,进一步影响了土壤微生物群落。其中,土壤细菌类群多样性和丰富度指数均有所提升,呈现由快速生长型向缓慢生长型转变的趋势;而土壤真菌类群由于不同的生草草种产生明显分异,显著相关的土壤环境因子主要为土壤蔗糖酶活性、自然含水率、过氧化氢酶活性、全碳/氮和碱解氮含量。丘陵山区锥栗园传统的地面管理措施,导致的水土流失、化肥面源污染,以及锥栗树势衰退、产量降低等问题,已无法满足锥栗木本粮食产业健康、快速发展的需求。本研究通过实践证明,生草法对于改善锥栗园土壤质量,增加土壤微生物群落多样性和丰富度,提升土壤有效养分利用率,促进锥栗健康生长,均有重要作用,可为今后南方丘陵山区锥栗园生草制度的科学制定和高品质生态锥栗产业的可持续发展提供参考。
