不同密度布氏田鼠对内蒙古典型草原菌根真菌群落的影响
2021-11-22刘荣荣王平代心灵陈科宇李国梁宛新荣纪宝明
刘荣荣,王平,代心灵,陈科宇,李国梁,宛新荣,纪宝明*
(1. 北京林业大学草业与草原学院,北京100083;2. 中国科学院动物研究所,农业虫害鼠害综合治理研究国家重点实验室,北京100101)
内蒙古典型草原是我国北方重要的生态屏障,在防风固沙、涵养水源、维持碳平衡及调节气候等方面发挥着重要作用[1]。由于气候变化及人类活动,内蒙古草原出现不同程度退化,而草地退化往往伴随着啮齿动物种群的聚集[2]。布氏田鼠(Lasiopodomys brandtii)是内蒙古典型草原主要啮齿类动物种,是草原生态系统的重要组成部分,布氏田鼠活动一方面能够直接影响草原植被的生长,改变群落组成和多样性,另一方面其挖掘行为可以改变土壤物理结构,影响土壤化学性质[3]。布氏田鼠活动所引起的植被与土壤的改变,极有可能进一步对生态系统的其他组分和生态过程产生潜在的重要影响。
迄今为止的研究发现,啮齿动物的活动能够直接改变草地生态系统地表地形、植物群落特征以及土壤理化特征[4−7]。啮齿动物对植物种子和茎叶的啃食会抑制植物生长,导致植物数量减少,进而降低了植被盖度和生物量[8]。同时,随着啮齿动物挖掘所形成土丘的增加,杂类草植物逐渐成为草地的优势种群,使群落结构发生改变[9−10]。但Lindtner 等[11]研究发现,啮齿动物的扰动增加了植物多样性、提高了草甸的质量,推动草原生态系统异质性、多样性发展[5,12]。对于土壤理化特征,啮齿动物挖掘行为改变了土壤粒径分布,使得土壤孔隙度和透气性增加、土壤容重降低[13−14]。此外,其活动改变了地表径流和侵蚀程度,进而改变土壤水分,同时加快了有机质的分解与转化,改变了土壤养分状况[14−16]。显而易见,任何植物群落和土壤性质的变化均有可能改变草原土壤微生物群落的组成和多样性,大量研究表明,植物群落的组成、生物量和丰富度均影响土壤微生物群落的组成和多样性[17−18],土壤养分的变化也可显著改变地下真菌的群落组成和多样性[19−20]。据此推测,啮齿动物活动可以通过改变植物群落和土壤性质对土壤微生物产生影响,但目前关于布氏田鼠活动对土壤微生物影响的研究鲜有报道。
土壤微生物作为草原生态系统的重要组分,在草地多样性和生产力维持以及生态演替过程中发挥着关键作用,其中丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是分布最广泛、功能最重要的共生微生物类群之一。在草地生态系统中,AMF 能够与80% 的植物形成互惠共生体,在调控植物的生理、生长、群落组成和多样性以及土壤的物理结构和养分周转等方面发挥着关键作用[19−22]。虽然大量的研究证明地上植物和地下土壤的变化均能够影响AMF 群落的组成和多样性[23−25],但到目前为止,关于布氏田鼠活动的研究主要集中于其穴居行为对植被群落和土壤特征的影响[3,26],对AMF 群落组成和结构的影响仍然空白。基于此,本研究依托中国科学院动物研究所在内蒙古自治区锡林浩特市毛登牧场草原动物生态研究站建立的大型野外布氏田鼠围场,通过研究不同密度布氏田鼠活动对土壤AMF 群落组成和结构的影响,探究啮齿动物−植物−AMF 三者间的关系,以期为草地生态系统的合理管控及应用提供更为全面的数据支撑。
1 材料与方法
1. 1 样地概况与试验设计
研究地点位于内蒙古自治区锡林郭勒盟锡林浩特市毛登牧场内的中国科学院动物研究所草原动物生态研究站(44°18′N,116°45′E,海拔1079 m)。该区域属于半干旱草原气候,冬季寒冷干燥,夏季温和湿润,年平均温度3 ℃,年平均降水量346. 1 mm,土壤类型以暗栗钙土为主。该区域草原属于温带典型草原,主要优势植物为羊草(Leymus chinensis)、大针茅(Stipa grandis)和糙隐子草(Cleistogenes squarrosa)。
中国科学院动物研究所于2008 年5 月在内蒙古草原动物生态研究站设置了24 个大型布氏田鼠围场,每个围场面积4800 m2(80 m×60 m),围场四周用2. 4 m 的镀锌钢板进行围封,钢板高出地面1. 4 m,延伸到地下1 m。钢板上方围有50 cm 高的铁丝网(网格孔径1 cm),铁丝网顶部用尼龙网覆盖(网格孔径10 cm),以此控制大型动物、布氏田鼠等在围栏之间的活动,也防止哺乳动物或鸟类等捕食者的进入。从2018 年开始,每年5 月初将野外捕获的布氏田鼠投放到相应的围场,每月进行一次标志重捕统计布氏田鼠数量,9 月底将围场内所有布氏田鼠清除以确保第二年投放之前围场内布氏田鼠数量为0。本研究取样时间为2019 年9 月,选取3 个代表不同密度布氏田鼠处理的围场以探究不同密度布氏田鼠活动对AMF 群落组成和多样性的影响,其中低密度处理围场当年5 月投放布氏田鼠12 只,中密度处理投放布氏田鼠24 只,高密度处理投放布氏田鼠48 只(布氏田鼠雌雄比为1∶1),当年9 月底重捕统计布氏田鼠数量时低密度、中密度和高密度围场对应的数量分别为66、133 和201 只。
1. 2 样品采集与指标测定
于2019 年9 月下旬进行植物群落调查和土壤样品采集。在不同密度布氏田鼠围场分别选取6 个洞群密集区域设置样方进行群落调查,样方面积为0. 5 m×0. 5 m,分物种测定植株高度、密度以及群落盖度。地上部分贴近土壤平面分种进行刈割,60 ℃烘干至恒重后称取地上生物量。在植物群落调查样方内进行根系和土壤样品采集,用土钻采集0~15 cm 土样,3 钻土壤混合成1 个土壤样品,共计18 个样品。土壤过2 mm 的筛子,去除残留的枯落物及混杂物。将土壤和根系进行分离,植物根系用于AMF 菌丝侵染率的测定[27],土壤样品采集后分成两份,一份保存于−20 ℃进行土壤菌丝密度测定[27],另一份风干后用于测定土壤理化性质。
土壤含水量(soil water content,SWC)采用烘干法测定[28],土壤pH 值采用复合玻璃电极检测[28],土壤有机质(soil organic matter,SOM)采用重铬酸钾容量法−稀释热法测定[29];土壤全氮(soil total nitrogen,TN)采用凯氏定氮法[30]测定;土壤全磷(soil total phosphorus,TP)采用高氯酸−硫酸法消煮钼锑抗显色后用分光光度法定量测定[28],土壤有效磷(soil available phosphorus,AP)用0. 5 mol·L−1碳酸氢钠浸提−钼锑抗比色法测定[31];土壤铵态氮(NH4+-N)、硝态氮(NO3−-N)采用2 mol·L−1KCl 浸提−靛酚蓝比色法测定[28]。
使用DNeasy Powersoil Kit 试剂盒(Qiagen,德国),按照说明书进行土壤DNA 的提取,以NS31(TTGGAGGGCAAGTCTGGTGCC)-AML2(GAACCCAAACACTTTGGTTTCC)和AMDGR(CCCAACTATCCCTATTAATCAT)-AMV4. 5NF(A-AGCTCGTAGTTGAATTTCG)分别作为第1 轮和第2 轮PCR 引物进行巢室PCR 扩增,使用1% 的琼脂糖凝胶对第2 轮PCR 产物进行电泳检测和胶回收,在荧光切胶台上切取目的胶带,使用胶纯化试剂盒(Axygen,Union City,CA,USA)进行回收和纯化。使用NanoDrop ND-8000 测定纯化后的DNA 样品浓度,将全部样品等摩尔混合进行Illumina-Miseq 高通量测序,通过Illumina MiSeq 测序平台获得不同操作分类单元(operational taxonomic units,OTU)代表序列,将序列上传至NCBI 数据库(https://www. ncbi.nlm. nih. gov/;)与GenBank 中已有序列进行BLAST 比对,在97% 的序列相似性水平上进行OTUs 的划分,使用MEGA 7 建立系统发育树。
1. 3 数据统计与分析
运用IBM SPSS 20. 0 统计软件对不同密度布氏田鼠处理下植物群落特征、土壤理化性质、根系侵染率、土壤菌丝密度、AMF 群落多样性数据进行单因素方差分析,采用Duncan 法多重比较检验各个处理间的差异显著性,显著性水平为P<0. 05。 利用R 语言中的vegan 包进行非度量多维尺度分析(non-metric multidimensional scaling,NMDS)和“Adonis”函数进行非参数多元方差分析(permutational multivariate analysis,PerMANOVA)分析不同密度布氏田鼠处理对AMF 群落结构的差异性。利用冗余分析(redundancy analysis,RDA)解释土壤理化特征和植被群落特征对AMF 群落的影响。
2 结果与分析
2. 1 不同密度布氏田鼠对植物群落的影响
布氏田鼠密度处理显著影响植物群落生物量和盖度(图1)。随着布氏田鼠密度的增加,植被群落地上生物量与地下生物量均呈下降趋势,且高密度处理地上生物量显著低于中、低密度处理(P<0. 05),其中高密度处理相较于低密度处理下降了30. 51%,相较于中密度处理下降了29. 92%。地下生物量在高密度处理下显著低于低密度处理(P<0. 05),高密度处理相较于低密度处理下降了33. 71%,相较于中密度处理下降了20. 65%。植被盖度随着布氏田鼠密度的增加先降低后上升,中密度处理显著低于低、高密度处理(P<0. 05),其中,中密度处理相较于低密度处理下降了20. 86%,相较于高密度处理下降了33. 66%。

图1 不同密度布氏田鼠对植物群落生物量和盖度的影响Fig. 1 Effects of different densities of Brandt’s voles on the biomass and coverage of plant communities
布氏田鼠密度处理显著改变了植物群落多样性和丰富度(图2)。随着布氏田鼠密度的增加,植物群落多样性和物种丰富度呈下降趋势,植物群落物种丰富度在中、高密度处理下显著低于低密度处理(P<0. 05),其中,中密度处理相较于低密度处理下降了21. 05%,高密度处理相较于低密度处理下降了17. 55%。植物群落多样性在高密度处理下显著低于低、中密度处理(P<0. 05),高密度相较于低密度处理下降了85. 1%,相较于中密度处理下降了82. 6%。

图2 不同密度布氏田鼠对植物群落物种丰富度和香农-威纳指数的影响Fig. 2 Effects of different densities of Brandt’s voles on the plant communities OTU richness and Shannon-wiener index
2. 2 不同密度布氏田鼠对土壤理化性质的影响
随着布氏田鼠密度的增加土壤有机质含量显著下降(P<0. 05)、硝态氮含量显著上升(P<0. 05),土壤pH、全氮、全磷以及铵态氮含量呈下降趋势,土壤含水量先增加后降低,且高密度处理下土壤pH、全氮、全磷、铵态氮以及土壤含水量显著低于低、中密度处理(P<0. 05)。布氏田鼠密度处理对土壤有效磷含量影响不显著(P>0. 05,表1)。
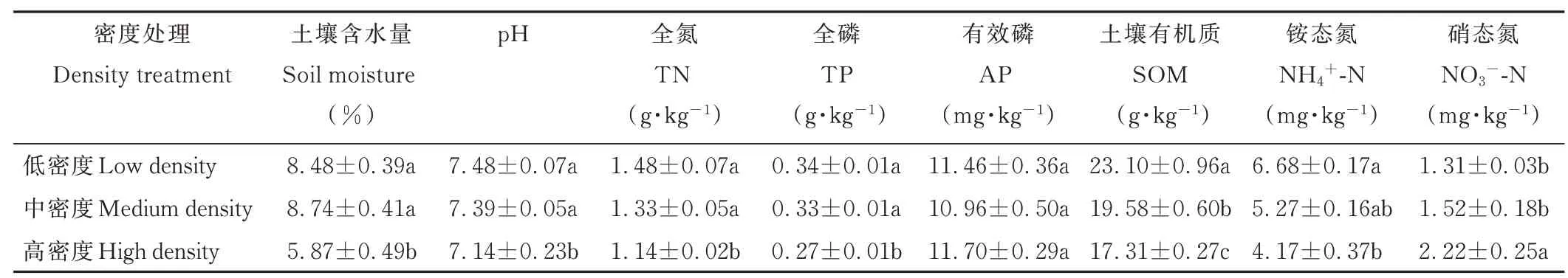
表1 不同密度布氏田鼠处理下土壤理化性质Table 1 Soil characteristics in different densities of Brandt’s voles
2. 3 不同密度布氏田鼠对AMF 群落的影响
随布氏田鼠密度的增加,AMF 菌丝侵染率先增加后降低,高密度处理下菌丝侵染率显著低于中密度处理(P<0. 05),高密度处理相较于中密度处理侵染率下降了69. 46%,相较于低密度处理下降了53. 73%。土壤菌丝密度随布氏田鼠密度增加呈下降趋势,高密度处理下土壤菌丝密度显著低于低、中密度处理(P<0. 05),其中高密度处理相较于低密度处理下降了56. 55%,相较于中密度处理下降了54. 06%(图3)。

图3 不同密度布氏田鼠处理下菌丝侵染率和菌丝密度Fig. 3 Mycorrhizal colonization and hyphal length density in different densities of Brandt’s voles
随布氏田鼠密度的增加,土壤AMF 群落OTU 丰富度、香农−威纳指数先增加后下降。AMF 群落OTU 丰富度在高密度处理下显著低于低、中密度处理(P<0. 05),其中高密度处理相较于低密度处理下降了17. 21%,相较于中密度处理下降了23. 12%。香农−威纳指数在高密度处理下显著低于中密度处理(P<0. 05),与低密度处理间差异不显著(P>0. 05),其中高密度处理相较于低密度处理下降了9. 95%,相较于中密度处理下降了14. 15%(图4)。
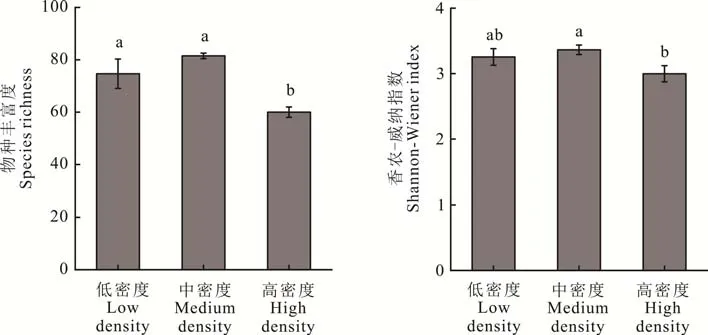
图4 不同密度布氏田鼠处理下AMF 物种丰富度和香农-威纳指数Fig. 4 AMF OTU richness and Shannon-Wiener index in different densities of Brandt’s voles
从18 个土壤样品中共鉴定出146 个OTU,分属4目6 科9 属,包括球囊霉属(Glomus)、近明球囊霉属(Claroideoglomus)、盾巨孢囊霉属(Scutellospora)、隔球囊霉属(Septoglomus)、斗管囊霉属(Funneliformis)、双型囊霉属(Ambispora)、根孢囊霉属(Rhizophagus)、多样孢囊霉属(Diversispora)和类球囊霉属(Paraglomus)。其中,低密度处理下优势属为球囊霉属(72. 59%)和近明球囊霉属(22. 80%),中密度处理下优势属为球囊霉属(86. 77%)和近明球囊霉属(6. 2%),高密度处理优势属包括球囊霉属(88. 22%)、近明球囊霉属(5. 30%)以及盾巨孢囊霉属(3. 52%)。与低密度处理相比,中、高密度处理显著降低了近明球囊霉属的相对丰度(P<0. 05,图5)。

图5 不同密度处理下基于属水平的AMF 相对丰度Fig. 5 Relative abundances of AMF at the genus level in different density treatment
通过NMDS 和PerMANOVA 分析对不同密度处理下AMF 群落结构进行差异性检验,结果表明,高密度和低密度布氏田鼠处理下AMF 群落结构差异显著(P<0. 05),中密度布氏田鼠处理下AMF 群落结构与其他两个处理差异不显著(P>0. 05,图6)。

图6 AMF 群落结构在不同密度处理下的NMDS 排序Fig. 6 NMDS plots demonstrating the effects of sampling sites on AMF communities in different densities
2. 4 土壤因子和植物多样性对AMF 群落的影响
通过对菌丝密度、菌丝侵染率、AMF 群落多样性与土壤理化性质、植物群落特征进行相关性分析,结果表明,土壤菌丝密度与硝态氮极显著负相关(P<0. 01),与土壤全氮、全磷、pH、含水量、有机质以及植物香农−威纳指数极显著正相关(P<0. 01)与植物丰富度显著正相关(P<0. 05)。根系菌丝侵染率与土壤pH、含水量极显著正相关(P<0. 01),与香农−威纳指数显著正相关(P<0. 05)。AMF 群落OTU 丰富度与土壤pH 和香农−威纳指数显著正相关(P<0. 05),AMF 群落香农−威纳指数与土壤pH 和土壤含水量显著正相关(P<0. 05,表2)。

表2 菌丝密度、菌丝侵染率、AMF 群落多样性与环境因子的相关性分析Table 2 Correlation analysis of hyphal length density,mycorrhizal rate,AMF community diversity and environmental variables
对AMF 群落结构与土壤理化性质、植物群落特征、菌丝侵染率、菌丝密度进行RDA 分析,结果表明,土壤pH、硝态氮、菌丝密度和菌丝侵染率显著影响了AMF 群落结构(P<0. 05),共能解释46. 03% 的AMF群落结构变化。其中pH 的解释度为20. 7%,NO3−的解释度为14. 3%(图7)。

图7 AMF 群落结构与环境因子RDA 分析Fig. 7 RDA analysis between AMF community structure and environmental factors
3 讨论
植物群落是陆地生态系统的重要组成部分,其组成和多样性决定了生态系统的结构和功能[32−34]。啮齿动物的活动行为将直接影响植物群落组成、生产力以及物种多样性[35−36]。本研究发现,中密度布氏田鼠处理对植物群落影响相对较弱,高密度处理显著降低了植物群落生物量、丰富度和多样性指数,与Semenov等[36]的研究结果一致。 一方面,布氏田鼠对植物茎叶、根系的采食造成的损伤会导致植物生长受到抑制,进而直接影响植物群落;另一方面,较高的田鼠数量会增加其挖掘行为的频率,使植物生长的微地形和土壤物理结构发生变化,对植物群落产生间接影响,二者综合影响导致植物群落生物量、丰富度和多样性显著下降[37−38]。有研究表明AMF 群落与植物群落之间存在较强的“共变性”,植物群落发生改变后AMF 群落通常随之产生变化,反之亦然[25,39−40],本研究中,菌丝密度、菌丝侵染率、AMF 群落多样性均与植物群落多样性显著正相关,因为较高的植物群落多样性可以为AMF 群落提供更为丰富的生态位[41]。AMF 群落多样性、物种丰富度与植物群落多样性和丰富度显著正相关,植物群落的丰富度越高,AMF 群落的多样性越高[42]。本研究中,高密度布氏田鼠处理下侵染率、土壤菌丝密度以及群落多样性显著低于其他两个处理,这是由于布氏田鼠数量增加导致因啃食而被破坏的植物叶片数量降低,使光合作用产生的营养物质减少,植物能够向地下分配的碳源也逐渐减少,不能满足植物根系和AMF 菌丝的需求,从而导致侵染率降低,AMF 群落多样性下降[43−45]。因此,由布氏田鼠数量增加而引起的植物群落生物量和多样性的下降,是侵染率、菌丝密度以及AMF 群落多样性下降的重要影响因素之一。
土壤是陆地生态系统中物质循环和能量流动的重要载体,储存着大量的碳、氮、磷等元素,为植物生长提供水分和营养物质[46]。啮齿动物的活动能够对土壤理化特征产生影响[47−49]。本研究中,高密度布氏田鼠处理显著增加土壤硝态氮含量。土壤矿化作用受土壤透气性的影响,高密度布氏田鼠挖洞行为破坏土壤稳定性,增加的氧气供应会加快矿化作用的速度,导致土壤硝态氮含量增加[50−51]。田富等[47]研究发现,土壤含水量会随着鼠洞密度的增加而下降。本研究同样发现高密度布氏田鼠处理会显著降低土壤含水量,这是因为高密度鼠群过度挖掘行为持续将下层松散土壤运输到地表形成土丘,裸露的鼠丘降低土壤保水性能、加速水分蒸发,导致土壤含水量下降[52]。刘碧颖等[53]以鼠洞数量表征鼠群密度发现pH 随鼠群密度梯度的增加逐渐递增,且高密度梯度下pH 最高。而本研究中,高密度布氏田鼠使土壤酸化,显著降低土壤pH。由于土壤pH 受气候条件、土壤理化性质和土地利用方式等多因素影响[54−56],其中持续的氮沉积到生态系统可直接导致土壤酸化[57],因此,本研究中高密度布氏田鼠活动导致的硝态氮含量增加可能是土壤pH 下降的关键因素[58]。
有研究表明,土壤理化特征能够影响AMF 群落结构及多样性[59−60]。其中,土壤pH 是影响AMF 群落多样性和结构的重要因子[44,61]。本研究中,土壤pH 显著影响菌丝密度、侵染率以及AMF 群落多样性。土壤酸碱度可以直接影响AMF 真菌孢子的产生和菌丝的生长,破坏其网络结构,从而改变AMF 群落结构和多样性[60−62]。此外水分也显著影响菌丝密度、侵染率以及AMF 群落多样性。Martínez-García 等[63]发现水分胁迫显著降低AMF 群落泡囊和丛枝侵染率,因为AMF 群落对水分变化有强烈的依赖性,较低的土壤水分会减缓胞外菌丝和土壤菌丝生长,进而影响AMF 的群落结构和多样性[64−65]。本研究中,不同密度布氏田鼠处理下菌丝密度与土壤硝态氮显著负相关。AMF 通过菌丝吸收土壤中的硝态氮,高的硝态氮含量可以促进AMF 菌丝生长[66],而本研究发现高的硝态氮含量抑制AMF 菌丝生长,可能是由于高密度布氏田鼠活动导致的矿化速率增加,土壤硝态氮的可获得性提升,植物更倾向于通过自身根系对其进行吸收而非通过菌丝,从而降低了对AMF 的资源投入,使土壤中AMF的菌丝生长受到抑制[67]。因此,不同密度布氏田鼠处理可能通过改变土壤养分、水分和pH 间接影响土壤AMF群落结构和多样性。
4 结论
在典型草原区,中、低数量的布氏田鼠分布对植物群落和土壤的影响相对较弱,但过高的布氏田鼠数量会导致植物群落生物量、多样性降低,土壤含水量和肥力下降,进而间接导致菌丝侵染率、菌丝密度以及AMF 群落多样性下降,表明大量的布氏田鼠活动可能会降低AMF 对植物生长的正反馈作用,进一步加剧草原退化程度。因此,在草地退化防治和管理过程中应增强对啮齿类动物分布数量的监控,对其种群数量进行一定的人为干预,从而维持草原植物群落的生产力和多样性,降低草地退化风险。
