高等植物阳离子转运载体OCT 研究进展
2021-11-22张亚楠欧斯艳王金祥
张亚楠,欧斯艳,王金祥*
(1.华南农业大学 资源环境学院;2.华南农业大学 根系生物学中心,广东 广州 510642)
在植物生长发育过程中,矿质元素、营养物质、信号分子等跨膜转运和长短距离运输是必不可少的,而承担这些任务的主要成员便是转运子(transporter)(或转运蛋白).有趣的是,研究发现植物中有些转运蛋白既有转运子的功能,又具有养分受体的功能,如NRT1.1(nitrate transporter 1.1)和IRT1(iron-regulated transporter 1).这类转运蛋白被称为转运受体蛋白(transceptor)[1-2].植物有机阳离子包括胆碱、肉碱、多胺,这些有机阳离子在植物生长发育和适应逆境等方面起重要作用,但对有机阳离子如何进出细胞还不清楚.动物四胺有机阳离子主要由SLC22 转运[3],SLC22 属于MFS(major facilitator superfamily)超家族.这些膜蛋白参与动物周围淋巴器官(peripheral organs)对一些药物、外来物质、或内源物质的吸收或排泄[4-9].目前关于植物有机阳离子转运体(Organic Cation Transporter,OCT)的研究相对较少,主要集中在模式植物拟南芥.本文从植物OCT 蛋白的结构、OCT基因对逆境的响应以及OCT 的功能等进行了综述.
1 植物OCT 家族
1.1 OCTs 家族蛋白结构的特点
首先在菜豆中鉴定植物OCT基因.Torres 等人在菜豆根中克隆了一个受水分胁迫调控表达的基因,序列分析表明,其全长cDNA 为2 627 bp,含有1 644 个碱基的开放阅读框,编码一个长度为547 个氨基酸的蛋白质,与哺乳动物OCT 转运蛋白家族具有同源性,因此命名为PvOCT1[10].另外,Lelandais-Briére 等人用PvOCT1 进行的BLASTX 分析,在拟南芥中发现6 个OCT-like 蛋白,分别命名为AtOCT1~6(见表1),其中 AtOCT1 与PvOCT1 有71%的相似性[11].这些拟南芥OCT 蛋白属于MFS 转运蛋白家族的“有机溶质共转运蛋白”的一个小分支.
TMPred 程序预测结果显示PvOCT1 蛋白存在12 个跨膜结构域(transmembrane domain,TMD),在TMD1 和TMD2 之间有一个由53 个氨基酸组成的大型胞外结构域,TMD6 和TMD7 之间有一个71 个氨基酸组成的长的中心亲水结构域[10].所有哺乳动物OCT 蛋白都属于MFS 超家族且都显示出糖转运蛋白家族的特征,例如位于TMD6 末端的ESPRXL 基序[12].植物OCT 蛋白也存在这个基序,如在PvOCT1 蛋白中可以观察到该基序以及有机离子转运蛋白的3 个特定结构域[5].此外,在PvOCT1 中发现了糖转运蛋白家族和ASF 共有的保守基序,在第151 位发现了1 个cAMP/cGMP 依赖性蛋白激酶的潜在磷酸化位点,在第263、328、389、413、418 和523 位发现了另外6 个蛋白激酶C 位点,在80、81 和295 位发现了3 个可能的N-糖基化位点[10].
拟南芥基因组共有6 个OCT基因,如表1 所示,其中AtOCT1、AtOCT2、AtOCT3、AtOCT5 和AtOCT6位于1 号染色体,AtOCT4 位于3 号染色体;编码的蛋白长度介于515~539 个氨基酸.
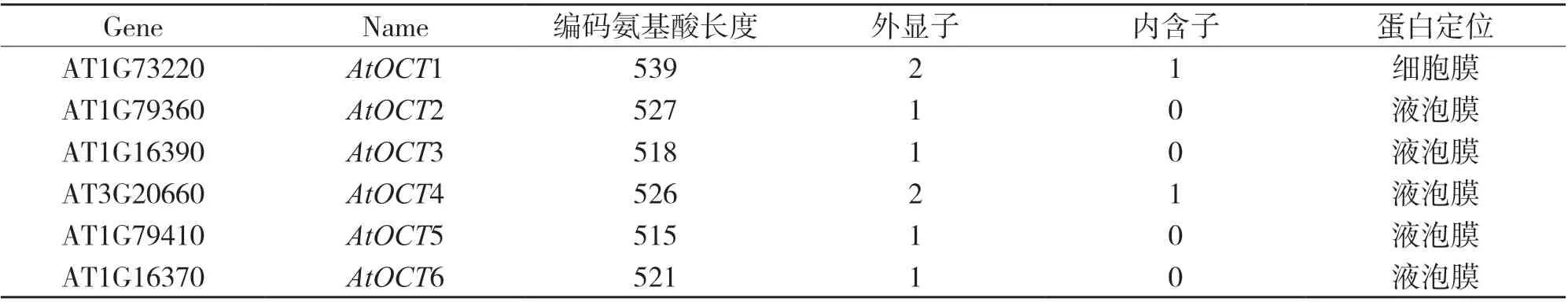
表1 拟南芥OCT 基因家族基本信息
对拟南芥AtOCT2~6 蛋白质序列进行分析,预测到其具有11~13 个跨膜结构域,且这5 个蛋白的结构非常相似. AtOCT1 结构与其家族的其他成员有所不同[13]. AtOCT1 蛋白有539 个氨基酸,携带一些N-糖基化位点和蛋白激酶C 磷酸化位点,且拥有一个非胞质N 端和一个显著的细胞内中央亲水环[11].AtOCT1蛋白具有SLC22 家族的大多数特征,如TM1 和TM2 之间有一个大环,以及TM2 之前的保守结构域STIVTEWD/NLVC 和TM10 之后的ELYPT;AtOCT1 的TM2 之后的G(X)3G(X)4G(X)3DR/KFGRR/K, TM4 之后的E(X)6R,TM6 之后的PESPRWL,TM8 之后的D/NR/HLGRR,TM10 之后的E(X)6R,以及TM12 之后的PETGK 发挥作用[14-15].
1.2 OCT 家族的分类
对6 个拟南芥OCTs 和普通菜豆OCT1 氨基酸序列进行进化分析,发现6 个AtOCT 可以分为4 类,并且AtOCT1 和PvOCT1 聚在一起具有很强的同源性[11]. AtOCT2、AtOCT3 和AtOCT5、AtOCT6 分别聚在一起,AtOCT4 独自成一类.这些结果说明,AtOCT2、AtOCT3、AtOCT5 和AtOCT6 具有相似的功能.
1.3 OCT 亚细胞定位、组织器官的特异性
OCT 蛋白属于膜蛋白.对AtOCT1 进行原生质体瞬时表达实验证实了AtOCT1 定位于质膜上;此外,亚细胞定位结果显示其他5 个成员(AtOCT2~6)都定位于液泡膜[13].
通过半定量RT-PCR 发现,拟南芥AtOCT1 在所有器官中表达,在生殖器官中含量最高,如花芽、花或未成熟的荚果[11]. PvOCT1 主要在根维管系统表达[10].有研究发现菜豆PvOCT1 基因在根和茎中表达,在叶柄和茎中也检测到非常低的转录水平[10].
RNA 印迹分析显示,拟南芥中5 个液泡OCT基因在不同的器官中有自己独有的表达方式,AtOCT2一般情况下是弱表达;AtOCT3 的mRNA 仅在长荚果中存在;AtOCT4 的mRNA 在根中表达最强,而在其他器官仅有非常微弱的表达;AtOCT5 在库叶和源叶表达最强[16].AtOCT6 和AtOCT4 一样,主要在根中高表达、茎中表达较弱[13].
AtOCT1 启动子在生殖器官中表现出相对较强的活性,尤其是在花药、萼片、花瓣和花梗活性强;在幼苗阶段,启动子仅限于维管系统,在叶和根中活性高,在根的伸长区和根毛区表达活性最高;此外,20%的植物在根冠表现出GUS 活性;发育后期,在叶和茎中的活性下降,但在根中保持较高的活性;根横切面证实AtOCT1 启动子活性仅限于维管组织[11].在菜豆中,通过原位杂交实验检测PvOCT1 的组织特异性表达,与茎切片的原位RNA 杂交证实PvOCT1 特异性地定位于韧皮部细胞[10].AtOCT2 启动子在花粉粒和柱头活性高;在成熟荚果的维管组织和幼嫩荚果的种皮中均有表达;对整个拟南芥进行染色,发现AtOCT2 启动子活性与叶龄相关,AtOCT2 启动子在除维管系统外的幼叶上表皮、下层细胞、幼叶维管系统的薄壁细胞中,在成熟叶片的韧皮部,在根的维管束、侧根的起始点和根尖中均具有活性[5].和AtOCT2 启动子不同,AtOCT3 启动子主要在荚果中表达,特别是发育较早的种子,而不是在荚果皮或较老的种子中;在茎的皮层以下的皮质细胞和实质细胞、在叶的下表皮和上表皮,表皮毛基部、次生花序的基部均有表达.AtOCT4启动子在幼嫩荚果和荚果的维管组织中都有表达,不同的是,AtOCT4 启动子在次生花序韧皮部细胞和木质部薄壁组织细胞中也有表达;与AtOCT4 相似的是,AtOCT6 启动子在次生花序的韧皮部表达,另外AtOCT6 启动子在花的雄蕊、花丝和药隔中均有表达;在莲座叶中,表达仅限于成熟叶的主脉[13].AtOCT5启动子活性表达部位还不是很清楚.
2 植物OCT 基因对胁迫的响应
2.1 对水分胁迫的响应
植物OCT1 响应干旱胁迫. Torres 等人的实验结果表明,脱水1 h 后观察到的PvOCT1 在根中转录水平增加,发生在从头合成ABA 之前,这说明PvOCT1 对早期干旱的响应不依赖于ABA 信号转导,而相反,脱水2、5 和8 h 后PvOCT1 的mRNA 丰度减少可能与ABA 合成有关[10].推测PvOCT1 可能转运溶质或信号分子参与对缺水的早期反应,它的反应调控机制和脯氨酸转运蛋白对寒冷或脱水胁迫响应类似[10,17].AtOCT1 在干旱胁迫下不会被诱导反而会减低积累量,而AtOCT2 和AtOCT3 则完全不响应[13],AtOCT4~6的转录本在干旱处理20 min 后开始积累,持续8 h,在2~4 h 左右累积量最高.
2.2 对冷胁迫响应
植物OCTs响应冷胁迫.植物对低温信号的响应,目前没有明确的结论,普遍认为是由于低温会增加膜的黏性,改变膜的流动性所致.将拟南芥幼苗转移到4 ℃进行冷处理,RNA 定量分析表明,AtOCT3和AtOCT5 的转录水平在诱导后20 min 开始升高,在2 h 以上短暂升高,4 h 后下降.AtOCT1、AtOCT2、AtOCT4 和AtOCT6 对冷胁迫没有反应[13].这些结果说明,AtOCT3 和AtOCT5 在转录水平响应冷害,但其具体生理功能有待深入研究.
2.3 对盐胁迫的响应
植物OCTs响应盐胁迫.AtOCT1 在盐胁迫下不会被诱导反而会被抑制,AtOCT2 和AtOCT3 对盐胁迫没有响应;AtOCT4~6 对盐胁迫有响应,其中AtOCT4 在盐胁迫24 h 后达到最高水平,AtOCT5 和AtOCT6的表达量在6 h 后达到最高水平[13].目前缺乏拟南芥OCT 蛋白水平对盐胁迫响应的证据,这值得开展研究.盐胁迫下会引起植物产生渗透胁迫、离子毒害、膜透性改变和生理代谢紊乱等一系列的问题,而植物本身可通过自身的渗透调节进而使自身损害降到最低.AtOCTs是否能通过避盐机制或耐盐机制调节植物对盐害的响应还不清楚.
2.4 对养分胁迫的响应
利用已公开的转录组和基因芯片分析数据(https://www.ncbi.nlm.nih.gov/gene),对AtOCTs养分胁迫的响应进行了分析,发现AtOCT1 在根和叶均受低磷强烈诱导,分别上调5.95 倍和4.48 倍,而AtOCT5 只在根部受低磷诱导,AtOCT1 受蔗糖下调(表2).有趣的是,AtOCTs在低氮和低硫胁迫下都无响应.这些结果说明,AtOCT1 和AtOCT5 基因可能在调节植物适应低磷养分胁迫方面发挥作用.磷在植物生长发育中必不可少,广泛参与植物体内物质合成和能量代谢过程,也是提高作物产量和品质的主要肥料成分之一[18].植物根系可直接吸收利用土壤中无机态可溶性磷酸盐,而土壤中大量存在的磷酸酯、磷酸酐等有机磷无法被植物直接吸收.很显然,多胺如何调节植物响应低磷胁迫,以及AtOCT1 和AtOCT5 在调节根细胞多胺平衡和磷吸收转运方面所起的作用值得深入研究.

表2 拟南芥OCT 基因家族对非生物逆境的响应
3 植物OCTs 的生理功能
3.1 参与植物体内肉碱和尸胺的转运
Lelandais-Briére 等人间接证明AtOCT1 介导肉碱的转运[5,11,16,19]. Strohm 等人发现AtOCT1 的失活可能影响植物细胞中的肉碱循环[20]. T-DNA 插入的AtOCT1 突变体对尸胺(Cad)敏感性增加,而过表达AtOCT1 的拟南芥对Cad 具有抗性,说明AtOCT1 可能是一个Cad 输出载体[11]. Sagor 等人提出一个模型,在含有较高精胺(Spm)的植物中,Spm 会抑制AtOCT1 肉碱转运蛋白的活性,从而导致Cad 的积累量更高;若Spm 水平下降,则AtLAT1 和AtOCT1 的肉碱转运蛋白活性将会发生逆转,从而导致Cad 进入减少和Cad 外排增加,从而导致Cad 净积累量降低.
可在根、幼叶和生殖器官的维管组织中检测到AtOCT1 启动子的活性,证明了AtOCT1 在长距离运输中起作用.此外,AtOCT1 在叶脉、花梗、叶颈和侧根基部的高水平表达,表明它也可能参与了韧皮部/木质部的物质交换[11].值得注意的是,氨基酸类化合物的双向交换已有报道[21-22].
3.2 OCT 调节植物生长发育
AtOCT1 调节侧根的发育.AtOCT1 可能通过直接或间接参与负调控侧根发育的化合物的转运而影响侧根的发育.AtOCT1 在侧根的维管组织中高表达,并且AtOCT1 功能的丧失导致拟南芥幼苗的侧根显著增加[11]. Strohm 等人对不同品种的拟南芥进行Cad 处理,发现当Cad 浓度增加时抑制主根生长、侧根分枝和根部波动的改变[20].有趣的是,对7 日龄幼苗的半定量RT-PCR 结果显示,AtOCT3、AtOCT4 和AtOCT6与AtOCT1 存在交叉调控,至少有4 个基因(另外3 个AtOCTs基因和bou)在突变体中的表达受到了 影响[11].
OCT可能调节花的发育.和其他OCT基因相比,AtOCT2、AtOCT4 基因在花粉优先表达,并且发现AtOCT4 属于花粉特异性转运蛋白.在花粉发育过程中,AtOCT2 基因在晚期花粉中表达,只是在三细胞期达到峰值,而在成熟花粉中急剧下降[23].AtOCT4 基因表达在配子发生过程中首先出现在三细胞或成熟花粉中[24].这些结果暗示,AtOCT2 和AtOCT4 可能参与调节花的发育.
OCT参与激素互作. AtOCT3 蛋白作为新定位的液泡膜蛋白,其功能尚不清楚,它也可能是叶绿体蛋白,但是需要进一步的实验来确定其亚细胞定位[24-25].另外,有研究证实AtOCT3 可能还是二糖转运蛋白[26].有趣的是,全基因组关联分析(genome-wide association studies,GWAS)发现AtOCT3 影响抗性激素ABA 和JA(jasmonic acid,JA)的对话(crosstalk)和对甘蓝夜蛾(Mamestra brassicae)的抗性,T-DNA 插入的AtOCT3 突变体对ABA 的敏感性下降,JA 响应基因VSP2 在AtOCT3 突变体的表达水平明显比野生型Col-8 的低,用AtOCT3 的叶子饲喂的甘蓝夜蛾比用Col-8 饲喂的体重大,这些结果说明AtOCT3 通过参与ABA-JA 互作而调节植物的抗虫性,但具体的生理机制不清楚;和AtOCT3 不同,虽然GWAS 分析揭示AtOCT6 可能是参与ABA-JA 互作的基因,但AtOCT6 的T-DNA 插入突变体和Col-8 的表型没有区别[27].
OCT可能参与植物解毒. 2-苯并噁唑酮(Benzoxazolin-2(3H)-one,BOA)是一种有机污染物,BOA可显著诱导AtOCT5 基因表达[28].但目前缺乏AtOCT5 突变体和过表达材料对BOA 抗性的实验结果.拟南芥是否是通过上调AtOCT5 而促进有机阳离子向液泡转运,进而降低BOA 的毒性还有待深入研究.综上所述,植物OCT 在生长发育和响应逆境胁迫方面起重要的调控作用.
4 展望
目前来看,对植物OCT基因家族的研究还不够深入,还有一些科学问题有待回答.AtOCT1~6 在转录水平分别由哪些转录调控因子进行调控还不清楚.此外,在蛋白水平OCT 是如何进行调控的,是否受磷酸化、泛素化等修饰也需要进行深入研究.在表观遗传学的层面,OCT基因是否受DNA 甲基化和组蛋白层面的修饰调控也值得开展研究.特别是基因编辑技术的运用,创造多重OCT突变体,来解析OCT的功能是今后研究的方向.目前对植物OCT基因功能的研究还集中在模式植物拟南芥,而对于有机阳离子转运体农作物如水稻、玉米、小麦和大豆等作物的OCT基因功能还不清楚.显然对这些作物OCT基因开展深入研究将有助于全面理解植物OCT基因的功能.
(注:文中OCT 表示蛋白为正体,表示基因为斜体)
