猪蓝耳病及其综合防控措施
2021-11-22谭涛
谭 涛
(礼蓝(上海)动物保健有限公司,上海 200003)
1 临床症状
母猪群感染猪蓝耳病后会出现流产、产弱仔、木乃伊胎、流产率可达10%~50%(图1);母猪还可以出现早产、分娩延迟、发情不正常、易返情等情况。公猪感染后精液品质下降、性欲减弱;流产胎儿脐带可能出现坏死性脉管炎;公、母猪都会出现厌食的现象。仔猪和生长育肥猪主要以呼吸道症状为主,表现体温升高、呼吸困难等肺炎症状;有的母猪、保育猪会出现躯体末端皮肤发绀或者耳部皮肤发紫即“蓝耳”现象(图2,图3),有时候猪只会出现眼结膜炎等临床症状(图4,图5)。部分猪后驱无力、不能站立或共济失调;仔猪、保育猪呼吸困难,发热或腹泻(图6,图7),急性暴发时发病率很高,猪蓝耳病阴性场暴发该病时,发病率可接近100%,死亡率50%以上;育肥猪急性感染时发病率可达60%,死亡率约10~30%。

图1 猪蓝耳病感染妊娠后期的母猪导致流产
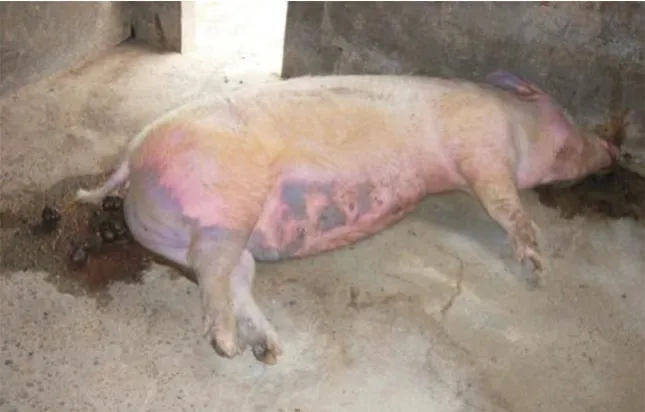
图2 猪蓝耳病急性感染造成的母猪死亡

图3 病猪耳部发紫即所谓的“蓝耳”现象
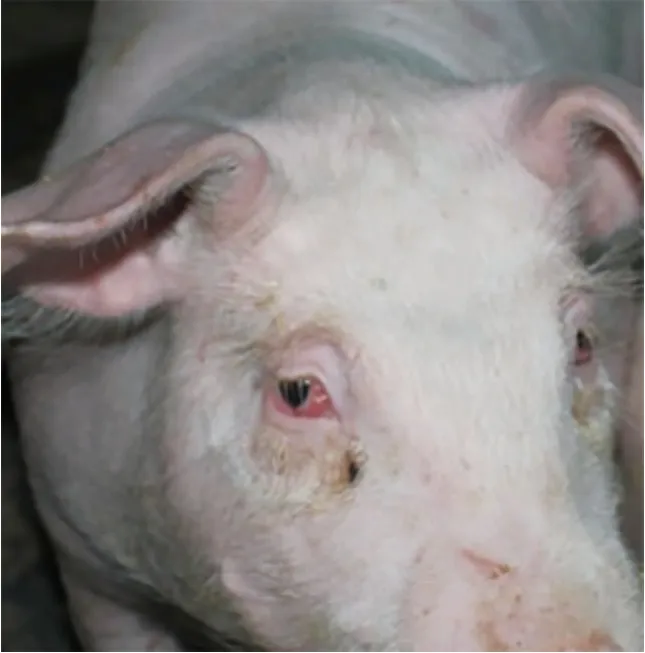
图4 猪蓝耳病感染后,有时可以造成猪眼结膜发红

图5 病猪有时会出现眼结膜炎

图6 产房仔猪感染猪蓝耳病后会造成发烧、呼吸困难和高死亡率
2 病理变化
猪蓝耳病感染后不同日龄的猪只表现出相似的病理变化,但感染毒株的毒力不同,其造成的病变程度和病变范围也有所区别[4-5]。病理变化主要集中在呼吸系统和淋巴系统上。
哺乳仔猪:肺脏红褐色斑驳状,水肿,指压不塌陷,表现间质性肺炎;全身各处淋巴结发生水肿、周围黄染或褐色肿大;可见腹腔、胸腔和心包腔内清亮积液。
保育猪:肺脏发生间质性肺炎,触摸有弹性但不易塌陷,北美型猪蓝耳病病毒在攻毒试验中会造成感染猪只肺部深红色实变(图8);全身淋巴结水肿,严重的呈红褐色。

图8 北美型猪蓝耳病病毒株感染猪只10 d后的肺部病变,肺脏表面出现深红色实变
生长育肥猪:肺脏多呈现暗红或红褐色。心脏出现轻度至中度的多灶性淋巴组织脉管炎和血管周心肌炎[5-8]。偶尔可见轻度的心肌纤维坏死[8]。有时在小脑、大脑和/或脑干中出现轻度的淋巴组织脑白质炎或脑炎[5,8-10]。
种猪:流产母猪会引起轻度到中度的子宫内膜炎和子宫肌炎;公猪精液品质下降,如精子畸形率上升、精子活力下降、精液稀薄等。
微观病理变化主要为间质性肺炎,肺组织血管阻塞、淤血、水肿,单核细胞浸润导致肺泡明显隔膜增厚,血管周围会出现单核细胞浸润现象(图9)[11]。
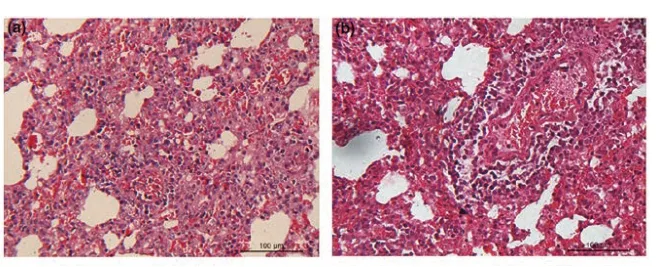
图9 猪蓝耳病病毒感染仔猪肺部微观病变
3 病原学与免疫学
猪蓝耳病病毒属于套式病毒目,动脉炎病毒科,动脉炎病毒属。病毒粒子呈球形,有囊膜,直径在40~60 nm之间,表面有约5 nm大小的突起。核衣壳呈二十面体对称,直径为25~30 nm(图10)。分为2种基因型,即Ⅰ型(欧洲型)和Ⅱ型(北美型),两型间的序列同源性不到60%。2个基因型的代表毒株分别为LV株和VR-2332株[12]。
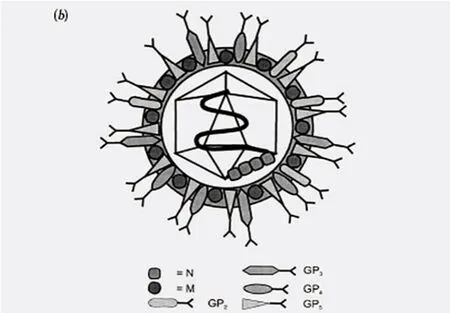
图10 猪蓝耳病病毒粒子模型
猪蓝耳病病毒的基因组是一条长约15 kb的单股正链RNA,基因组约四分之三编码非结构蛋白(NSP),四分之一编码结构蛋白(图11)。作为RNA病毒,猪蓝耳病病毒基因变异快速。该病毒的非结构蛋白基因变异相对较大,NSP的功能主要是蛋白酶、复制酶和聚合酶活性,不产生中和抗体。猪蓝耳病病毒的结构蛋白基因变异相对较小,该病毒共编码7个结构蛋白,功能各不相同(表1)。GP5和非糖基化的M蛋白是病毒表面主要囊膜蛋白,GP5是病毒粒子中功能最丰富的糖蛋白,参与病毒感染与免疫,最新研究表明囊膜蛋白GP2-GP5刺激产生中和抗体。PRRSV的核衣壳蛋白(N蛋白)是病毒最主要的结构蛋白之一,具有很多抗原表位,产生抗体最早,病毒感染7~10 d就能检测到高滴度的N蛋白抗体水平,所以常作为诊断和血清学调查的理想对象[13]。

表1 蓝耳病病毒基因编码蛋白及功能

图11 蓝耳病病毒基因组结构模式图
2006年以来中国不断分离到北美株高致病性猪蓝耳病病毒(HP-PRRSV),又被称作变异株,判定HP-PRRSV毒株的依据是:相比经典北美株病毒,变异株非结构蛋白(NSP)中的NSP2基因编码的482及533-561位氨基酸共缺失30个氨基酸,即90个核苷酸[1]。中国变异株猪蓝耳病病毒代表株有JXA1、HuN4-F112、以及TJM-F92(图12)等。2014年开始,国内出现了类NADC30毒株,该毒株和美国的NADC30毒株高度同源[3,14-15]。近几年不断有报道疫苗株与野毒重组的发生,毒株的多样性也增加了猪蓝耳病防控的难度。

图12 蓝耳病病毒基因组:江西毒株JXA1和天津毒株TJM-F92的基因差异
猪蓝耳病病毒不耐高温,56 ℃下45 min即失活。低温保存时,猪蓝耳病病毒具有较好的稳定性[12]。同时,PRRSV在微酸性条件下更易复制,在pH低于5和高于7的条件下,感染力下降90%以上。
猪蓝耳病病毒首先感染猪肺部,然后进入淋巴系统,进一步分布到全身各组织和器官,并产生相应的病理变化。无论猪蓝耳病病毒通过哪种途径侵入,有效感染主要发生在肺部的肺泡巨噬细胞中。感染猪蓝耳病病毒的猪病毒血症持续时间长,还可能长期的排毒(图13)。实验感染条件下在30 d内可以检测到病毒血症,攻毒后14~120 d检测到中和抗体,14~120 d可以检测到IFN-γ介导的细胞免疫反应[18]。病毒主要在扁桃体、肺和淋巴组织中持续性复制。出生后感染的猪体内,猪蓝耳病病毒能持续性存在长达150 d;而先天感染的猪体内甚至能存在长达210 d之久[12]。
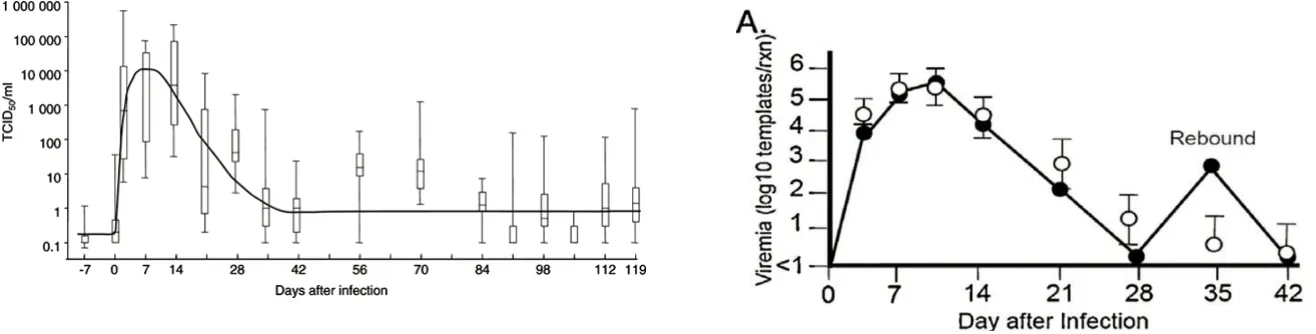
图13 猪蓝耳病的特征之一是其能够长时间在感染猪群内长期存在,形成持续性感染,有时会间歇性排毒[16- 17]
当猪只体内的猪蓝耳病抗体处于低水平时,病毒与抗体在巨噬细胞上结合后会使病毒更容易进入巨噬细胞,促进猪蓝耳病病毒在巨噬细胞中的复制,这种作用被称为抗体依赖性复制增强效应(ADE)[19]。因此低浓度的抗体会增加病毒粒子与巨噬细胞结合机会,可能会加重疾病的发生。
猪蓝耳病的另外一个重要的危害是猪蓝耳病感染的猪群会出现免疫抑制的现象。猪蓝耳病病毒可以调节巨噬细胞和树突状细胞(DCs)的细胞因子产量,调控抗原递呈相关分子的表达,从而抑制天然免疫和特异性免疫反应,引起免疫抑制[20-22]。免疫抑制的产生还与猪蓝耳病病毒的感染有关。猪蓝耳病病毒感染猪群后,主要在肺泡巨嗜细胞、淋巴细胞和单核细胞内复制,在复制的过程中,病毒会诱导感染细胞和周边未感染细胞的死亡和凋亡,导致肺泡巨噬细胞、单核细胞、淋巴细胞等免疫细胞数量的大量减少,而肺泡巨噬细胞等具有吞噬、杀死外来病原,将病原进行抗原处理、递呈给免疫系统的功能,一旦这类细胞在猪蓝耳病病毒的感染过程
中死亡,那么必然导致机体的整体免疫能力大大下降,从而出现免疫抑制[23]。在感染期间,由于免疫抑制的存在,动物对其他病原的免疫反应能力下降,抗体产生迟缓、低下,对细菌的入侵清除能力下降,继发细菌感染的机会大大增强。因此,由于免疫抑制的存在,猪蓝耳病感染的猪场,猪瘟、猪伪狂犬病等常见疾病的抗体水平不高,整齐度低,且常伴随非常严重的副猪嗜血杆菌、胸膜肺炎放线杆菌、链球菌、巴氏杆菌的感染。
4 猪蓝耳病的传播
猪蓝耳病的主要传播途径为水平传播、垂直传播。除了猪只之间的直接传播之外,还有物品或蚊虫引起的间接传播,包括:设备、工作服、靴子、垫料、水、饲料、活载体(苍蝇、蚊子等带毒者)、悬浮微粒等;携带猪蓝耳病病毒的空气尘埃造成的传播距离可达9.1 km[24]。
猪蓝耳病病毒在猪场猪群中的流行传播与猪场的饲养模式有关,尤其是单点式饲养模式,该病毒可以通过公猪的精液传给母猪,也能通过母猪的胎盘屏障传给胎儿;在哺乳、 保育、生长及育肥屠宰猪群各阶段猪蓝耳病病毒都可以通过转群、注射针头、排泄物及苍蝇、蚊子等昆虫媒介而流行传播;种猪群引入后备种猪也是猪蓝耳病流行传播的常见途径;许多猪场管理不善,不能严格执行全进全出,导致猪蓝耳病病毒感染的生长育肥猪群成为内部循环感染的重要传染源,通过水平传播或间接传播等方式,发生逆向或正向感染,导致仔猪群、母猪群和/或大的生长育肥猪群感染甚至发病(图14)。
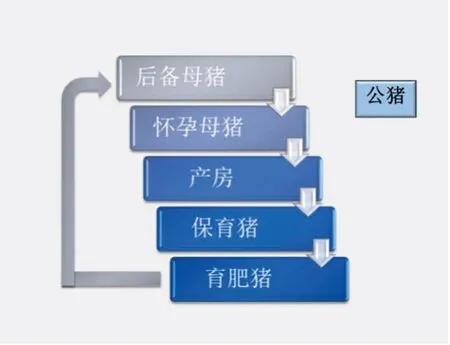
图14 猪蓝耳病病毒在猪场的传播和循环
5 诊断与检测
科学的诊断需要结合临床症状、流行病学、剖检变化以及实验室检测(血清抗体检测以及病原检测等)。但是,目前国内的组织病理学方面的实验室诊断使用的不多。
血液样品和组织样品采集:前者主要用于猪蓝耳病血清学抗体检测,而后者主要用于猪蓝耳病病原检测;猪蓝耳病病原检测普遍采用RT-PCR,该方法灵敏度高,可对组织、唾液及疾病急性发作期血清进行检测。
RT-PCR检测可区分经典猪蓝耳病病毒和突变株猪蓝耳病病毒,但不能区分疫苗毒株与野毒毒株,如果要区分的话需要进行基因测序。ELISA检测也不能区分野毒感染还是疫苗免疫产生的抗体,因此,实验室的检测结果要与猪群的免疫情况以及临床发病情况结合起来,进行综合诊断。
目前口腔唾液检测已经得到了相当广泛的使用。具体的方法为:将棉绳悬挂于发病猪群或可疑猪群栏舍之上(长度以猪群可以咀嚼到为佳),任猪只含咬,待猪群咀嚼20 min后,将棉绳上的唾液挤入一个封口袋,再将收集的唾液转入15 mL离心管保存送往实验室进行检测。检测之前,将唾液样本 10 000 r/min离心15 min,之后0.22 µm滤膜过滤,再作进一步的抗原或者抗体检测。
血清学ELISA检测PRRS-S/P值评判参考标准(IDEXX®试剂盒)见表2。需要引起注意的是,在猪场实际进行猪蓝耳病抗体的监测时,以上的判定方法不一定与猪场实际感染状况符合,所以S/P值判定猪场猪蓝耳病感染状态的方法仅仅作为参考,而不能作为确切的诊断方法。

表2 血清学ELISA检测猪蓝耳病抗体S/P值的参考标准(IDEXX®试剂盒)
6 防控
猪蓝耳病的控制方法需要做好三方面的工作:良好的饲养管理和生物安全;选择安全性好的疫苗并制定科学的免疫程序;合理的药物保健程序。
6.1 建立良好的饲养管理与生物安全
1)严格控制猪群的流动,避免不同批次和不同猪群的接触,尽量做到全进全出;
2)引种:尽量避免一次性引入大量后备母猪;尽量避免一次性从多个来源同时引进后备母猪(或后备公猪),引种后需要进行隔离、驯化;
3)保持猪舍良好的温度、湿度与合理的饲养密度;防止饲料的霉变或者营养不足;
4)对猪蓝耳病的阳性猪场进行封群,使其自然的转阴,但此方法不适合单点饲养模式;
5)对猪蓝耳病发病严重的猪场进行清群并重新建群;
6)条件允许时尽量采用分胎次饲养、多点式饲养;
7)有条件的情况下,可以考虑安装空气过滤设备,尤其是公猪站。
6.2 疫苗免疫
猪蓝耳病疫苗使用的原则是安全和有效:疫苗注射后注意不能造成猪群的不良反应比如流产等;免疫疫苗以后也能抵抗猪蓝耳病的感染,起到预防猪蓝耳病的作用。需要引起注意的是,猪蓝耳病疫苗接种后产生的免疫是部分保护(partial protection)而非完全保护(complete protection);猪蓝耳病疫苗接种后不能阻止野毒的感染,但可以降低感染野毒后造成的临床症状和损失。有专家指出,疫苗的不规范使用和免疫程序不科学也是猪场猪蓝耳病难以控制的原因之一。
国内猪蓝耳病疫苗生产厂家有30多家。疫苗包括灭活疫苗和弱毒疫苗。弱毒疫苗包括以CH-1R、R98、VR2332为代表的经典毒株疫苗,以 及 以JXA1-R、HuN4-F112、TJM-F92、GDr180株为代表的高致病性毒株疫苗。关于猪蓝耳病病毒不同毒株之间的交叉保护效果以及灭活疫苗的保护效果,专家们还存在争议。
一个猪场猪蓝耳病疫苗的免疫,最好先做全群抗体检测分析(按规范的采血方案),将猪场猪群猪蓝耳病的感染状况进行分类,分阴性场,稳定不活跃场、稳定控制场、稳定活跃场及不稳定场(表3),再进一步决定是否进行猪蓝耳病疫苗免疫。同时,猪场要了解仔猪猪蓝耳病病毒抗体转阳的时间,从而确定仔猪最佳免疫时机。

表3 根据猪场猪群猪蓝耳病病毒的排毒和感染状况,将猪场的蓝耳病状况划分为4个等级
6.3 做好药物保健,控制继发感染
猪蓝耳病感染以后猪只免疫系统受损,机体免疫力下降,很容易发生各种细菌性的继发感染,导致发病率和死亡率更高。控制好细菌的继发感染可以控制由于继发细菌性感染而造成的死亡,减少经济损失。有些药物如替米考星可以在巨噬细胞内富集,杀菌的效果更明显[25]。同时细胞内环境的改善还能有助于巨噬细胞抵抗病毒性感染[26]。这种抗病毒的作用是间接的,与猪蓝耳病对巨噬细胞的吸附和侵入后的脱衣壳作用密切相关。
猪蓝耳病病毒感染猪体后首先在局部组织的巨噬细胞内复制,然后迅速向淋巴组织、肺扩散,最终到达肺泡巨噬细胞表面,通过与肺泡巨噬细胞膜表面上的受体结合,诱导细胞吞噬病毒而进入细胞。猪蓝耳病病毒进入巨噬细胞后,将同细胞内的溶酶体融合,溶酶体内含有丰富的各种蛋白酶,这些酶必须在酸性的环境下才能发生酶促水解反应,猪蓝耳病病毒在溶酶体内通过这些酶的作用脱去病毒表面的核衣壳[27-29]。Nauwynck等研究发现,猪蓝耳病的吸附并进入巨噬细胞的过程需要偏酸性的环境,并且进入细胞后的病毒复制进程仍然依赖于低pH的环境,如果没有足够的H+进入,溶酶体内的pH就会升高,猪蓝耳病病毒的脱壳将减缓甚至失败[27,30]。
7 替米考星在控制猪蓝耳病感染中的应用
替米考星是一类大环内酯类抗生素,该抗生素被口服后可迅速被吸收,具有良好的组织穿透力,能快速聚集于肺脏,并主要聚集在肺脏,而在血液中的浓度极低。研究资料表明,替米考星连续400 mg/kg 饲喂10 d,在肺部组织的含量是在血液中的11倍(2.59/0.23)。替米考星进入肺部组织后,会集中于巨噬细胞、单核细胞、淋巴细胞,尤其肺泡巨噬细胞,而且从亚细胞器的分布来看,替米考星主要分布于肺泡巨噬细胞内的溶酶体内,其细胞内外的浓度差可以高达75倍(图15),而猪蓝耳病感染动物机体后,病毒的复制过程中最重要的脱壳过程就在此处完成,替米考星的这种嗜巨噬细胞溶酶体的特性,是它间接抑制猪蓝耳病复制的基础[25]。替米考星有2个碱性基团,其pKa值分别为7.4和8.5,这种碱性基团以在巨噬细胞内(尤其是溶酶体内)的高含量,可以改变巨噬细胞的内环境,降低猪蓝耳病病毒的复制速度[31]。

图15 替米考星在细胞内外的浓度
2001年,美国明尼苏达州立大学的Thomas Molitor报道,如果将猪蓝耳病病毒直接暴露于替米考星溶液中,让替米考星先作用于猪蓝耳病病毒,再将处理完毕的猪蓝耳病病毒感染肺泡巨噬细胞,此时的替米考星并不能杀死或者抑制猪蓝耳病病毒的复制,对猪蓝耳病病毒的活性也没有任何影响;但是如果反过来,先将肺泡巨噬细胞用替米考星处理后,再感染猪蓝耳病病毒,发现猪蓝耳病病毒在肺泡巨噬细胞内的复制量大大降低,明显存在抑制作用,但存在剂量依赖性[26]。在替米考星的浓度达到0.1~1 μg/mL时,猪蓝耳病病毒的复制量比没有使用替米考星处理的对照组下降约30%~40%、如果替米考星的量达到10 μg/mL时,猪蓝耳病病毒复制几乎停止。美国伊利诺斯州立大学Yijun Du等人研究也发现,替米考星无论对欧洲型还是北美型猪蓝耳病病毒,在猪肺泡巨噬细胞中均有抑制猪蓝耳病病毒复制的作用[32]。泰国学者Korakrit Poonsuk和越南Chung Hoang也发现,替米考星对流行于亚太地区的高致病性猪蓝耳病病毒,也同样存在抑制其复制作用[33]。
David Benf ield对猪蓝耳病阴性保育猪进行提前1周饲喂替米考星,连续饲喂28 d,在第7天时进行强毒攻毒试验,结果发现使用替米考星组在日增重、采食量方面均比未使用替米考星组高,而料重比比未使用替米考星组低;通过分析血清和肺组织中的病毒发现,使用替米考星后血清中的猪蓝耳病病毒的阳性率从75.9%下降到58.6%,肺组织中猪蓝耳病病毒阳性率则从48.3%下降到34.5%。
替米考星对猪蓝耳病阳性猪群的效果除了控制继发感染与减缓病毒的复制之外,还与它降低炎症反应的效果有关。细胞因子可以造成炎症反应,而替米考星可以调节细胞因子的表达,从而抑制和减轻炎症反应。同时,替米考星可以增强吞噬细胞的效率,使之更有效地对凋亡细胞进行吞噬,这样就减少细胞凋亡和破裂导致的炎性因子释放,进一步降低炎症反应[34-37]。替米考星还具有免疫调节和抗炎作用,能够抑制“细胞因子风暴”,并能通过免疫调节作用减轻感染后的临床症状。此外,替米考星本身作为一种抗生素,可以有效控制猪蓝耳病发生后的细菌性的继发感染,这种混合感染往往造成严重的肺炎。在实际临床应用时,使用替米考星配合其他药物,可以显著降低猪蓝耳病阳性场保育猪的死淘率。
2006年的第19届世界猪病大会上,Misener报道了一个加拿大猪场的案例。一家1 690头母猪的猪场,含有分娩场和保育场,虽然该场进行过猪蓝耳病疫苗的常规免疫,但仍然发生了猪蓝耳病。该猪场后来采取了含有猪蓝耳病野毒的血清对猪群进行接种,并且对比了试验组(血清接种结合添加替米考星)与对照组(只有血清接种)的结果(表4),结果显示,未加替米考星的对照组的死亡率为15.8%,而添加了替米考星的试验组死亡率仅为1.1%;对照组流产率为42.3%,而添加了替米考星的试验组流产率仅为5.2%(图16)。

图16 添加替米考星的对照试验结果(1)

表4 加拿大某猪场暴发猪蓝耳病后,在使用活病毒血清接种的方法时,进行对比试验
Karen Lehe报道,一家位于美国印第安纳州的1 700头母猪的猪场,在怀孕舍突然发生个别母猪的流产后,母猪怀孕率大幅度下降,之后保育舍出现明显的猪蓝耳病临床症状。母猪流产后,检测到其猪蓝耳病抗体S/P值显著上升,除猪蓝耳病外,该场同时存在多杀性巴氏杆菌、链球菌7型、波氏杆菌、胸膜肺炎放线杆菌的混合感染。在A农场,第1、2批猪只没有添加替米考星,设定为未处理组,共770头;第3~5批进入保育舍即添加了替米考星,共1 110头。在每吨饲料中添加替米考星1.5 kg,饲喂10~14 d;同时在撒在地板上的饲料中加替米考星1 kg/t,饲喂3周。结果A场的保育死亡率从未处理组(第1、2批)的27%下降到了处理组(第3、4、5批)的6%(图17)。
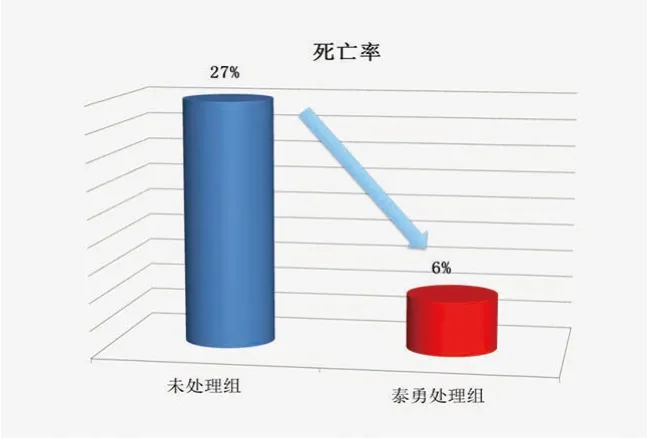
图17 添加替米考星的对照试验结果(2)
在C农场,前4批未进行替米考星的添加,共1 678头保育猪,死亡率为18%,后3批(共1 688头保育猪)设为处理组,在饲料中添加替米考星(泰勇)1.5 kg/t饲料,连续饲喂3周,结果死亡率显著下降,仅为4%(图18),同时保育猪采食量也由之前的从0.722磅(327.7 g)/d升高到0.928磅( 421.2 g)/d。

图18 添加替米考星的对照试验结果(3)
8 总结
猪蓝耳病是除了非洲猪瘟以外影响我国养猪业最重要疾病,猪蓝耳病病毒作为一种RNA病毒,变异迅速、毒株多并且新的毒株不断出现,不同毒株之间可以发生重组。该病的传播途径多种多样,除了直接接触传播以外,还可以通过各种物资、昆虫、人员甚至空气进行传播。猪只在感染后,抗猪蓝耳病病毒的中和抗体出现时间很晚,无法很好地抵挡猪蓝耳病病毒的感染。猪蓝耳病病毒存在持续性感染,一旦感染很难清除,而且会长时间的排毒并引起免疫抑制,导致细菌性继发感染的高发,这更加剧了
疾病的复杂程度与防控难度。猪蓝耳病的诊断需要结合临床症状、剖检变化和实验室检测,最好能同时进行组织病理学的诊断。猪蓝耳病疫苗免疫起到部分保护,但是无法做到完全保护,不同毒株的交叉保护力效果存在争议,有些疫苗的安全性还未完全达标,甚至可能出现毒力返强问题[38]。猪蓝耳病的防控需要良好的生物安全、精细化的管理、科学的疫苗免疫以及合理的药物保健程序。替米考星作为新一代的动物专用抗生素,无论是从理论上还是实践中,对于猪场猪蓝耳病及其继发感染具有较好的效果,它可以减缓猪蓝耳病病毒的复制速度、控制继发细菌性感染、降低炎症反应,可以作为猪蓝耳病阳性猪场的控制措施之一,帮助猪场减少损失,维持生产稳定。
