基于“证据推理和模型认知”的教学实践
2021-11-20顾海东
顾海东

摘要:化学核心素养的培养需要在课堂教学中落实,以盐类的水解(第一课时)为例,借助于希沃授课助手、化学实验操作、pH传感器创设教学情境,培养学生“证据推理和模型认知”的核心素养能力。
关键词:核心素养;模型认知;教学设计与实施
文章编号:1008-0546(2021)04-0061-03 中图分类号:G63241 文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.04.016
一、提出问题
《普通高中化学课程标准(2017年版)》提出学科核心素养是学科育人价值的集中体现,是学生通过学科学习而逐步形成的正确价值观念、必备品格和关键能力[1]。在提出的5个方面的核心素养中“证据推理与模型认知”素养作为化学学科核心素养的思维核心,包括五大培育目标:学会假设、学会认证、学会分析、学会预测与建模、学会问题解决[2]。选修教材《化学反应原理》因为理论性比较强,所以更加需要学生养成分析问题和解决问题的能力。在实际的教学中如能帮助学生先搭建起一个基本模型,然后让学生收集证据再去修正模型,最后以模型认知去解决问题将会大大减轻学生的学习负担,并极大地提高学习效率。本文以盐类水解第一课时的教学为例,探讨提升学生“证据推理与模型认知”素养的教学设计。
二、基于“证据推理与模型认知”的教学设计与实施
1.教材分析
盐类的水解是人教版选修,((化学反应原理》第三章第三节的教学内容,是对电解质的电离、水的电离平衡、水的离子积以及平衡移动等知识的综合应用。教材主要包括了三个部分:一是找规律,从学生比较熟悉的盐类物质入手,引导学生通过实验并归纳分析盐类的组成与盐溶液酸碱性的关系;二是查原因,以水的电离平衡为基础,分析盐类电离出的阴、阳离子与水电离出的H+和OH-结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因;三是谈变化,讨论影响盐类水解的主要因素,同时介绍盐类水解的利用。作为第一课时的教学,主要要让学生明确什么是盐类的水解?怎么形成的?有什么判断规律?
2.学情分析
学生通过前面两节的学习已经初步建立起了从“微粒”的角度来认识和分析溶液情况的基本能力,也具备了一定的观察、实验、思考和自学能力,在此基础上探究盐类在水溶液中的酸碱性规律,有助于提高学生对知识的综合应用能力。教学内容理论性较强,学生能否主动参与获取知识对教学效果达成与否影响很大。
3.教学目标
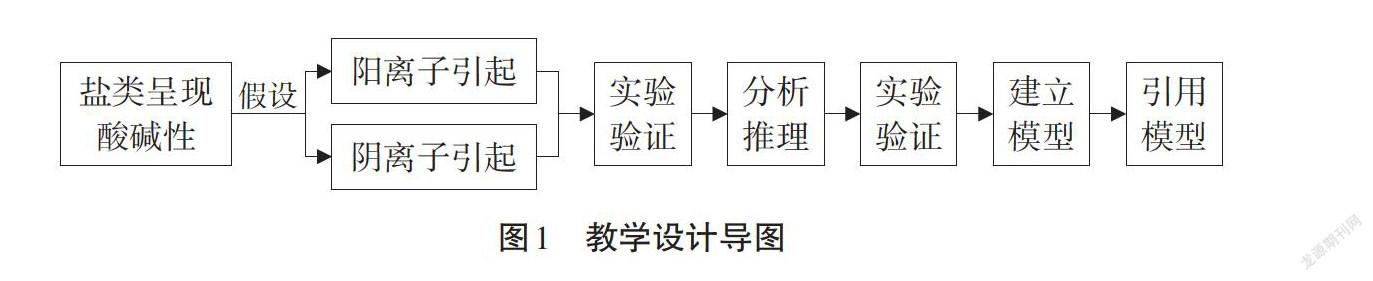
本节内容中,学生必须明确引起盐类水解的根本原因?怎样影响?影响的结果是什么?所以为方便学生推理和建模,按图1进行教学设计。再根据设计确定如下教学目标:
(1)运用实验和离子平衡分析认识盐类水解的本质,学会从宏观与微观结合的视角分析化学问题。
(2)初步学会用离子反应表示盐类水解的过程,知道盐类水解的微观特征。
(3)能够运用盐类水解的规律判断盐溶液的酸碱性,建构相应的知识模型。
4.教学流程
(1)体验盐类的水解
【师生互动】请两位同学上台,一位同学手持附有白纸的板,另一位同学手持喷壶,并将喷壶的溶液喷向白纸,实验现象是白纸上显示出一个红色的枣字。(为确保每个同学都能清晰的观察到实验现象,对实验过程采用希沃授课助手进行直播)
设计意图:因为上课地点在山西临县,而临县是“中国红枣之乡”,以当地的乡土之情和酚酞遇到碳酸的化学“小魔术”来充分调动学生的学习积极性,并以此激发学生探究的热情。
【教师活动】揭秘魔术,并提出碳酸钠呈碱性,那其他的盐类呢?
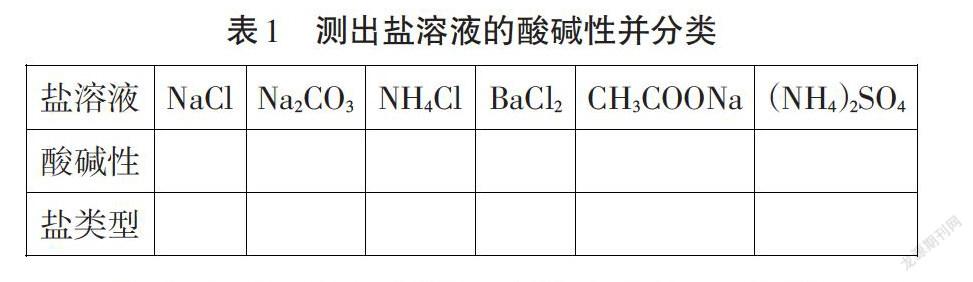
【活动1】用pH试纸测出表1中盐溶液的酸碱性,根据形成该盐的酸和碱的强弱,将表1中盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类。
设计意图:通过实验培养学生实验探究能力,同时让学生获取盐溶液酸碱性的感性材料,再次形成认知冲突。通过对盐类型的分类,为盐类水解实质性离子作好铺垫。
【教师活动】将学生活动成果通过希沃平台展示,提出从刚才的实验中可以发现盐溶液并不都是中性的。追问那小魔术中碳酸钠溶液的碱性是谁引起的呢?是它电离出的钠离子吗?(学生回答:不是)为什么?你有佐证材料吗?(学生回答:实验显示氯化钠是中性的,应该不是钠离子引起的)那如果是碳酸根离子引起的,我们该如何通过实验来验证呢?
【学生活动】思考,小组交流,最后得出假设:如果处理掉溶液中的碳酸根离子,那么溶液应该呈现中性。
【教师活动】那根据我们现有的实验试剂,你能解决这个问题吗?
【学生活动】学生观察所提供的试剂,最后锁定氯化钡溶液。
(2)探究盐类的水解
【活动2】设计并动手完成一个简单的实验,来证明碳酸钠溶液的碱性是由CO32-引起的。
【學生活动】取少量碳酸钠溶液,滴入1~2滴酚酞,逐渐加入氯化钡晶体振荡,溶液红色褪去,并出现白色沉淀。
【教师活动】为进一步说明碳酸钠溶液的碱性是由碳酸根离子引起的,引入pH传感器实验。将pH传感器插入到碳酸钠溶液中(为增强视觉性,在碳酸钠溶液中滴入1~2滴酚酞),用电磁搅拌器搅拌溶液,再逐渐加入氯化钡固体,请学生观察pH的数字变化(图2、图3)。
设计意图:通过引入传感器实验,让学生从更为直观的角度认识到碳酸钠溶液的碱性与碳酸根离子的关系。
【问题思考】碳酸根离子引起了溶液呈碱性,它的根本机理是什么?
【活动3】结合Na2CO3和H2O电离出的微粒,试着分析碳酸钠溶液呈碱性的原因。
(已知:常温下H2CO3的Ka1=4.3×10-7,Ka2=5.61×10-11)
【学生活动】讨论上述问题,汇报结果。碳酸钠溶于水后电离产生的碳酸根离子结合了水电离出的H+,形成弱电解质HCO3-,由于水电离出的H+浓度减小,打破了水的电离平衡,促进了水的电离,使溶液中的c(OH-)大于c(H+),从而使溶液显碱性。
【教师活动】Na2CO3=2Na++CO32-
H2OOH-+H+
【问题思考】能否用化学方程式表明碳酸钠固体加入水后发生的反应?
【展示学生成果】Na2CO3+H2O=NaHCO3+NaOH
【教师活动】在两个烧杯中加入同浓度的碳酸钠溶液,分别连接好传感器,在一个烧杯中加入碳酸钠固体,另一个烧杯中加入碳酸氢钠固体,学生直观的看到了不同的数值变化。(加入碳酸钠固体的数值增大,加入碳酸氢钠的数值变小,如图4、图5所示。)
【师生互动】通过演示实验的数据变化并結合学生前面学过的原理,得出这是一个可逆反应的结论。
【学生活动】把该反应方程式改写成离子方程式。
【教师活动】展示学生的改写成果,可以发现这个反应中真正参加反应的是碳酸根离子,这也验证了前面对碳酸钠溶液显示碱性是由碳酸根离子引起的论证。
设计意图:从电离出离子的角度,让学生认识到盐类水解的实质,并以此建立起盐类水解的理论模型。通过引入传感器实验,让学生从更为直观的角度认识到碳酸钠溶液的碱性与碳酸根离子的关系,帮助学生建立模型。
【活动4】结合NH4Cl和H2O电离出的微粒,试着分析氯化铵溶液呈酸性的原因。
【师生互动】展示学生分析的成果。学生代表描述小组讨论结果,氯化铵溶于水电离出的铵根离子结合了水电离出的氢氧根离子,形成弱电解质一水合氨,打破了水的电离平衡,促进了水的电离,使溶液中c(H+)大于c(OH-),从而使溶液显酸性。
设计意图:通过对碳酸钠溶液呈碱性的分析而建立起思维模型,培养学生引用模型分析问题的能力。
(3)归纳盐类的水解
【教师活动】通过对碳酸钠溶液、氯化按溶液的分析,我们认识到盐溶液之所以显酸碱性,主要是当这类盐溶于水后,电离出的阳离子、阴离子分别结合了水电离出的OH-和H+结合生成弱电解质,从而促进了水的电离平衡,像这样的反应,叫做盐类的水解。
【过渡】现在我们已经从实质上认识了某些盆呈酸碱性的根本原因,下面请同学们把桌上的盐溶液按酸性、中性、碱性的顺序重新整理一下。再从盐类型的角度观察分别显示酸性、中性、碱性的盐分别有什么特点。
【学生活动】小组整理、观察后回答组成为强酸弱碱的盐显酸性、强酸强碱的盐显中性、强碱弱酸的盐显碱性。
【追问】盐类因为水解而显示酸碱性,那能否找出什么样的盐才能发生水解?溶液显示出性质又有什么规律?
【学生活动】再次观察分类情况,得出“有弱才水解、谁强显谁性”。
【师生互动】下面我们再进行一个头脑风暴,你能否列举出一些可以发生水解的盐,并指出它们溶液的酸碱性呢?学生思考交流、代表回答、互为补充。
设计意图:以点带面,让学生通过头脑风暴,从盐的组成上应用模型认识盐类水解的规律,并巩固弱酸、弱碱。
(4)总结与提升
【师生活动】①归纳一下盐类水解的相关知识点。(展示归纳角度:定义、实质、规律)
②习题巩固,检验课堂教学效果。
5.教学反思
本节课从趣味魔术引入,以学生实验操作和对盐的简单分类为起点,帮助学生形成一个判断盐性质的初步框架。再以探究碳酸钠溶液呈碱性的原因为切入点,培养学生先分析假设,再证明假设的“证据推理”核心素养能力。以探讨碳酸根离子引起溶液呈碱性的机理,使学生从“微粒”层面认识盐类水解的本质。通过小组活动对氯化铵溶液的成果展示,为学生搭建起盐酸水解分析的模型,再以“头脑风暴”的形式,帮助学生应用模型,最终达成“模型认知”的核心素养能力。整个教学过程中通过数字传感器和多通道对比实验的引入,把微观的实验变化,以数字化的形式呈现给学生,使得学生能更直观地理解微观的机理。希沃投屏的展示使学生更能从小组合作学习中获得成长,从而最终达成良好的教学效果,培养学生“证据推理和模型认知”的核心素养能力。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:3
[2]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015:347
