抗核抗体谱对急性主动脉综合征的影响
2021-11-20杨静云邢震宇张静波
史 坚 杨静云 邢震宇 张静波
保定市第一中心医院心脏血管外科,河北 保定 071000
急性主动脉综合征(acute aortic syndrome,AAS)包括急性主动脉夹层(acute aortic dissection,AAD)、壁内血肿(intramural haematoma,IMH)和穿透性动脉粥样硬化性主动脉溃疡(penetrating atherosclerotic aortic ulcer,PAU)。AAS是一系列威胁生命的主动脉疾病,其具有共同的病理生理表现(主动脉内膜和中层的破裂)、临床特征和诊断难点[1-3]。创伤、高血压、吸烟、高脂血症及妊娠等是已知AAS的危险因素[2]。研究显示,炎性因子及动脉粥样硬化参与了AAS的形成[4-5]。抗核抗体谱(antinuclear antibodies,ANAs)作为初始自身免疫指标,与机体炎性反应及动脉粥样硬化均存在相关性[6-7],但ANAs与AAS是否存在相关性目前鲜少进行研究。因此,本研究探讨AAS的相关危险因素及ANAs对AAS的影响,现报道如下。
1 对象与方法
1.1 研究对象
纳入2019年12月至2020年12月保定市第一中心医院收治的经主动脉增强计算机断层扫描(computed tomography,CT)确诊为AAS胸痛患者77例为AAS组。纳入标准[1]:AAD影像学可见内膜破口,内膜片及真假腔形成;IMH影像学可见主动脉壁新月形成或环形增厚≥5 mm,但无内膜破裂形成的双腔主动脉征象;PAU影像学可见对比剂充盈的龛影,其周围可伴有不同程度的壁间血肿,范围可局限或弥漫。排除标准:(1)年龄<18岁;(2)孕妇;(3)急性心肌梗死;(4)自身免疫性疾病;(5)应用免疫抑制药物治疗;(6)甲状腺疾病;(7)慢性感染;(8)创伤;(9)已知恶性肿瘤患者。同期选取非AAS胸痛患者76例为对照组,非AAS患者中肋间神经痛患者27例,心脏神经症22例,反流性食管炎18例,病因不明9例。本研究获医院伦理委员会批准,所有患者知情同意并签署知情同意书,同意将其信息存储在医院数据库中并用于研究。
1.2 观察指标
1.2.1 资料收集
记录患者的临床特征,包括性别、年龄、吸烟史、基础疾病等;记录入院实验室指标[白细胞计数(white blood cell,WBC)、红细胞计数(red blood cell,RBC)、血红蛋白(hemoglobin,Hb)、肌酸激酶(creatine kinase,CK)、谷草转氨酶(glutamic oxaloacetic transaminase,AST)、谷丙转氨酶(glutamic-pyruvic transaminase,ALT)、C反应蛋白(C-reactive protein,CRP)、D-二聚体(D-dimer,D-D)和高敏肌钙蛋白Ⅰ(high-sensitivity troponinⅠ,Hs-TnⅠ)、血肌酐(serum creatinine,SCr)、血糖(blood glucose,Glu)]。
1.2.2 ANAs检测试剂与方法
入院后清晨空腹抽取患者静脉血5 ml,放入乙二胺四乙酸试管中,在4 ℃下冷藏4 h或更短时间,离心4000 r/min,离心5 min,提取血浆并储存在-70 ℃冰箱中,通过间接免疫荧光法检测,滴度>1∶100作为ANAs阳性。
1.3 统计学方法
应用SPSS 26.0统计软件对数据进行分析,符合正态分布的资料以(±s)表示,组间比较采用两独立样本t检验;非正态性分布资料以M(P25,P75)表示,组间比较采用秩和检验;计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法。AAS发生的影响因素采用Logistic回归分析;P<0.05为差异有统计学意义。
2 结果
2.1 临床特征比较
两组患者年龄、高脂血症、糖尿病、体温、心率和呼吸比较,差异无统计学意义(P>0.05);AAS组患者男性、高血压发生率、动脉粥样硬化发生率、吸烟率、收缩压、舒张压和平均动脉压均高于对照组患者,差异有统计学意义(P<0.05)。(表1)

表1 两组患者基线特征比较
2.2 实验室指标比较
两组患者的RBC、Hb、CK水平和AST/ALT比较,差异无统计学意义(P>0.05);AAS组患者WBC、CRP、D-D、Hs-TnI、SCr、Glu水平高于对照组患者;ANAs阳性率高于对照组患者,差异有统计学意义(P<0.05)。(表2)
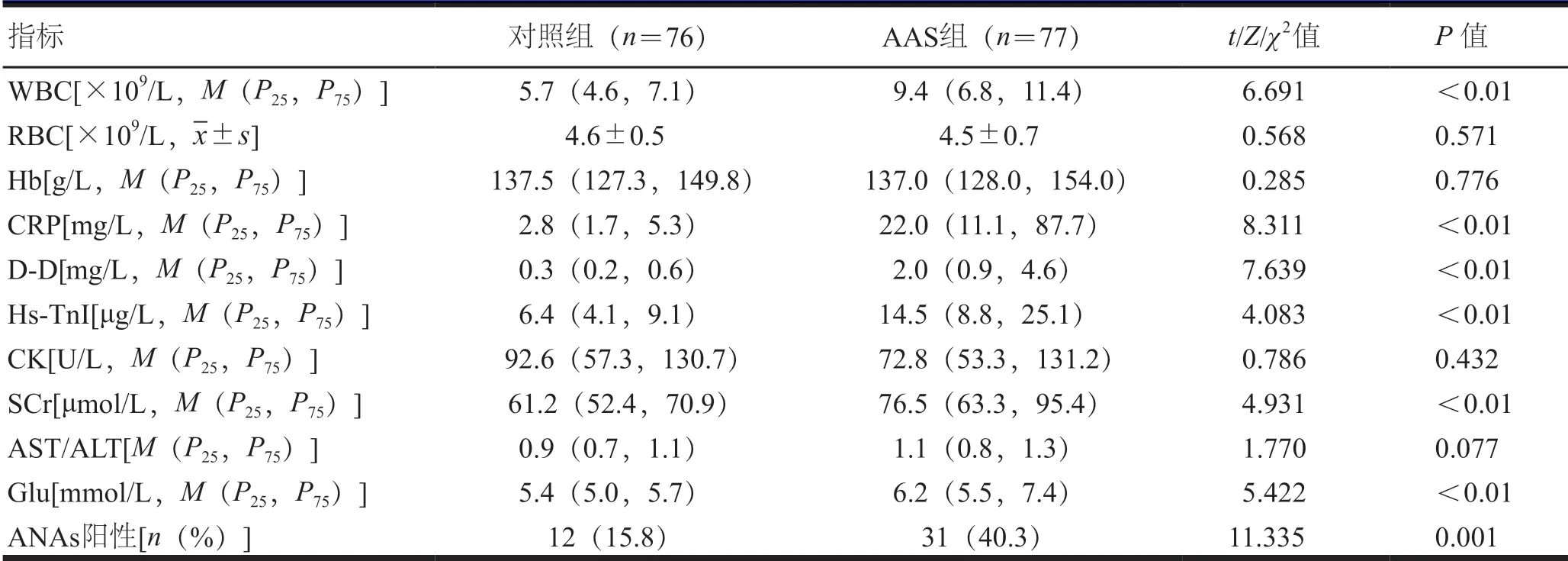
表2 两组患者实验室指标比较
2.3 AAS发生的影响因素分析
将男性、合并高血压、合并动脉粥样硬化、合并吸烟、收缩压升高、舒张压升高、平均动脉压升高、WBC升高、CRP水平升高、D-D水平升高、Hs-TnⅠ水平升高、SCr水平升高、Glu水平升高及ANAs阳性作为自变量,将发生AAS作为因变量,进行多因素回归分析显示,合并高血压、合并动脉粥样硬化、WBC升高、ANAs阳性是AAS的独立危险因素(P<0.05)。(表3)
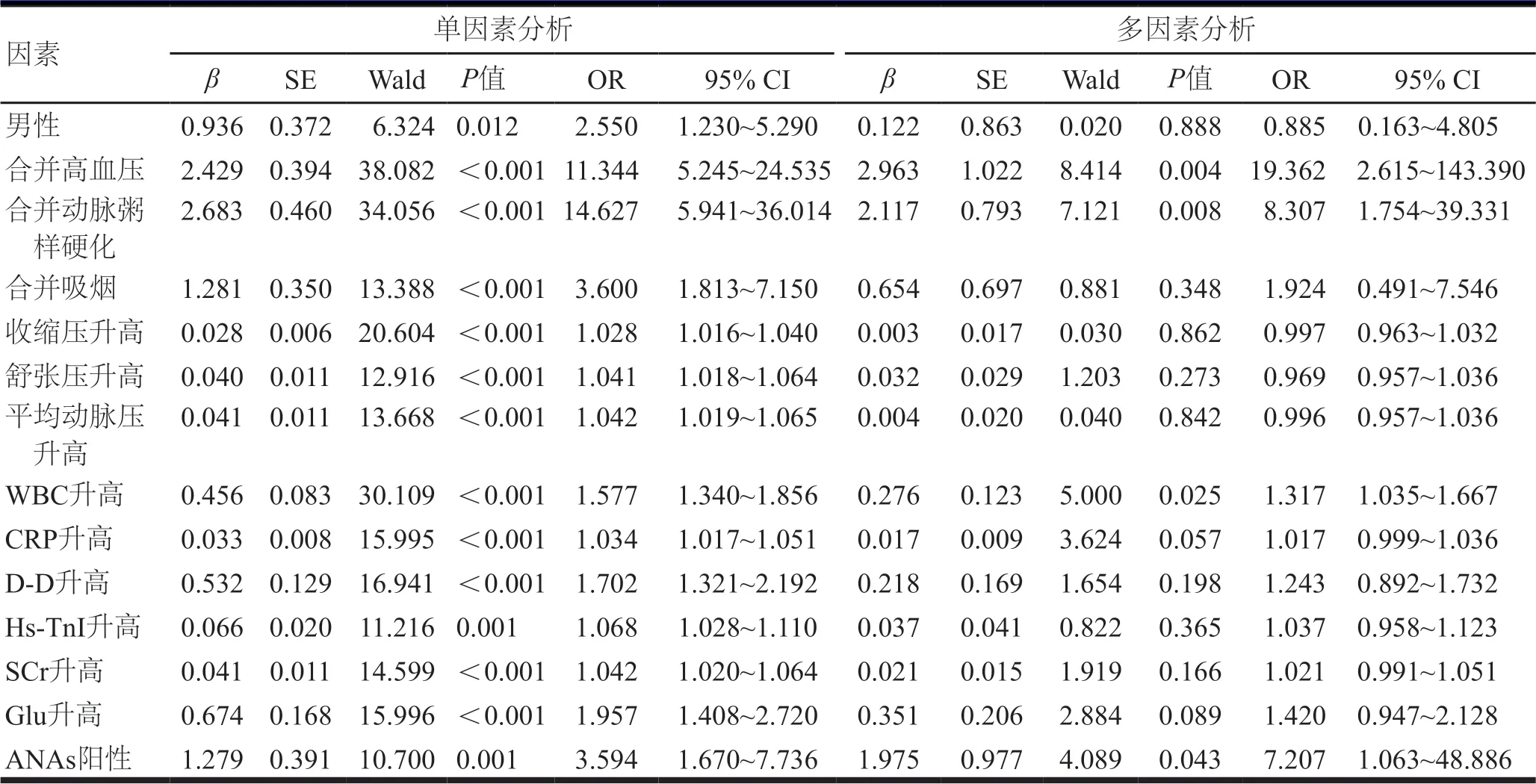
表3 AAS发生的影响因素分析
3 讨论
AAS是一组急性发作并有相似临床表现的主动脉疾病,其病死率在世界范围内达50%[8]。随着诊治技术的不断发展,同时诊断时间的提高,有效降低预后不良事件的发生风险,AAS患者的病死率也逐步降低[9]。目前,由于超声医师技术限制和三级以下医院增强CT的普及率及分辨率较低,AAS的诊断时间仍相对较长,导致偏远地区AAS患者病死率仍居高不下。简单的监测和早期有效的干预是降低病死率的根本措施。既往研究表明,AAS生物标志物主要包括肌钙蛋白T、中性粒细胞/淋巴细胞比值、炎性因子(CRP、白细胞介素6、肿瘤坏死因子α)、血清基质金属蛋白酶9和基质金属蛋白酶12等[10],但均需进一步研究。
本研究结果显示,AAS组患者男性、高血压发生率、动脉粥样硬化发生率、吸烟率、收缩压、舒张压和平均动脉压均高于对照组患者,WBC、CRP、D-D、Hs-TnI、SCr、Glu水平高于对照组患者;ANAs阳性率高于对照组患者,差异有统计学意义。其中,合并高血压、合并动脉粥样硬化、入院时WBC升高和ANAs阳性是发生AAS的独立危险因素。合并高血压及动脉粥样硬化病是血管损伤和破裂的基础[5,11]。WBC升高提示了AAS患者可能存在炎性反应,从而可能引起免疫功能的激活[4]。而研究表明ANAs与免疫宿主的活性相关[12]。炎性反应是已知的主动脉综合征的危险因素,参与了AAS的发生发展。本研究中,WBC可作为发生AAS的独立危险因素参与AAS的发生发展。AAS发生过程中血管内膜出现损失,导致炎性细胞因子的释放,从而进一步引起炎性风暴和组织损伤[13]。研究显示,有1/3的AAS患者存在血管壁炎性反应可进展为血管疾病的高危因素[4]。炎性细胞因子和继发免疫应答在AAS中发挥重要作用。其中,炎性细胞能增加蛋白酶和细胞黏附分子的表达,导致主动脉平滑肌细胞凋亡,从而最终导致动脉壁中层的降解[14]。这一过程是主动脉综合征形成的主要机制之一。有病理证据表明AAS患者主动脉中有存在炎性细胞[15]。
ANAs作为“良性自身免疫”,被证实与普通人群的全因死亡率相关[16]。研究表明,ANAs在冠状动脉疾病和外周动脉疾病中均阳性[6,17-19]。本研究中,AAS患者ANAs阳性率达40.3%,高于对照组患者,差异有统计学意义,考虑ANAs可能参与主动脉内膜的损伤过程。Pertovaara等[6]研究发现,在ANAs阳性患者中,其血管的顺应性及弹性下降,动脉壁发生了早期的结构变化。动脉粥样硬化可导致主动脉内膜完整性发生改变,而ANAs的大量释放可能是由于动脉粥样硬化急性改变所致[19]。此外,研究显示,ANAs与血管内皮相关因子可溶性血管细胞黏附因子及可溶性细胞间黏附因子等密切相关[7],ANAs可能与血管内皮相关因子共同参与了血管壁完整性的改变[20]。最后,主动脉壁撕裂过程中,可能导致炎性反应调节的障碍,从而进一步增加主动脉壁的损伤,从而刺激循环中ANAs的释放。
本研究中,对照组患者ANAs阳性率为15.8%,较既往研究中保定市正常人群ANAs阳性率(14.01%)偏高[21],可能与本研究中对照组为胸痛人群,存在胸痛患者可能存在非主动脉综合征的其他疾病。本研究存在一定的局限性,首先,ANAs是病因还是症状及ANAs在预后方面的作用尚需进一步研究;其次,本研究为单中心回顾性研究,且样本例数较小,故结果可能存在偏倚,尚需更大规模的临床研究支持。目前,AAS的发生与免疫因子方面的研究较少,研究为免疫反应可能参与了AAS的发生提供了一定的理论基础。
