兔颈动脉修复联合牛心包补片成形术后再狭窄的效果研究
2021-11-20冯远平王良华肖骏琦刘凤恩
曾 澄 冯远平 王良华 肖骏琦 段 青 刘凤恩
1 赣南医学院心脑血管疾病防治教育部重点实验室,江西 赣州 341000 2 赣南医学院第一附属医院血管外科,江西 赣州 341000
脑卒中位列中国居民疾病死亡原因的首位,缺血性脑卒中的主要病因是颈动脉粥样硬化闭塞,斑块在颈动脉中积聚,继而出现狭窄,随着时间推移,导致大脑的血液供应障碍,随之导致脑卒中[1-3]。颈动脉狭窄通常是颈总动脉分叉处的动脉粥样硬化闭塞,即颅外颈动脉狭窄,这是临床脑卒中事件的主要原因[4]。颈动脉闭塞性疾病的外科治疗采用颈动脉内膜剥脱术(carotid endarterectomy,CEA),治疗主要通过修复颈动脉恢复动脉血流,但颈动脉修复术后出现内膜增生、再狭窄,影响预后。研究显示,与补片血管成形术相比,CEA一期缝合再狭窄率更高[5]。CEA联合补片成形术是目前降低脑卒中风险的主要技术,补片材料可以由自体静脉、牛心包或合成材料制成,合成材料包括聚四氟乙烯、涤纶、聚氨酯等。牛心包补片既往多用于先天性心脏病手术患者,其安全性、有效性通过多年随访得到验证。牛心包补片可以较好地黏附于缝合部位,有助于止血,使其成为颈动脉和其他血管手术良好选择[6]。研究表明,牛心包补片血管成形术可以减少长期同侧脑卒中事件的发生,减少颈动脉术后远期再狭窄或闭塞的风险[7],但证据级别较低,且较少研究将补片成形术与CEA一期缝合中的新生内膜增生进行比较,需要更多的数据来证明[8-9]。本研究通过构建新西兰兔颈动脉切开缝合术后再狭窄模型,运用血细胞分析、苏木精-伊红染色法(hematoxylin-eosin staining,HE)、免疫组化、透射电镜等技术,检测颈动脉修复术后炎性水平和血管内膜增生情况,为颈动脉修复联合牛心包补片成形术在临床中应用提供更多证据,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用15只雄性新西兰兔[SCXK(湘)2020-0005],体重2.0~2.5 kg,平均(2.37±0.14)kg,10周龄。
1.1.2 主要实验药物
戊巴比妥钠(30 mg/kg,Sigma)、9-0缝合线(宁波医用缝合针有限公司)、牛心包补片(4190807-5;北京佰仁医疗科技)、青霉素(80 U/KG,华北制药股份有限公司)、HE染色(AR1180-1,博士德生物)、免疫组化[3,3二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒(CW0125,CWBIO)]、Tunel凋亡检测试剂盒(C1088,碧云天)、基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)(AF0577 affinity)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)(10375-2-AP Proteintech)、蛋白激酶Cα(protein kinase C α,PKCα)(bs-3531R,BIOSS)、二抗[辣根酶标记山羊抗兔免疫球蛋白G(H+L),中杉金桥,ZB-2301]、Cy3(C1089,碧云天)。
1.1.3 主要仪器设备
颈动脉超声系统(加拿大VisualSonics公司,vevo2100)、透射电镜分析仪[JEM-1230(80KV),JEOL]、血液细胞分析仪(深圳市锦瑞生物科技股份有限公司,型号KT-6610)。
1.2 动物模型构建方法
按照兔颈动脉修复方法不同将兔子分为三组,每组5只。使用2%戊巴比妥钠按照30 mg/kg耳缘静脉注射进行麻醉,将新西兰兔固定、备皮、碘伏消毒。三组新西兰兔均沿颈部正中纵向切口分离左侧颈内静脉,近心端和远心端结扎(结扎点间隔2 cm),静脉补片组从两结扎处中间取下1.5 cm颈内静脉。
对照组行切开后一期缝合,从左侧颈动脉纵行切开 1 cm,使用9-0缝合线进行一期缝合;静脉补片组于自体静脉补片与缝合切口处进行连续缝合,从左侧颈动脉纵行切开1 cm,取同侧颈内静脉修剪为长10 mm、宽2 mm的自体静脉补片,使用9-0缝合线将静脉补片与切口处进行连续缝合;牛心包补片组行将牛心包补片与切口处进行连续缝合,牛心包补片组从左侧颈动脉纵行切开10 mm,取牛心包补片(将其修剪成为长10 mm、宽2 mm的生物补片,使用9-0缝合线将牛心包补片与切口处进行缝合。所有新西兰兔术后予以青霉素80 U/kg肌内注射,连续注射3 d进行抗炎治疗。造模成功标准为血管缝合后血流通畅、无渗血即造模成功。
1.3 观察指标
分别于术后2周、4周、12周采血进行凝血四项、血细胞分析和颈动脉超声检查。12周后耳缘静脉注射2%戊巴比妥钠(150 mg/kg)处死新西兰兔,检查心脏完全停止跳动确定动物死亡,取手术部位颈动脉进行HE染色、Tunel凋亡检测、透射电镜和免疫组化分析。
术后2周、4周、12周取三各组血液充分抗凝后,于室温条件下,采用动物血液细胞分析仪于4 h内完成上机检测,检测凝血四项[纤维蛋白原(fibrinogen,Fib),活化部分凝血活酶时间(activated partial thromboplastin time,APTT),凝血酶时间(thrombin time,TT),凝血酶原时间(prothrombin time,PT)]。检测血细胞[红细胞计数(red blood cells,RBC)、白细胞计数(white blood cells,WBC)、嗜酸性粒细胞计数(eosinophils,Eos)、淋巴细胞计数(lymphocyte,Lym)]。分别于术后2周、4周、12周行各组颈动脉超声检测,保存图片,记录结果。
HE染色,颈动脉组织流水冲洗,行分级酒精溶液(70%、80%、90%)逐级梯度脱水后放置乙醇与二甲苯等量混合液15 min,然后放置15 min二甲苯Ⅰ溶液、15 min二甲苯Ⅱ溶液(至透明为止)。置于二甲苯和石蜡各50%的混合液15 min,行石蜡包埋后切片。石蜡切片进行烤片,脱蜡、水化后,切片置于苏木精水溶液中染色3 min,盐酸乙醇分化液分化15 s后水洗,返蓝液返蓝15 s后,流水冲洗,伊红染色3 min,流水冲洗、脱水、透明、封片、镜检。
Tunel凋亡检测,三组组织切片置于65 ℃烤箱中烤2 h,然后将切片在二甲苯中放置10 min,更换二甲苯再放置10 min,而后切片依次放入100%乙醇、95%乙醇、80%乙醇和纯化水中各5 min。经烤片、脱蜡、水化后,将切片移入湿盒中,37 ℃下逐个样本滴加 50 μg/ml 蛋白酶K工作液,30 min后行热修复。磷酸盐缓冲盐溶液充分洗涤3次,每次5 min,将蛋白酶K洗净。吸水纸吸掉组织周围的磷酸盐缓冲盐溶液,每张玻片滴加足量Tunel检测液,45 ℃湿盒内避光孵育2 h。磷酸盐缓冲盐溶液充分洗涤3次,每次5 min。吸水纸吸干玻片残余液体,抗荧光淬灭封片后在荧光显微镜下观察。
透射电镜,三组组织样品用2.5%戊二醛固定2 h以上,0.1 mol/L磷酸盐缓冲盐溶液漂洗,1%锇酸固定液固定2 h后,0.1 mol/L磷酸盐缓冲盐溶液中漂洗,经各浓度酒精(50%、70%、80%、90%)逐级梯度脱水,再丙酮脱水后包埋固化标本,切片机于厚度为70 nm处切成薄片。聚合后3% 醋酸铀-枸橼酸铅双染,随机选择内皮细胞结构相对完整切片于透射电镜下观察。
免疫组化,将石蜡组织切片放入65 ℃烤箱中烤2 h,在二甲苯中放置10 min,依次放入100%乙醇、95%乙醇、80%乙醇和纯化水中各5 min,经烤片、脱蜡、水化后,放入修复盒中,加入抗原修复液,煮沸,冷却后磷酸盐缓冲盐溶液冲洗。将切片移入湿盒中,加入3%双氧水,以除去内源性过氧化物酶封闭液,室温25 ℃孵育10 min,磷酸盐缓冲盐溶液充分漂洗。滴加足量、已稀释的一抗MMP2、MMP9、PKCα于湿盒中孵育4 ℃过夜。室温静置45 min,磷酸盐缓冲盐溶液浸洗玻片3次,每次5 min,漂洗后滴加二抗,37 ℃孵育30 min。磷酸盐缓冲盐溶液充分漂洗,3,3二氨基联苯胺(diaminobenzidine,DAB)显色5~10 min后,苏木精染料复染3 min,1%盐酸乙醇溶液透明后封片后镜检,观察MMP2、MMP9和PKCα表达量。
1.4 统计学方法
应用SPSS 20.0软件进行统计分析,计数资料以n(%)表示;计量资料以(±s)表示,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 造模结果
造模新西兰兔17只,1只分离颈动脉时用力过大导致动脉破裂死亡,1只术后切口感染化脓致死,造模成功率88.2%(15/17),造模结果见图1。术后12周处死新西兰兔,取术区颈动脉组织,对照组可见缝合处狭窄,静脉补片组可见静脉补片变形、回缩、假性动脉瘤形成。牛心包补片组补片内面光滑,无变形、穿孔、血栓形成、瘤样扩张等,见图2。

图2 术后12周处死新西兰兔的颈动脉组织
2.2 超声检查
术后不同时间点,对照组可见内膜呈不规则增厚并纤维化,管腔狭窄,12周后增生最为严重;静脉补片组见假性动脉瘤形成;牛心包补片组缝合处均未见明显管腔狭窄、瘤样扩张、血栓形成等。补片周围均未见积液或脓肿。(图3)
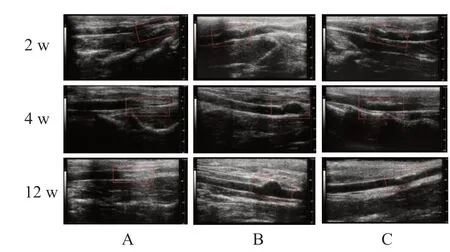
图3 三组动物颈动脉修复术后不同时间点超声结果
2.3 凝血指标、血细胞比较
术后不同时间点三组凝血指标及血细胞比较,差异无统计学意义(P>0.05)。(表1)
表1 术后不同时间点三组凝血指标及血细胞情况 (±s)

表1 术后不同时间点三组凝血指标及血细胞情况 (±s)
指标 时间 对照组(n=5)静脉补片组(n=5)牛心包补片组(n=5)Fib(g/L) 术后2周 2.02±0.84 2.70±0.36 3.07±0.51术后4周 3.03±0.22 2.99±0.18 2.93±0.14术后12周 2.29±0.31 1.88±0.82 2.93±1.20 APTT(s) 术后2周 41.74±23.08 51.52±5.24 44.14±21.74术后4周 65.92±21.7181.48±25.3755.58±14.30术后12周 53.96±11.6965.80±31.3060.92±22.55 TT(s) 术后2周 14.84±6.08 18.68±5.72 18.20±4.74术后4周 17.96±5.61 19.90±0.55 20.66±1.19术后12周 26.56±3.28 34.84±8.77 38.64±30.70 PT(s) 术后2周 12.94±7.43 10.27±8.94 13.32±7.82术后4周 12.30±2.02 11.90±1.13 12.64±1.78术后12周 30.14±13.58 15.80±1.29 29.22±14.01 WBC(×109/L)术后2周 9.70±3.55 12.16±2.49 10.90±2.03术后4周 10.34±5.40 11.81±3.14 10.27±0.96术后12周 2.29±0.31 1.88±0.82 2.93±1.20 Lym(×109/L)术后2周 4.70±1.60 3.22±0.56 3.34±0.93术后4周 2.07±0.64 3.02±1.40 2.68±1.11术后12周 5.50±1.17 5.25±0.95 4.49±1.25 Eos(×109/L)术后2周 0.40±0.12 0.86±0.25 0.74±0.09术后4周 0.10±0.06 0.18±0.05 0.14±0.05术后12周 0.17±0.04 0.30±0.17 0.17±0.05 RBC(×109/L)术后2周 5.77±0.83 6.39±1.37 6.30±1.33术后4周 6.17±0.41 6.26±0.40 5.64±0.32术后12周 6.03±0.47 5.38±0.52 5.41±0.55
2.4 HE染色
对照组血管内膜显著增厚、结构致密,细胞严重纤维化,可见平滑肌细胞并纤维组织增生,静脉补片组与牛心包补片组内皮细胞排列整齐,纤维化程度较低。(图4)

图4 血管内皮细胞纤维化程度(HE染色,×200)
2.5 Tunel凋亡检测结果
对照组与静脉补片组细胞凋亡少,提示组织细胞生长迅速,增殖较快,易纤维化,继而形成狭窄;牛心包补片组细胞凋亡多,提示组织细胞生长缓慢,纤维化程度低。(图5)

图5 Tunel凋亡检测分析细胞凋亡
2.6 透射电镜结果
对照组电镜下可见小细胞紧密分布于血管平滑肌细胞内,板层细胞排列紊乱和分层;静脉补片组电镜下可见中膜平滑肌细胞分布不规律、变性,间质增宽,在中层胶原纤维显著增生;牛心包补片组电镜下可见中膜平滑肌细胞空泡变性,在中层胶原纤维增生较少。(图6)

图6 透射电镜分析血管内膜超微结构
2.7 免疫组化结果
对照组MMP2、MMP9表达量较高,牛心包补片组PKCα表达量较高。(图7)

图7 三组动物免疫组化结果
3 讨论
欧洲血管外科学会在2018年发布的一篇荟萃分析中显示,就围手术期死亡、颅神经损伤方面而言,CEA一期缝合和补片成形术没有显著差异,但从长期结果看,常规补片成形术与围手术期同侧脑卒中和短期内颈内动脉血栓形成的显著减少有关,还可以减少对侧卒中和颈动脉再狭窄的发生[10]。在补片成形术中,静脉补片是常用方法,而且能抵抗感染,然而术后假性动脉瘤的形成率较高。合成补片材料,包括聚四氟乙烯和涤纶,补片破裂风险较低,但具有更高感染风险。与合成补片材料相比,牛心包补片术后感染、血栓形成等其他并发症风险较低,且不需要长期抗凝。而且牛心包补片可对感染具有一定抵抗力,研究显示牛心包补片用于重建感染部位的血管,长期随访结果良好,复查未提示血栓形成或狭窄的迹象,但文献报道证据级别较低,需要更多的实验数据来确定是否存在差异[11-13]。血管移植物感染是术后少见、但较危急的并发症,早中期感染通常发生在术后4个月内,WBC增多[14-15]。本实验中,术后12周三组WBC比较,差异无统计意义,提示其良好的生物相容性。CEA术后早期再狭窄的主要原因是内膜增生,新内膜增生所致的再狭窄通常始于术后3~6个月。近年来,再狭窄通常被认为是潜在动脉粥样硬化疾病的进一步演变,再狭窄相关因素包括颈动脉内径较小、血脂异常等[16-17]。超声作为评价血管疾病的首选影像检查,不仅可评估术后再狭窄情况,还可用于评估移植物周围积液或脓肿,并可将积液与脓肿或假性动脉瘤区分[14]。本实验中,除静脉补片组见假性动脉瘤形成外,补片周围均未出现积液与脓肿。超声所示牛心包补片组见少量内膜增生,但未见明显狭窄,可能与观察时间有关。
基质金属蛋白酶超家族对细胞外基质成分(如胶原蛋白)及非细胞外基质蛋白(如细胞因子、脂质载体蛋白等)具有很强的蛋白水解活性。由于其底物众多,基质金属蛋白酶的集体作用调节多种过程,如细胞迁移和生长、血管生长(血管生成)、血管收缩、新陈代谢等,与心血管疾病的发展之间有许多联系。MMP2和MMP9也称为明胶酶或Ⅳ型胶原酶。MMP2是一种锌钙依赖性内肽酶,其活性的上调有可能通过裂解包括血浆脂蛋白和细胞表面脂蛋白受体在内的众多代谢介质来解除对脂质代谢的调控。血浆低密度脂蛋白胆固醇清除受损和血清MMP2的上调影响动脉粥样硬化的发展[18-19]。MMP9主要通过蛋白参与细胞外基质降解而在应对脑损伤中发挥作用,因此MMP9作为脑卒中诊断生物标记物的期望很高,MMP9浓度的增加与梗死范围、神经预后较差等有关[20-21]。然而,MMP9的升高并不是缺血性脑卒中所特有标志,而且据报道,其浓度在脑卒中后24 h才达到峰值,其临床价值仍有待挖掘,还需对MMP9的测量进行标准化和重复试验[22]。蛋白激酶C是一类特异性蛋白激酶家族,根据结构和机制分为经典型蛋白激酶C、非典型蛋白激酶C和新型蛋白激酶C等12种亚型,是调节细胞激活、分化、增殖、凋亡和效应器功能的关键信号转导因子。蛋白激酶C激活可引起与动脉粥样硬化相关的异常改变,如内皮功能障碍、激活细胞内信号通路、细胞因子和生长因子的表达增加等[23-24]。PKCα是经典蛋白激酶C的一员,其在细胞分化、增殖、凋亡、细胞转化、运动、黏附等多种细胞功能中发挥着不可或缺的作用。但PKCα在细胞增殖中的作用尚不清晰,PKCα在特定的细胞类型中表现出抗增殖功能,在其他类型的细胞中可能作为生长刺激因子发挥作用,研究发现,PKCα经常被半胱氨酸蛋白酶水解,但在凋亡过程中,它在特定的细胞类型中被激活,这使得更难确定PKCα在细胞增殖中的作用。比如在人乳腺癌细胞中,PKCα过表达显示出更具侵袭性的表型和促进了细胞增殖。相反,PKCα在几种细胞类型中作为抗增殖因子,如胶质瘤细胞和内皮细胞[25]。本实验探讨了MMP2、MMP9、PKCα在颈动脉修复术后的表达情况,发现静脉补片、牛心包补片可抑制颈动脉修复术后MMP2、MMP9的表达,减缓细胞迁移和生长、血管生成及术后继发动脉粥样硬化等过程,牛心包补片表现较优。本实验中,PKCα表现为对内皮细胞的抗增殖作用,补片组PKCα表达量较对照组增多,牛心包补片组PKCα表达量明显增多,提示其对内皮细胞增殖的抑制作用。
虽然本研究通过直观观察探讨CEA一期缝合及牛心包补片成形术对颈动脉修复术后再狭窄的影响,但术后继发动脉粥样硬化的启动过程及MMP2、MMP9、PKCα的信号通路,在本实验中尚未得到研究。本实验中,新西兰兔在行颈动脉修复术前无颈动脉粥样硬化,但术后均存在不同程度内膜增生、再狭窄变化。最近研究发现,ApoE基因敲除联合高脂喂养可以有效建立小鼠颈动脉粥样硬化斑块模型,但小鼠颈动脉内径较小[26],颈动脉修复术操作难度较新西兰兔大,术后再狭窄率高,后期的实验中,可进一步探究如何快速建立新西兰兔颈动脉粥样硬化模型。
综上所述,建立颈动脉修复术后再狭窄模型,联合牛心包补片成型较静脉补片、CEA一期缝合组在预防术后再狭窄、继发动脉粥样硬化方面具有良好效果。本研究为阐明颈动脉修复术后MMP2、MMP9、PKCα在继发动脉粥样硬化的机制提供新的依据,为颈动脉修复联合牛心包补片成形术后减少颈动脉术后远期再狭窄或闭塞的风险提供有力证据。
