原发性下肢浅静脉曲张诊治专家共识(2021版)
2021-11-20中国微循环学会周围血管疾病专业委员会
中国微循环学会周围血管疾病专业委员会
下肢浅静脉曲张是一种常见的临床表现,以小腿浅静脉曲张最多见,多发于大隐静脉,可以由多种不同疾病引起。早期、中期下肢浅静脉曲张不同程度地影响着患者的生活质量,后期会使部分患者丧失一定的劳动能力,消耗大量医疗资源。国外文献报道大隐静脉曲张的患病率达25%[1];国内文献报道,原发性下肢浅静脉曲张成年人患病率为10%,男性和女性的患病率接近,女性的患病率略高[2]。总之,原发性下肢浅静脉曲张是指下肢浅静脉瓣膜关闭不全或静脉壁薄弱,使静脉内血液倒流,远端静脉淤滞,继而病变静脉壁扩张、变性、出现不规则膨出和扭曲,早期表现为肢体酸胀不适、浅静脉迂曲成团,随着病情的进展可出现皮肤瘙痒、色素沉着、脱屑、脂质硬化,甚至溃疡、出血及血栓性浅静脉炎[3]。应与继发性因素如深静脉血栓形成(deep venous thrombosis,DVT )、髂静脉压迫、腹腔肿瘤压迫等发生梗阻而导致的静脉曲张相区别。
目前国际上对下肢浅静脉曲张的发病机制存在很多不同的理论,但相对一致是,轴向静脉的瓣膜功能障碍所致静脉压升高、血液反流和浅静脉管腔增粗导致静脉迂曲隆起进而引发一系列临床表现[4]。
下肢浅静脉曲张的发生原因包括原发性下肢浅静脉瓣膜功能不全、先天性静脉瓣膜功能缺陷及继发于下肢深静脉瓣膜功能不全、静脉回流受阻等。继发性下肢浅静脉曲张需以原发病的治疗为重点,其诊疗过程具有特殊性,故不在本共识讨论之列。对原发性下肢浅静脉曲张规范的评估和治疗有利于中断病程,改善预后。
1 下肢浅静脉曲张诊断
1.1 病史采集
询问患者下肢静脉曲张的相关家族病史,尤其需了解有无可导致继发性下肢静脉曲张的原发病史。早期下肢静脉曲张引起的症状相对较轻,主要表现为患肢酸胀、不适和胀痛等;后期症状则主要由各类并发症引起,并发症包括足靴区的皮肤色素沉着、脂溢性皮炎等改变及溃疡形成,血栓性浅静脉炎引起的沿静脉走行的疼痛,曲张静脉破裂出血等。同时,还需要了解职业暴露因素,如工人、农民、教师、交通警察等因为工作需要长期站立的人群均是下肢静脉曲张发生的高危人群。
1.2 体格检查
下肢静脉曲张的体征主要表现为下肢浅静脉的蚯蚓状突起、扩张和迂曲,以及并发症相关的足靴区皮肤改变,包括色素沉着、脱屑、皮炎、脱毛,甚至溃疡形成等。下肢内侧及胫前、足背区域的浅静脉曲张提示病变发生于大隐静脉系统,而小隐静脉系统病变常表现为小腿后方的浅静脉曲张。对相关体征的仔细检查可有助于对疾病病情的准确评估。
传统的体格检查方法包括大隐静脉瓣膜功能试验(Trendelenburg试验,即屈氏试验)、深静脉通畅试验(Perthes试验,即潘氏试验)和交通静脉瓣膜功能试验(Pratt试验)。此类检查手段仅可用于初步评估下肢静脉功能,不能作为诊断依据,目前在临床上已较少使用,详细的下肢血管彩色多普勒超声检查可较好地达到诊断的目的。
1.3 辅助检查
1.3.1 影像学检查
(1)血管彩色多普勒超声。血管彩色多普勒超声可以同时明确下肢的深静脉、浅静脉、穿通静脉和交通静脉的功能,判断有无反流或血栓形成。该检查安全、无创、简便、快捷、准确率高。操作时,需嘱患者采取站立位,还可增加屏气试验(Valsalva)、挤压试验等,以进一步明确大隐静脉是否存在反流。其检查结果准确、可靠,同时可以为手术提供直接的引导和辅助,是目前诊断下肢静脉曲张首选的辅助检查方法。
(2)数字减影血管造影(digital subtraction angiography,DSA)、顺行性静脉造影。随着介入技术的发展,DSA的应用日益广泛,特别适合髂静脉狭窄病变的一期处理。顺行性静脉造影被认为是诊断下肢静脉曲张的金标准,但由于其属于有创性检查,因此,目前,更多地选用功能日益完善的血管彩色多普勒超声技术进行筛查。但在一些情况下,如先天性下肢静脉畸形、复杂交通静脉、深静脉功能不良、髂静脉病变等,下肢静脉造影的直观性与准确性具有优势。
(3)计算机断层扫描静脉成像(computed tomography venography,CTV)/磁共振静脉成像(magnetic resonance venography,MRV)。可用于静脉阻塞性疾病和先天性静脉疾病的诊断,适用范围类似静脉造影,但准确度不及静脉造影,对于肿瘤性病变或外源性压迫尤其适用。
1.3.2 实验室检查
诊断下肢静脉曲张时,需要依靠的实验室检查并不多。实验室检查主要用于辅助诊断下肢静脉曲张的相关并发症。例如,在并发血栓性浅静脉炎时,可增加血常规、C反应蛋白(C-reactive protein,CRP)、D-二聚体等检测以评估炎性反应和血液黏度等。
2 下肢浅静脉曲张鉴别诊断
临床上,继发性下肢浅静脉曲张并不少见,其主要致病因素可概括为继发性下肢深静脉瓣膜功能不全和静脉高压/回流受阻两大类。
2.1 深静脉瓣膜功能不全
最常见的下肢深静脉瓣膜功能不全为下肢原发性深静脉瓣膜关闭不全,是指下肢深静脉瓣膜的游离缘伸长、松弛、下垂,以致在下肢静脉血液回流时,管腔中两个相对的瓣叶无法紧密对合,从而引起深静脉倒流性病变,造成下肢静脉系统瘀血和高压,最终导致一系列的临床症状和体征,如下肢浅静脉继发性曲张及与其相关的一系列临床表现[5],可以进行手术。此外,常见的特征性临床表现还包括下肢肿胀,常表现为凹陷性肿胀,抬高肢体后可明显消退。鉴别时,首选的辅助检查方法为血管彩色多普勒超声,可探测下肢静脉系统的血流方向,以直接判断是否存在反流。其他鉴别手段还包括光电容积描记检测,可根据静脉再充盈时间来判断瓣膜功能不全的静脉段;双功彩色多普勒超声可直接观察静脉瓣膜的活动,判别反流位置,并利用血流频谱测定静脉血反流量;下肢静脉造影可见深静脉主干增粗,瓣膜影模糊或消失,深静脉主干段失去竹节状膨隆,同时可见增粗的穿通静脉[6]。
继发性下肢深静脉瓣膜关闭不全常发生于血栓形成后再通的过程中,瓣膜遭受损害,继而引起的静脉反流及浅静脉和交通静脉瓣膜关闭不全导致下肢静脉高压。其临床症状与原发性深静脉瓣膜关闭不全相似,手术需慎重。此外,还存在先天性下肢深静脉无瓣膜症的临床病例,较少见,以早期出现下肢静脉系统高压的临床表现为特征,多于少年或青春期发病,常有家族患病史[7]。
2.2 深静脉高压/回流受阻
2.2.1 静脉血栓后综合征(post-thrombotic syndrome,PTS)
PTS指DVT后,由于静脉阻塞和(或)瓣膜功能受损,导致长期静脉高压所引起的肢体肿胀、疼痛、皮肤营养障碍、静脉跛行等症状和体征的临床综合征。其静脉高压是导致继发性下肢浅静脉曲张的重要原因之一[8]。诊断PTS主要根据DVT患者的病史及PTS的症状和体征;对于怀疑PTS尤其是髂静脉阻塞的患者,可行血管彩色多普勒超声、CTV/MRV或静脉造影检查。
2.2.2 髂静脉压迫综合征
髂静脉压迫综合征又称Cockett综合征,是指髂静脉在汇入下腔静脉前,受到髂动脉和腰骶椎压迫而致局部狭窄、闭塞或者管腔内粘连。其中,左髂总静脉受到右髂总动脉及后方腰骶椎压迫是最常见的解剖学因素[9]。髂静脉压迫造成静脉回流障碍和下肢静脉高压,成为下肢浅静脉曲张的病因之一。
2.2.3 下腔静脉/ 静脉受压
下腔静脉原发性平滑肌瘤、腹腔肿瘤、盆腔肿瘤或腰椎来源的肿瘤,压迫或侵犯下腔静脉、髂静脉,引起腔静脉、髂静脉狭窄,导致下肢静脉高压,可有下肢静脉曲张的表现。腹腔增强计算机断层扫描(computed tomography,CT)检查可发现原发病灶[10]。
2.2.4 布-加综合征(Budd-Chiari syndrome,BCS)
BCS是指肝后段下腔静脉和(或)肝静脉发生狭窄或完全闭塞的病变。特征性的临床表现为肝大、进行性肝功能损害和大量腹腔积液,严重的患者可发生上消化道出血、呕血和黑便,晚期易并发肝硬化[11]。BCS所造成的静脉高压常导致双下肢浅静脉曲张。
2.2.5 动静脉瘘(arteriovenous fistula,AVF)
AVF是动、静脉之间存在的异常交通,动脉血经瘘口进入静脉,使血流动力学发生改变[12]。常见的特殊体征: 局部皮温增高,可闻及血管杂音及震颤;脉率加快;心脏扩大;心力衰竭。动脉血流直接汇入,可导致静脉压力剧增,并造成下肢浅静脉曲张。
2.3 其他
先天性静脉畸形骨肥大综合征(Klippel-Trenaunay syndrome,KTS)是一种先天性罕见病,其特征是血管畸形,典型表现为红葡萄酒色斑、静脉畸形、患肢过度增长,可累及淋巴管、肠道、膀胱、直肠等器官[13]。KTS的病因至今不详,有研究认为血管瘤和静脉畸形是机体先天性发育异常的结果,而浅静脉曲张和组织增生则是多种因素共同作用引起的继发表现[14]。
3 下肢浅静脉曲张评估
目前,国际上评价慢性静脉疾病严重程度及治疗效果的权威方法和标准主要有CEAP分类和VCSS评分。
3.1 CEAP分类
美国静脉论坛(American Venous Forum,AVF)国际专家特别委员会于1994年首次提出CEAP静脉分类系统[15]。CEAP是各分类系统的英文单词的首字母缩写:C——临床表现(clinical),E——病因(etiology)、A——解剖部位(anatomy),P——病理(pathology)。该分类方法经多次改版完善后,目前临床应用最为广泛。(表1)
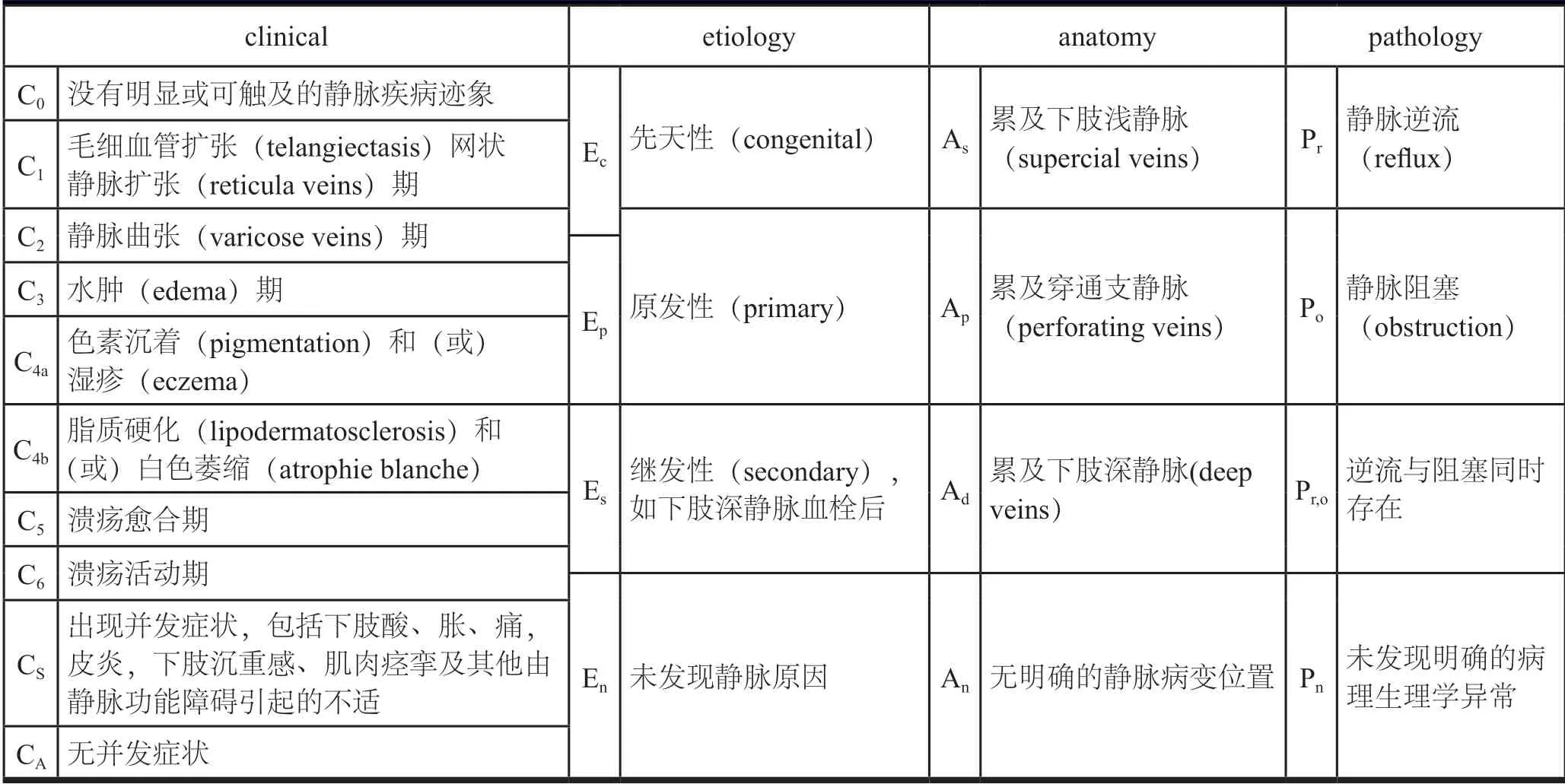
表1 CEAP静脉分类系统[15]
3.2 VCSS评分
Rutherford对CEAP静脉分类系统进行改良后提出了静脉临床危重程度评分(the venous clinical severity score,VCSS)系统[16],包括疼痛、水肿、静脉性跛行、色素沉着、脂溢性皮炎、溃疡、溃疡直径、病期、复发和数量10个评估项目,每个单项0~3分,总分为0~30分。评分越低表示病情越轻,评分越高表示评估结果越差。该评分系统更适用于病情较重的下肢静脉曲张,同样经过多次改版。(表2)

表2 改良静脉临床危重程度评分[16]
4 下肢浅静脉曲张非手术治疗
近年来,药物治疗的重要性逐渐受到重视,药物联合压力治疗和(或)手术的综合治疗已成为新的趋势。综合治疗方案在遏制和缓解下肢浅静脉曲张的病理生理变化方面作用显著,同时对进一步巩固手术疗效亦发挥着重要作用。
4.1 药物治疗
药物治疗在下肢静脉曲张的保守治疗中发挥重要作用,其适合于CEAP各分级,贯穿整个CEAP分级的始终,可改善静脉功能,用于缓解下肢沉重、酸胀不适、痉挛、疼痛、皮肤营养改变和水肿等临床症状,促进溃疡愈合[17]。治疗药物可分为静脉活性药物(venoactive drug,VAD)和其他药物。
4.1.1 VAD
共同作用机制:(1)降低毛细血管通透性,抗炎、抗渗出;(2)保护静脉,提高静脉弹性,增加静脉张力;(3)促进静脉回流,促进淋巴回流,提高肌肉泵功能,改善微循环;(4)抗氧自由基,保护受损伤的组织细胞。适用于各阶段的患者,可与硬化剂治疗、手术和(或)压力治疗联合使用[18]。VAD的推荐使用时间为3~6个月或更长时间。常用的VAD包括三大类:
(1)黄酮类(flvonoids)。主要成分为地奥司明。目前,国内应用较为广泛的药物是葛泰,采用微粉化或微粒化纯化工艺,使黄酮类的小肠吸收率是非微粒化黄酮类的2倍,具有抗炎作用,可抑制白细胞与血管内皮细胞的相互作用。非微粒化黄酮类VAD对缓解症状也有一定的效果,国内外也有较广泛的应用。黄酮类VAD在众多国内外指南和专家共识中获得较高级别的推荐。
(2)七叶皂苷类(seven leaves saponins)。主要成分为七叶素和马栗种子提取物,具有降低毛细血管渗透性,减少渗出,减轻水肿;增加静脉张力,活化静脉瓣膜,促进静脉血液回流;清除氧自由基等作用[19]。疗效确切,发挥着重要而独特的作用,国内外应用广泛,推荐剂量为每日口服100~150 mg。
(3)香豆素类(coumarins)。来源于草木犀植物提取物,可降低毛细血管通透性,促进血液循环及增加血液流量,促进淋巴回流,有效减轻水肿,特别是对炎性肿痛的疗效更佳[20]。
4.1.2 其他药物治疗
(1)纤维蛋白降解药物(fibrinolytic drug):可改善局部血液循环,逆转皮肤损害,尤其对脂溢性皮炎的炎性反应和组织硬化的效果较好。临床常用的药物是多磺酸粘多糖、舒洛地特等。多磺酸粘多糖通过作用于血液凝固系统和纤维蛋白溶解系统而发挥抗血栓形成的作用。通过抑制各种参与分解代谢的酶及影响前列腺素和补体系统而发挥抗炎作用。其还能通过促进间叶细胞的合成及恢复细胞间物质保持水分的能力从而促进结缔组织的再生。因此,纤维蛋白降解药物能防止浅表血栓的形成,促进其吸收,阻止局部炎性反应的发展,加速血肿的吸收。舒洛地特具有血管内皮修护、抗炎、抗血栓的作用,口服可缓解症状,加速静脉溃疡愈合,预防深静脉血栓复发和PTS。
(2)前列腺素E1(prostaglandin E1):可降低皮肤病变的炎性反应,抑制血小板聚集及改善肢体循环功能。对淤滞性皮炎、脂溢性皮炎和静脉性溃疡均具有治疗作用。
(3)活血化瘀中药:具有活血化瘀和软坚散结功效的中药对皮肤损害具有较好的治疗效果。
(4)非甾体抗炎药物(non-steroidal anti-inflammatory drug):对于脂溢性皮炎的复发和活动期具有良好的抗炎、消肿和止痛作用。
(5)其他常用药物包括羟苯磺酸钙药物、抗凝药物和抗血小板药物,均对下肢静脉曲张有一定的疗效,根据病情可以选择使用。
药物治疗能有效减轻患者的临床症状和体征。术前使用可为手术创造条件,延缓疾病进展,降低疾病的临床分期。术中及术后使用可以预防早期并发症的发生,巩固手术疗效[21-22]。
4.2 压力治疗
下肢浅静脉曲张的压力治疗包括弹力绷带、循序减压弹力袜和间歇充气加压装置等,使下肢远端至近端所受的压力逐渐降低,浅表静脉完全萎瘪,促使血液通过深部回流。压力治疗可用于静脉曲张及并发症的治疗,是手术后尤其微创手术治疗后的必要措施,适用于静脉曲张各期[23-24]。
压力治疗应达到以下要求:缓解病理性血液淤滞状态及其程度,遏制包括静息性、运动性在内的病理性静脉高压;促进水肿组织中过多的水分重吸收,缓解静脉及淋巴系统的负担,减少长期水肿引发的炎性反应。
5 下肢浅静脉曲张手术治疗
目前,手术是治疗下肢静脉曲张最有效的方法。在手术之前,应该对患者进行全面的评估,以明确病变的严重程度、部位及特征,并由此明确是否有手术指征及选择何种个体化手术方式。下肢浅静脉曲张的手术治疗方式主要有以下几种。
5.1 开放式手术治疗
5.1.1 大隐静脉高位结扎+剥脱术
相对于传统的术式,大隐静脉高位结扎+剥脱术从根本上消除了大隐静脉瓣膜功能不全所引起的反流,也是相对彻底的手术方法,原则上适用于所有C2级及以上的下肢浅静脉曲张患者。缺点是该手术切口多,创伤大。该术式可分为顺行剥脱、逆行剥脱、顺逆结合剥脱术和基于血流动力学的门诊手术——CHIVA等多种方式[25-26]。
(1)逆行剥脱。在内踝处作切口,找出大隐静脉主干,远端结扎,插入剥离子装置并送至卵圆窝处,于该处作切口,找出其属支并结扎切断,距隐股交界0.5 cm处切断大隐静脉主干,近心端结扎并缝扎,远心端扎于剥离子上,从上到下抽除大隐静脉。新型剥脱导管用于改良的逆行剥脱。
(2)顺行剥脱。在卵圆窝处作切口,找出大隐静脉及其属支,结扎并切断其属支,距隐股交界0.5 cm处切断大隐静脉主干,近端结扎并缝扎,向远端插入剥离子并送至内踝,于该处作切口游离此处大隐静脉,远心端结扎,近心端扎于剥离子上,从下到上抽除大隐静脉。
(3)顺逆结合剥脱术。一般大隐静脉在膝关节上下方多有交通支,剥离子在此多遇阻碍,可分别于卵圆窝处、内踝处及膝关节附近作切口,分段将大隐静脉抽除。该术式在临床上较常用。
(4)CHIVA。CHIVA是法语Cure Conservatrice et Hemodynamique del’Insufficience Veineuse en Ambulatoire的简称,中文名称为针对静脉血流动力学障碍的保守型门诊手术,是一种静脉曲张微创手术方式。CHIVA对静脉曲张传统手术的破坏性、废弃性有了一定减轻,通过术前超声对静脉血流动力学分析,进行血流改道手术[27]。手术一般在显露大隐静脉主干后结扎并切断相关属支,属于点式剥脱的一种特定方式。
5.1.2 外套式剥脱导管剥脱术
外套式剥脱导管剥脱术是一种针对大隐静脉主干进行的新型外套式剥脱术式。手术方式简要介绍如下:将外套式剥脱导管通过腹股沟切口将需要剥脱的远端大隐静脉主干,从导管前端喇叭口导入导管并从侧孔引出,从导管尾部注射麻醉肿胀液于隐静脉室内,向前缓慢、轻度旋转导管,切割大隐静脉属支,同时剥离主干,到达远端需要切断的位置时,使用头端内置切刀切断主干,最远可到达膝关节上方。切断后,残端自然痉挛、回缩,同时在肿胀液的有效压迫下可避免出血。该术式是从传统内翻到外套式剥脱的革新,避免了热损伤,有效解除了导致曲张的下行压力入路,是一种全新的开放手术方式和治疗理念,也属于点式剥脱的一种方式。
以上几种传统、改良和新型的术式均可经点式切口进行,创伤亦可非常轻微。腔内微创手术(或新型剥脱导管)通常也会附加点式切口处理大隐静脉根部囊状扩张和膝下大的扭曲成团。基于经济发展不均衡,传统大隐静脉高位结扎+剥脱术改良的点式切口术式在许多基层医院值得推广。
5.2 腔内消融治疗
5.2.1 热消融治疗
热消融治疗主要包括腔内激光消融术(endovenous laser ablation,EVLA)、射频消融术(radiofrequency ablation,RFA)和微波消融术等。除了普通激光光纤可以直接闭合静脉之外,其他热消融术因为光纤或导管支撑在静脉内均不能直接闭合,而是撤出支撑后压力治疗导致闭合、粘连、机化和吸收,从而达到治疗目的,因此,压力治疗是热消融治疗的根本保证。
(1)EVLA。EVLA是本世纪初出现的治疗下肢静脉曲张的微创新技术。原理:穿刺静脉置入光导纤维,激光经光导纤维转化为热能,作用于静脉内膜引起热损伤,静脉内膜胶原皱缩,随后纤维化,使曲张静脉闭塞。激光消融(包括射频等热效应治疗方式)术中,通常需在血管走行毗邻的深浅筋膜间隐静脉室注射肿胀麻醉液作为配合。2005年,国内首次提出肿胀麻醉液的概念,推荐配比为500 ml生理盐水+2%利多卡因10 ml和其他成分。良好的肿胀麻醉液注射可同时达到局部镇痛、压瘪静脉管腔和避免皮肤灼伤的目的,适宜的肿胀麻醉液配制比例需满足一定的要求[28]。在达成上述作用的前提下,本共识也认可国内相关诊疗中心根据临床应用经验对肿胀麻醉液配比进行的调整。EVLA与大隐静脉高位结扎+剥脱术的疗效相当,具有操作简单、微创、美观、经济、住院时间短、康复快、可门诊手术等优点;缺点是激光的穿透性造成静脉血管劈裂引起瘀斑,隐神经受损引起麻木、刺痛等。目前,新型环光纤、双环,甚至多环光纤有助于减少功率,从而降低损害[29]。主干直径4~10 mm是本共识推荐的EVLA适宜范围。当大隐静脉根部管腔直径超过10 mm或存在瘤样扩张,或存在大量血栓时,建议行点式切口的大隐静脉高位结扎+剥脱术。EVLA凭借其安全、有效、复发率低、经济等特点广泛应用于临床,颇受认可。
(2)腔内RFA。RFA是通过射频发生器和专用的电极导管产生热能,造成与发射电极接触的有限范围内的局部组织高热,导致血管内皮损伤、静脉内膜胶原纤维收缩,直至血管闭合,并最终导致纤维化。采用RFA治疗可以通过小切口或穿刺进行,但需彩色多普勒超声检查引导及定位。RFA也是2002年后出现的新技术,具有微创、住院时间短、康复快等优点,且其组织穿透性较弱,对周围组织损伤相对较小[30]。近年来,随着导管技术的不断成熟,RFA受到许多临床医师的青睐。本共识推荐的RFA适宜范围为主干直径4~15 mm。需要注意的是,RFA仅处理近端主干,远端主干及属支均需另行处理;行RFA治疗时,大隐静脉主干通常无需行高位结扎,但在大隐静脉根部管腔直径超过15 mm或存在瘤样扩张,或存在大量血栓时,建议行点式切口的大隐静脉高位结扎+剥脱术。
(3)腔内微波消融术。其是一种国产特有的治疗下肢浅静脉曲张的方法,其原理与RFA类似,是通过转换热能使静脉内膜纤维化收缩,进而管腔闭锁。本共识推荐的适宜范围为主干直径4~15 mm。腔内微波消融术仅处理近端主干,远端主干及属支均需另行处理。隐静脉根部管腔直径超过15 mm或存在瘤样扩张,或者存在大量血栓时,建议行点式切口的大隐静脉高位结扎+剥脱术。
5.2.2 化学消融
目前,应用于下肢浅静脉曲张的腔内化学消融治疗方式主要指的是硬化剂注射治疗。
5.2.2.1 硬化剂类型
治疗下肢浅静脉曲张的硬化剂按照化学结构可分为两类:(1)表面活化剂或去污剂,即泡沫硬化剂。该类物质直接破坏静脉内皮细胞,具有较小剂量、较大内膜接触面、较长接触时间的优点,目前应用较为广泛。(2)化学刺激剂或高渗溶液。均为液体硬化剂,直接作用于内皮细胞使其坏死,由于存在诸多不良反应,目前临床中的使用较少[31-32]。本共识推荐将泡沫硬化剂作为临床治疗下肢浅静脉曲张的首选硬化剂,包括聚多卡醇和聚桂醇。
5.2.2.2 适应证
下肢浅静脉曲张的硬化剂注射治疗是利用硬化剂注入曲张静脉腔内,破坏静脉内膜,使其发生粘连,导致纤维化闭合,从而消除或减轻局部的静脉高压。被推荐应用于所有类型的下肢静脉曲张。轻症静脉曲张或管径较小的毛细血管、网状静脉扩张和小静脉曲张,以及非隐静脉主干的大口径曲张静脉,可以单独使用;也可作为手术时的辅助治疗方式,处理术后残留的曲张静脉尤为合适;针对一些不适合进行更积极的手术处理的部位,如足背环状静脉,硬化剂治疗通常为首选处理方式;同时,硬化剂治疗还可适用于不能耐受开放手术的患者。
5.2.2.3 禁忌证
(1)绝对禁忌证:硬化剂过敏;胶原性疾病史;近期有血栓形成及肺栓塞病史,伴有局部或全身性感染;卧床制动;下肢严重缺血。
(2)相对禁忌证:过敏体质;妊娠早期和哺乳期;乳胶过敏;血液高凝状态(S蛋白缺乏等);有DVT复发或肺栓塞复发史;糖尿病微循环病变;未控制的高血压(如嗜铬细胞瘤);卵圆孔未闭或房间隔缺损。
5.2.2.4 硬化剂治疗注意事项
(1)不同直径的静脉所选用的泡沫硬化剂浓度及剂量有相应的区别。以聚多卡醇泡沫硬化剂为例,静脉直径≥8 mm(大隐、小隐静脉主干等),慎重使用。推荐使用3%聚多卡醇,泡沫注射剂量4~6 ml;静脉直径3~7 mm(交通静脉、一级属支等),推荐使用1%聚多卡醇,泡沫注射剂量2~4 ml;静脉直径<3 mm(二级属支、网状静脉、蜘蛛静脉等),推荐使用0.5%聚多卡醇,泡沫注射剂量不超过1 ml。每个注射部位以泡沫硬化剂局部充满为宜,推荐单例患者泡沫硬化剂注射总剂量≤2 mg/kg。当静脉直径>8 mm时,单纯硬化剂注射的治疗效果尚无确切数据,建议手术医师在选择治疗方式时应根据患者病情及实践诊治经验谨慎选择。
(2)应缓慢注射,避免阻力过高。
(3)每个注射点注射完毕后,助手用消毒干棉球紧压针眼,迅速拔针。
(4)完成全部注射点治疗后,对患肢立即给予加压包扎。
(5)对于一些穿刺困难的病变静脉或位置较深的交通支静脉,可选择在超声引导下进行,可精准定位靶静脉,并即时评估治疗效果。
(6)每次注射泡沫总量一般不超过10 ml,确有必要时,充分评估风险效益后可增加用量。
5.2.3 机械化学消融术
近年来,国外陆续出现的机械化学消融装置主要包括两种类型:(1)机械装置注射泡沫硬化剂。通过机械装置使大隐静脉主干内膜毛糙并痉挛,进而仅需注入少量泡沫硬化剂即可闭合主干及其属支;(2)机械装置将氰基丙烯酸酯(医用胶)直接注入大隐静脉主干粘合静脉。
此类治疗方式从原理上彻底改变了热消融治疗的损伤效应,使术后局部反应显著降低,是今后下肢静脉曲张微创治疗的发展方向之一。目前,这两种类型的机械装置在国外分别有其相应的产品,推广迅速,国内亦在进行相关工作。
5.3 透光直视旋切术(transilluminated powered phebectomy,TIPP)
目前,TIPP主要建立于曲张静脉旋切系统(TriVex system),采用冷光源进入皮下浅筋膜层,通过灌注肿胀液扩大空间,利用皮肤透光使迂曲的浅静脉直接显示,使用旋转刀准确旋切目标曲张静脉并吸出,经验丰富的术者甚至可以不用光源,从而达到治疗目的[33]。该方法适用于较大面积的曲张静脉团,鉴于刨吸器本身可造成淋巴及感觉神经创伤,对术者有一定的要求,不推荐初学者学习,这种术式仅处理曲张属支,主干需另行处理,加之耗材费用问题等,限制了其临床推广使用。
5.4 其他术式
一些用于下肢浅静脉曲张的术式虽然也进行了临床应用,但由于相关因素的限制,在临床实际应用中并未被推广或接受,在此仅作简单介绍。
(1)静脉腔内电凝治疗术。导管电凝术是通过电灼静脉内膜,促使内膜粘连,使管腔闭合,阻断曲张静脉血液倒流,可达到与剥脱血管同样的效果。
(2)经内镜行穿支静脉离断术。经内镜小腿穿支静脉离断术是利用内镜通过特殊器械对穿支静脉进行结扎处理的方法,目的在于阻断病理穿支静脉的反流。
5.5 特殊病变的处理
5.5.1 单纯小隐静脉系统曲张
单纯的小隐静脉系统曲张在临床上存在一定的比例,其治疗原则和治疗方式与大隐静脉系统病变相类似。针对小隐静脉系统曲张,本共识推荐选择点式剥脱术、腔内热消融治疗、泡沫硬化剂治疗等方式进行处理。行近心端结扎时,结扎水平应尽量靠近腘窝处小隐静脉汇入点。
5.5.2 穿通支静脉
下肢浅静脉曲张的患者,若同时存在发达的交通静脉和反流,通常可导致较为严重的并发症,如局部反复出现并迁延不愈的静脉性溃疡。本共识认为对于交通支静脉的处理是必要的。目前,处理方式首选手术探查后进行确切结扎。准确的热消融治疗和硬化剂注射治疗也可取得较好的效果,但是需要加深对治疗技术的学习,避免DVT的风险增加。
5.5.3 网状静脉曲张及毛细血管扩张
下肢网状静脉曲张及毛细血管扩张属于静脉疾病CEAP 1级病变。网状静脉曲张直径通常为1~3 mm,毛细血管扩张直径在1 mm以下。目前,针对网状静脉曲张、毛细血管扩张的治疗,主要推荐硬化剂治疗和激光治疗两种方式。
(1)硬化剂治疗。对于网状静脉曲张,推荐采用空气作为制作泡沫硬化剂的气体成分,也可使用二氧化碳和氧气的混合物,硬化剂原液和气体的推荐比例为1∶4;对于毛细血管扩张,则建议直接使用硬化剂液体。注射治疗后需行局部偏心压迫并穿戴弹力袜,可显著提高对下肢毛细血管扩张的治疗效果,有效避免过多的残留血栓、血栓性静脉炎和皮肤色素沉着[34-35]。
(2)激光治疗。激光治疗已被广泛应用于血管疾病的治疗中[36-39],作用原理是基于“选择性光热作用理论”——特定波长的光被血液中的氧合血红蛋白吸收后转化为热能,热能传导至血管壁造成血管内皮细胞肿胀,血管痉挛收缩,继而发生缺氧,血管内皮萎缩、凝固、坏死,最终扩张的毛细血管消失。目前,激光治疗主要推荐用于直径较小(通常认为<1 mm)或经硬化剂治疗后仍有残留的扩张毛细血管。
5.5.4 静脉性溃疡
目前,对于C6级病变,先处理活动性溃疡,还是先处理曲张静脉存在较大争议。本共识推荐,在溃疡合并感染时,应首先控制感染,当感染控制后应优先处理曲张静脉相关病变,而不必等溃疡完全愈合后再行手术。对于静脉性溃疡本身而言,病变静脉尤其是存在反流的交通静脉,是制约溃疡愈合的直接因素;对病变静脉的有效处理可有效促进溃疡愈合。
各医院应依据下肢浅静脉曲张患者的具体情况及自身条件合理选择是否行手术治疗。非手术治疗是手术治疗的有效补充,可贯穿于静脉曲张的整个治疗全程。目前,大隐静脉高位结扎+剥脱术仍是国内治疗下肢浅静脉曲张的重要手术方法。近年来,微创治疗的理念已被业界广泛认可,且微创治疗与大隐静脉高位结扎+剥脱术治疗的疗效相当。治疗下肢浅静脉曲张的微创手段很多,每种手段都有其相应的适应证,并没有哪一种方式能适用于所有患者。根据患者诉求结合病情及经济状况,选择“123的治疗方案”,即在腔内热消融治疗、点式剥脱术、泡沫硬化剂治疗3种治疗方式中,个体化合理选择1种、2种或3种方式,力求获得更微创、更美观、更彻底的治疗。
6 下肢浅静脉曲张的术后处理
6.1 术后压力治疗
下肢浅静脉曲张术后的压力治疗是外科手术治疗后的重要辅助措施,有效的压力支持治疗可起到有效止血、强化闭合效果、促进下肢静脉回流、预防下肢DVT等重要作用。为了达到术后有效压迫的目的,术后压力治疗开始的时间宜尽早。
(1)本共识推荐在行开放手术或热消融手术后,使用弹力绷带(或弹力袜+弹力绷带)进行有效压力支持24 h后,可拆除弹力绷带,以穿戴弹力袜的方式继续行压力支持治疗至少1个月;在术后最初的1周内,建议患者坚持24 h穿戴弹力袜,1周后可调整为白天穿戴,夜间可以脱下。
(2)在对C2级以下的下肢浅静脉曲张进行单纯硬化剂治疗时,本共识推荐在硬化剂注射完成后即刻开始行偏心性压迫,使用弹力袜进行持续压力支持,建议持续时间为至少1周,之后坚持白天或活动时穿戴并持续至少1个月。
(3)由于压力治疗的效果可靠,建议对于所有下肢浅静脉曲张患者,尤其是对于同时合并下肢深静脉瓣膜功能不全的患者,无论是否接受手术治疗,均坚持长期穿戴弹力袜,进行连续有效的压力治疗。
6.2 术后药物治疗
下肢浅静脉曲张术后通常仅需少量应用VAD以改善静脉回流,减轻术后下肢肿胀不适。对于合并静脉血栓或血栓风险评分较高的患者,或在术中使用了热消融/化学消融经临床医师评估后认为深静脉血栓风险较高的患者,可适量使用抗凝药物。对于合并静脉炎或静脉性溃疡的患者,可视情况给予抗生素预防围手术期感染,但必须符合使用规范。
7 下肢浅静脉曲张围手术期并发症防治
除了术区出血、血肿、感染等围手术期并发症之外,一些与下肢浅静脉手术直接相关的特殊类型的并发症,也应当引起临床医师的足够重视,并做到积极有效的防治。
7.1 隐神经损伤
隐神经损伤应当以预防为主,尽量避免出现。术中操作时,小腿内侧隐神经分布区域应尽量减少机械性损伤及热损伤,治疗时推荐以泡沫硬化剂治疗作为首选方式,仅在该区域存在明显的曲张静脉团或明确的交通静脉时,再局部进行点状剥脱术,原则上禁止在该区域使用热消融治疗。一旦术后出现隐神经损伤的表现,可给予神经营养药物进行对症治疗。
7.2 下肢DVT
因腔内热消融和硬化剂注射本就可诱导治疗后的浅静脉血栓化,故治疗后浅静脉内形成的血栓无需特别处理,静脉曲张术后压力治疗及鼓励活动均是防治DVT的有效手段,但是,静脉曲张和手术却是DVT的好发因素,因此,住院期间可给予抗凝治疗,仅在患者存在其他血栓高危因素时延长抗凝时间。一旦出现DVT,可根据患者病情进行抗血栓规范化治疗。
8 下肢浅静脉曲张术后随访
对于下肢浅静脉曲张术后患者,短期随访除了需注意是否存在曲张静脉残留之外,还应注意是否存在术区疼痛、麻木等不适症状,是否存在沿静脉走行的条索状硬结及是否伴有压痛。这些不适症状或表现通常提示患者可能存在术后感染、隐神经损伤、浅静脉内血栓或硬化剂导致的浅静脉炎等。远期随访应观察患者是否存在下肢浅静脉曲张复发,以及记录患者压力治疗的坚持情况等。随访时间为术后1周、1个月、3个月、6个月和1年。
下肢浅静脉曲张的治疗是一个综合治疗和个体化治疗的过程,也是复杂的、需要长期关注的过程。本共识仍然存在不足之处,还需要长时间临床实践的检验,需要进一步的深入研究提供更加充分的证据。因此,本共识作为广大医务人员的参考工具,希望能够为临床工作提供参考与指导,同时希望提出宝贵的意见和建议,力求使下肢浅静脉曲张的治疗更趋完美,从而促进中国下肢浅静脉曲张诊治的规范化推广。
主要执笔人
梅家才(上海交通大学附属第六人民医院)、郑月宏(中国医学科学院北京协和医学院北京协和医院)
参与本共识讨论、审校的专家(排名不分先后)
梅家才(上海交通大学附属第六人民医院)、郑月宏(中国医学科学院北京协和医学院北京协和医院)、职康康(海军军医大学第二附属医院)、王晓天(中国科学技术大学附属第一医院)、崔佳森(复旦大学附属华东医院)、赵海光(山东大学齐鲁医院)、张望德(首都医科大学附属北京朝阳医院)、陈泉(甘肃省人民医院)、党永康(内蒙古赤峰市医院)、郝迎学(陆军军医大学第一附属医院)、蒋鹏(北京积水潭医院)、李光新(山东省千佛山医院)、李鲁滨(烟台毓璜顶医院)、禄韶英(西安交通大学附属第一医院)、刘小平(解放军总医院)、刘丽(黑龙江远东心脑血管医院)、孟路阳(杭州市第三人民医院)、牟德堂(山东省寿光市人民医院)、毛由军(江苏省常州市第二人民医院)、彭军路(河北医科大学第一附属医院)、潘力生(安徽省安庆市立医院)、潘乐(肇庆市第一人民医院)、潘烨(上海交通大学附属第六人民医院)、普布次仁(西藏自治区人民医院)、秦露(湖北荆州市中心医院)、亓明(大连大学附属第一医院)、任补元(内蒙古自治区人民医院)、孙芳国(山东省章丘国博医院)、王雅(河南省南阳市中心医院)、王永高(浙江省中医院)、王贵明(山西医科大学第一医院)、吴梦涛(山东大学第二医院)、夏印(福建省人民医院)、叶炜(中国医学科学院北京协和医学院北京协和医院)、张磊(河北医科大学附属第一医院)、朱国献(深圳市第二人民医院)、种振岳(山东省立医院)、张章(空军军医大学唐都医院)、张显岚(广西桂林医学院附属医院)、黄建忠(广州妇女儿童医院)、蒋劲松(浙江省人民医院)、金辉(深圳大学总医院)、李春民(首都医科大学附属北京朝阳医院)、李昭辉(四川省宜宾市第一人民医院)、刘建林(西安交通大学第一附属医院)、梅志军(海军军医大学附属长海医院)、马玉奎(四川大学华西医院)、孙建明(重庆医科大学附属第二医院)、田众一(复旦大学附属浦东医院)、杨世伟(陆军军医大学第一附属医院)、朱越锋(浙江大学医学院附属邵逸夫医院)、赵渝(重庆医科大学附属第一医院)
利益冲突所有作者均声明不存在利益冲突
