赭曲霉毒素A 的抗原设计及在免疫分析中的应用
2021-11-20张莹蕾潘艳华方书灿
张莹蕾,潘艳华,方书灿,王 冕,李 玲
(西华大学食品与生物工程学院,四川 成都 610039)
赭曲霉毒素是曲霉菌属和青霉菌属的某些菌种产生的二级代谢产物,共包含7 种结构类似的化合物[1]。在已经发现的真菌毒素中,根据其重要性和危害性排序,赭曲霉毒素仅次于黄曲霉毒素,是继黄曲霉毒素后又一个引起世界广泛关注的真菌毒素[2]。在赭曲霉毒素系列中,赭曲霉毒素A(Ochratoxin A,OTA)因其毒性最大,分布最广,含量最高,被认为是最重要和危害性最大的一种赭曲霉毒素[3]。OTA 广泛存在于谷物(玉米、小麦等)和其他植物性食品(橄榄、豆类、葡萄干、无花果、南瓜子等),饮品(啤酒、葡萄酒、咖啡等)和中药材(甘草等)中也有OTA 的存在[4]。由于OTA可以直接污染谷类、水果等农作物,人和动物通过摄入污染的植物性食物而吸收进入体内,同时也可因OTA 在动物体内的蓄积作用而通过摄入动物性食物进入人体内。研究表明OTA 不仅具有免疫毒性、肾毒性和肝毒性,并且还有致畸、致突变和致癌作用[5-9]。因此建立食品中OTA 的快速检测技术对加强食品安全风险控制,提高食品安全保障能力具有重要的意义。
目前报道的OTA 检测方法主要包括仪器检测方法和生物检测方法两大类。仪器检测主要是气相色谱、液相色谱和质谱[10-12],生物检测方法主要包括免疫分析法、酶抑制分析法、适配体探针等[13-15]。仪器检测一般具有灵敏度高、定量相对准确、一次能检测多个指标等优点,是国家标准采用的主要方法。但仪器检测也存在一些不足,比如:昂贵的仪器购置及维护费用、需要专业技术人员操作、样品处理繁琐、检测耗时长、不适用于现场检测和高通量检测等[16]。免疫检测方法可用于现场检测,同时具有检测速度快、检测成本低、能实现高通量检测等优点,能很好地弥补仪器检测方法的不足,与之形成互补。
免疫分析法是基于抗原和抗体特异性结合进行检测的一种技术,在食品安全检测领域具有广泛的应用。商品化的免疫试剂盒和免疫试纸条已被用于食品中农兽药、抗生素、生物毒素等有毒有害物质的残留检测。根据标记物的不同,常见的免疫分析方法可分为:放射免疫分析法[17]、荧光免疫分析法[18-19]、酶联免疫分析法[20-21]、化学发光免疫分析法[22-23]、胶体金免疫分析法[24-25]、磁珠免疫分析法[26-27]等。无论是哪种免疫分析方法,抗体都是最关键的试剂,抗体的性质通常决定分析方法的灵敏度和可靠性,而抗体性质的好坏又很大程度上取决于抗原设计的合理性。
目前文献报道的OTA 抗原都是直接以OTA分子本身作为半抗原(图1(a)),通过OTA 分子自带的羧基偶联载体蛋白得到完全抗原(图1(b)),Zhang 等[28]用DCC 活化OTA 分子偶联蛋白制备了OTA 的完全抗原和单克隆抗体,抗体的IC50为7.6 ng/g。孟辉等[29]EDC 活化OTA 分子偶联蛋白制备了OTA 的完全抗原和单克隆抗体,抗体的IC50为1.29 ng/mL。尽管这些抗体已经用于实际样品的检测,但是对于基质较复杂的样品则需要稀释较大倍数才能排除基质干扰;因此,需要更加灵敏的抗体,建立更加灵敏的酶联免疫分析方法。

图1 OTA 的结构式、文献报道的OTA 抗原设计和本文的抗原设计
1 材料与方法
1.1 材料与仪器
雌性Balb/c 小鼠由成都达硕实验动物有限公司提供;OTA 标准品购自青岛普瑞邦生物工程有限公司,二环己基碳二亚胺(DCC),N-羟基琥珀酰亚胺(NHS)购自天津希恩思;Freunds 完全佐剂和不完全佐剂,牛血清蛋白(BSA)和卵清蛋白(OVA)购自Sigma 公司;羊抗鼠IgG-HRP 购自武汉博士德生物工程有限公司;OTA 抗体由中国农业大学提供;其它化学试剂均为市售分析纯。UV1900 紫外可见分光光度计,日本岛津公司;Multiskan FC多功能酶标仪,美国Thermo Fisher 公司。
1.2 OTA 半抗原和完全抗原的制备
1.2.1 OTA 半抗原的合成
OTA 属于有机小分子生物毒素,只有反应原性,没有免疫原性,如果要作为免疫抗原必须与载体蛋白偶联。本文通过两步反应,增加了OTA 分子羧基碳链的个数,有利于免疫抗原中OTA 分子抗原表位的完全暴露,增加抗体的亲和力,其合成路线如图2 所示。
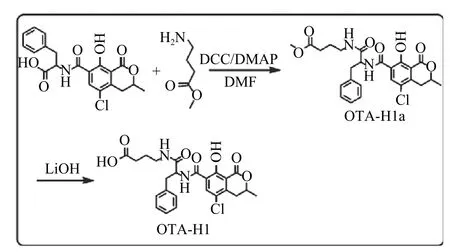
图2 OTA-H1 半抗原的合成路线
具体合成步骤如下:10.0 mg OTA(25 μmol)、5.8 mg 4-氨基丁酸甲酯(37.4 μmol)、15.5 mg DCC(75 μmol)和3.1 mg DMAP(25 μmol)溶 于2 mL DMF 中,室温搅拌反应3 h,用TLC 板监测反应,待OTA 反应完全后,将反应体系倒入10 mL 水中,用20 mL 乙酸乙酯萃取,收集有机相,有机相用1 mol/L HCl 洗涤3 次后用无水硫酸钠干燥2 h,浓缩有机相得OTA 半抗原中间体(OTA-H1a),该中间体不经任何表征直接用于下一步反应。用3 mL 甲醇溶解上步产物,加入等体积的1 mol/L LiOH 水溶液,室温搅拌反应1 h,用TLC 板监测反应,待反应完全后,用1 mol/L HCl 小心调节反应体系pH 至中性,将反应体系倒入10 mL 水中,用20 mL 乙酸乙酯萃取,收集有机相,有机相水洗3 次后用无水硫酸钠干燥2 h,浓缩后柱色谱纯化得到OTA 半抗原(OTA-H1)9.7 mg,两步反应总收率:80.2%。
1.2.2 OTA 完全抗原的合成
准确称取9.8 mg(20 μmol) OTA-H1 溶于0.6 mL DMF,加入6.2 mg DCC(30 μmol)和6.9 mg NHS(60 μmol),反应体系室温搅拌24 小时,出现白色沉淀(二环己基脲),离心后收集上清液,即为活化好的半抗原。准确称取20 mg BSA 和10 mg OVA 分别用于2 mL PBS(pH 7.4、0.1 mol/L)缓冲液溶解,室温条件下,准确吸取420 μL 上述活化好的半抗原,缓慢滴加到BSA 溶液中,边滴加边搅拌,滴加完毕,反应液4 ℃继续搅拌反应12 h。采用同样操作,将剩余的180 μL 活化好的半抗原偶联OVA。将上述偶联产物透析纯化后(透析液为pH 7.4,0.1 mol/L 的PBS 缓冲液,每次透析6 h,共透析6 次)分装并低温保存,即得到OTA 的完全抗原(OTA-H1-BSA,OTA-H1-OVA)。
B2C企业技术能力包括核心技术水平和技术创新能力两个方面。核心技术水平主要由信息技术水平和物流技术水平等构成。信息技术水平指B2C企业的网站系统建设、信息化水平的建设等;物流技术能力是指物流软技术,包括系统工程技术、价值工程技术、配送技术等。技术创新能力是引领市场需求、减少成本、增大企业市场规模的物质基础,B2C企业的信息技术和物流技术的学习创新在优化企业产品/服务组合、降低企业成本、提升企业主营业务的异质性、独特性方面发挥重要作用。
1.3 小鼠免疫试验
选择6 周大小的雌性Balb/c 小鼠,用完全抗原OTA-H1-BSA 免疫5 只小鼠,具体步骤为:将完全抗原OTA-H1-BSA 用PBS 缓冲液溶解稀释至1.0 mg/mL。第1 次免疫时取1.0 mL 完全抗原与1.0 mL 完全弗氏佐剂混合并充分乳化。每只小鼠腹腔注射0.1 mL 乳化好的完全抗原,背部多点注射0.1 mL。第2 次免疫时取1.0 mL 完全抗原与1.0 mL 不完全弗氏佐剂乳化,其他操作与第1 次相同,第3 次免疫时与第2 次完全相同。每次免疫的间隔期为2 周,第3 次免疫1 周后用毛细管从小鼠眼角静脉窦处采血,用间接竞争酶联免疫分析法(ic-ELISA)检测血清的效价和抑制,效价定义为OD 值为1.0 时的抗血清的最大稀释倍数。间接竞争酶联免疫分析检测血清的具体操作如下所示。
1) 用包被缓冲液将包被抗原稀释成系列浓度,酶标板每孔加100 μL,37 ℃温育3 h,用PBST 洗板3 次后甩干。
2) 用样品稀释液将抗血清稀释成系列浓度。在每组包被抗原及抗血清浓度梯度棋盘组合下分别设置1 000 ng/mL OTA 标准品和样品稀释液空白对照孔,每孔50 μL,再加入50 μL 系列浓度梯度的抗血清,37 ℃温育30 min,用PBST 洗板3 次后甩干。
3) 每孔加入100 μL 用PBSTG 稀释的羊抗鼠IgG-HRP,37 ℃温育30 min,用PBST 洗板3 次后甩干。
4) 每孔加入100 μL OPD 底物溶液,37 ℃避光显色10~15 min 后,每孔加入50 μL 2 mol/L 的硫酸溶液终止反应,在492 nm 下测定吸光值。
1.4 间接竞争酶联免疫分析法的建立
间接竞争法用抗原包板,用棋盘滴定法优化包被抗原和抗体最佳浓度组合浓度。固定包被抗原稀释倍数为1 000、2 000、4 000、8 000 倍,抗体稀释倍数为1 000、2 000、4 000、8 000 倍,每一个浓度组合包含一个空白孔(不加标样)和一个抑制孔(加标样)。选取最佳浓度组合必须同时考虑空白孔的吸光度和对应的抑制孔的抑制率。一般空白孔的吸光度控制在0.8~1.0 较合适,在此前提下抑制率越高越好。确定最佳浓度组合后,在最佳浓度组合下做出工作曲线,计算工作曲线IC50,IC50越小,检测越灵敏,检测范围定义为IC20~IC80抑制浓度。
1.5 添加回收实验
从市场购买不同品种的小麦,按照国标方法[30]用HPLC 进行检测,选择不含OTA 的阴性样品用于添加回收实验。添加回收实验具体步骤如下:取5.0 g 的阴性小麦样品置于离心管中,加入不同浓度的OTA 标准品,加入25 mL 提取液(70%的甲醇水溶液),在多功能旋转混合器上振荡提取10 min 后过滤提取液,离心取上清液,上清液用样品稀释液稀释10 倍后用于分析。作为对照,取空白样品进行同样处理后用于分析。
2 结果与讨论
2.1 半抗原和完全抗原的结构表征与鉴定
本文采用核磁氢谱、核磁碳谱和高分辨质谱对半抗原OTA-H1 进行表征,结果表明半抗原结构正确。表征数据如下:1H NMR (400 MHz,CDCl3):δ 12.73 (s,1H),8.54 (dd,J=7.4,2.7 Hz,1H),8.29(d,J=1.4 Hz,1H),7.26 -7.08 (m,6H),6.37 (t,J=5.4 Hz,1H),4.76 (d,J=7.2 Hz,1H),4.68 (dd,J=5.8,2.3 Hz,1H),3.24 -3.04 (m,5H),2.77 (ddd,J=17.4,11.6,3.1 Hz,1H),2.16 (t,J=7.1 Hz,2H),1.70 -1.61 (m,2H),1.52 (d,J=6.3 Hz,3H).13C NMR(101 MHz,CDCl3):δ 176.56,170.86,169.73,169.70,162.93,159.00,157.60,140.95,140.92,138.82,136.57,129.33,128.66,127.08,123.16,120.49,110.11,75.92,55.67,38.97,38.41,32.25,31.50,29.70,24.46,20.68.HRMS calcd for C24H25ClN2O7:[M+H+]489.142 3,found 489.142 6。
OTA 完全抗原的表征结果如图3 和图4 所示,其中图3 为OTA-H1-BSA 的紫外-可见吸收光谱图,图4 为OTA-H1-OVA 的紫外-可见吸收光谱图。图3 中BSA 的特征吸收峰在278 nm 附近,对应的是蛋白中酪氨酸残基的吸收峰。OTA-H1 的特征吸收峰在380 nm 附近。作为BSA 和OTAH1 的偶联物,OTA-H1-BSA 同时在278 nm 附近和380 nm 附近出现吸收峰,这表明偶联物OTAH1-BSA 同时含有BSA 结构单元和OTA-H1 结构的单元,因此偶联成功。图4 中偶联物OTA-H1-OVA 也同样在279 nm 和380 nm 附近出现吸收峰,这表明偶联物OTA-H1-OVA 偶联成功,因此OTA 的完全抗原制备成功。
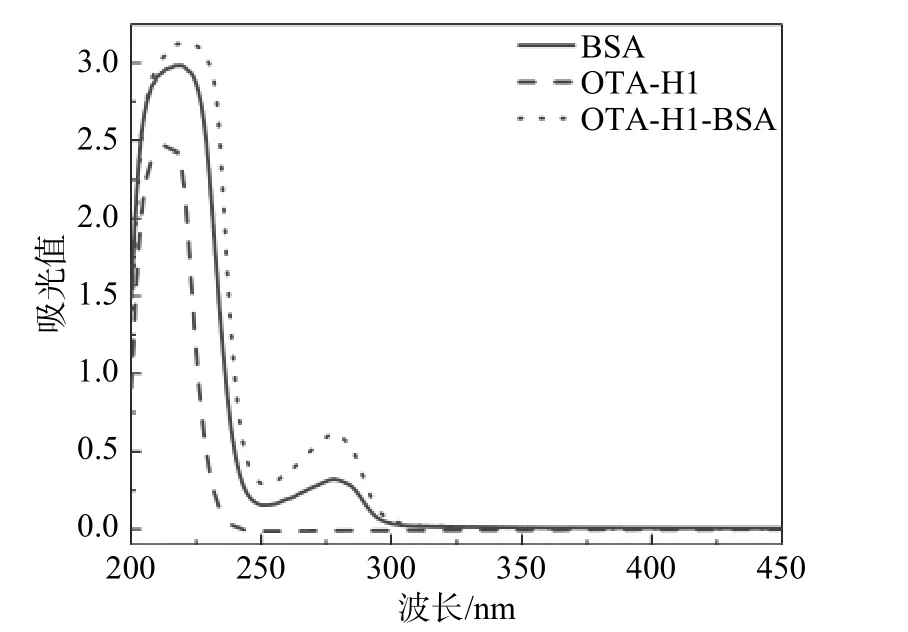
图3 OTA-H1、BSA、OTA-H1-BSA 的紫外吸收光谱图
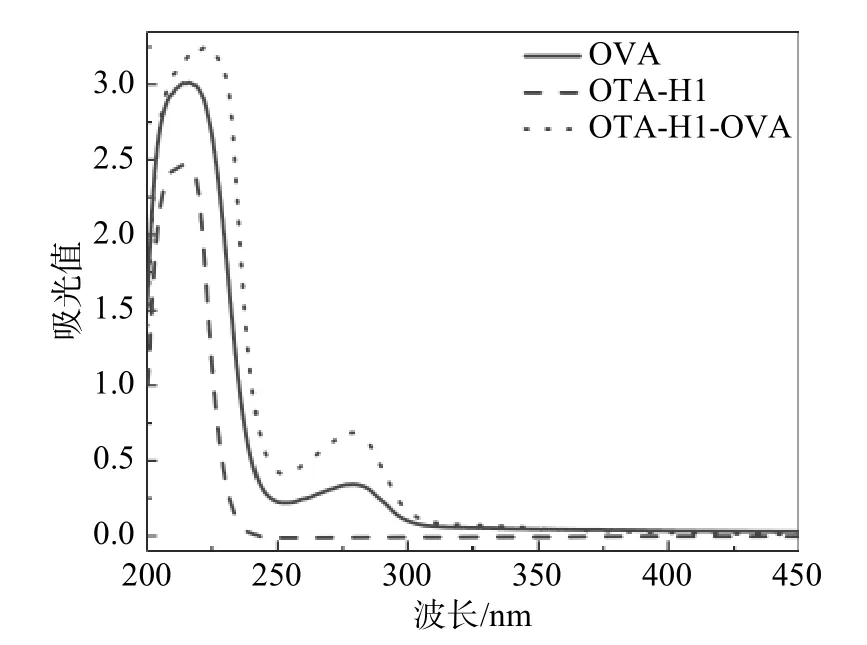
图4 OTA-H1、OVA、OTA-H1-OVA 的紫外吸收光谱图
2.2 小鼠血清效价及抑制的检测
免疫的5 只小鼠均有较高的效价与抑制,其中5 号小鼠的效价最高,抑制最好(见表1)。当小鼠血清稀释8 000 倍时,对照孔的吸光度仍然超过1.0,因此小鼠血清的效价超过8 000,并且对OTA有较好的抑制(包被抗原和血清都稀释8 000 倍时,抑制率为50%);因此,该小鼠可用于后面单克隆抗体的制备。
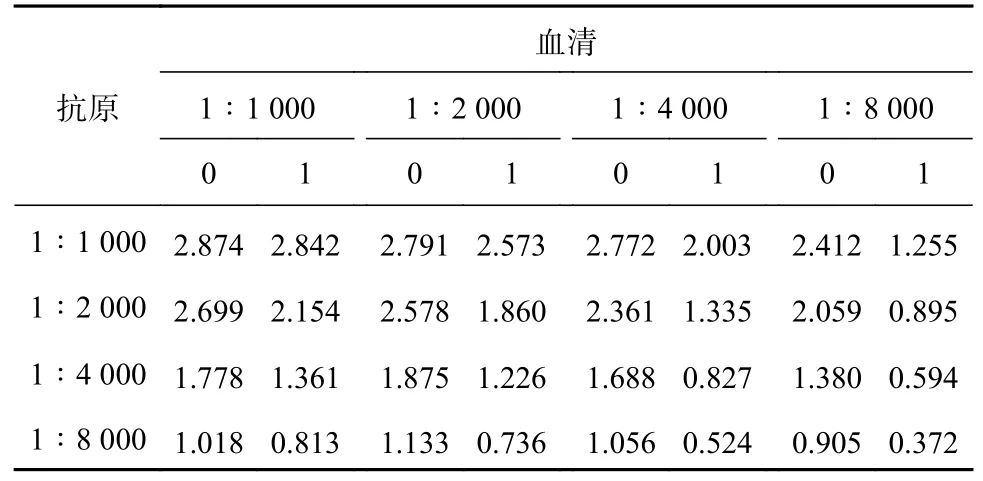
表1 赭曲霉毒素A 融合小鼠血清效价及抑制反应的检测
2.3 间接竞争酶联免疫分析法的建立
2.3.1 工作曲线的建立
综合考虑空白孔的吸光度和对应抑制孔的抑制率,选择抗体稀释4 000 倍,包被抗原为OTAH1-OVA 稀释8 000 倍,在此浓度组合下做出工作曲线如图5 所示,工作曲线IC50为0.04 ng/mL,比文献报道的灵敏度提高了30 倍[29],检测范围为0.01 ng~0.17 ng/mL(IC20~IC80抑制浓度)。
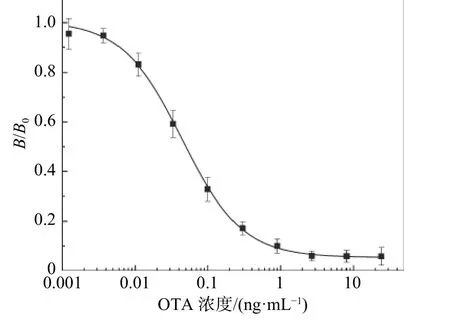
图5 赭曲霉毒素A 间接竞争酶联免疫法的标准曲线
2.3.2 添加回收实验
根据工作曲线的检测范围,在样品中分别添加3 个质量浓度(2.5、5.0、8 ng/mg)的OTA,每个质量浓度3 次平行,采用1.5 中的方法对样品进行前处理后用于分析,添加回收实验计算公式如下:

添加回收实验结果见表2,两种小麦样品的添加回收率范围分别为:86.7%~102.0%、85.8%~101.4%,变异系数分别为3.6%~5%、1.8%~4.7%,一般认为回收率在80%~120%之间为合理范围,因此本实验建立的ic-ELISA 方法具有较高的准确性和精密度,可用于小麦样品中OTA 的检测[30]。
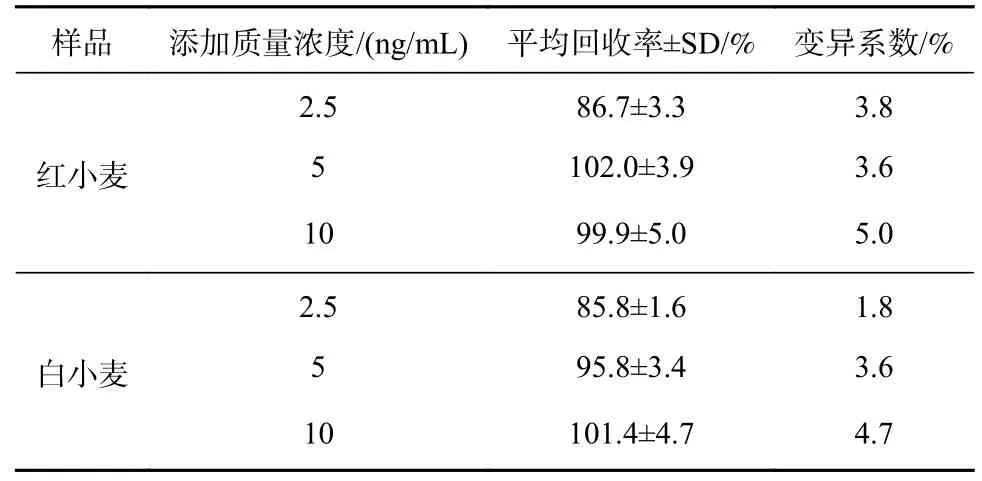
表2 红小麦、白小麦中OTA 的添加回收实验结果
3 结论
本研究设计合成了结构合理的新OTA 半抗原,增加了OTA 分子与载体蛋白之间的连接臂,有利于完全抗原中OTA 分子抗原表位的完全暴露,这样有助于提高抗体亲和力,得到高灵敏的OTA抗体。以完全抗原OTA-H1-BSA 作为免疫原免疫小鼠,小鼠的血清效价为8 000,并且对OTA 有一定的抑制,可用于进一步制备OTA 的单克隆抗体。以完全抗原OTA-H1-OVA 作为包被抗原,建立了OTA 的间接竞争酶联免疫分析法,该方法对OTA 的IC50为0.04 ng/mL,比文献[29]报道的OTA 检测灵敏度提高了30 倍。本文采用建立的方法对小麦样品做了添加回收试验,试验结果表明该方法具有较高的准确性和精密度,可以用实际样品的检测。
