富含γ-氨基丁酸豆酱制酱工艺优化及品质鉴定
2021-11-18李拂晓李冬龙郭燕王晖怡李秋凤刘继栋
李拂晓,李冬龙,郭燕,王晖怡,李秋凤,刘继栋,2*
(1.广西大学 轻工与食品工程学院,南宁 530004;2.广西大学广西蔗糖产业协同创新中心,南宁 530004)
豆酱是一类利用微生物代谢降解基质形成独特风味的调味酱,具有咸、鲜等滋味。豆酱生产分为制酱与制曲两大工艺步骤,其中制曲工艺由微生物代谢产生蛋白酶,制酱工艺通过长时间发酵将基质降解为氨基酸,同时促进风味物质的形成[1]。当前,豆酱发酵存在环境粗放、工艺可控性差等问题,难以满足功能性豆酱高品质、工艺稳定及规范化生产等要求。基于此,学者们在制酱工艺优化上进行了诸多研究,如通过恒温发酵[2]、复合发酵[3]、低盐发酵[4]等方式优化制酱工艺中生成的氨基酸、还原糖等常规性物质,但鲜有利用制酱工艺富集γ-氨基丁酸(γ-aminobutyric acid,GABA)开发功能性豆酱的研究报道。
GABA作为一种抑制性神经递质,已发现降血压[5]、抗抑郁[6]及改善睡眠[7]等诸多功能,并已列为新资源食品。前期研究表明,通过豆酱制曲工艺可富集少量GABA[8],但制酱后熟工艺周期较长,是蛋白质降解、累积游离氨基酸的主要阶段。其中,游离氨基酸与豆酱滋味、风味形成及GABA积累均显著相关[9-10],较大程度决定了豆酱品质。但在常规工艺生产中,豆酱的游离氨基酸含量易受环境差异影响[11],制酱过程中添加的过高盐含量盐水也会导致游离氨基酸含量上下波动[12],并且高盐饮食易诱发高血压、中风等疾病[13]。因此,为开发一款高品质功能性豆酱,本研究拟对制酱发酵工艺中发酵时间、制酱温度及盐水盐含量优化以实现GABA与氨基酸态氮在豆酱制品中的可控调节。使用二次回归正交旋转组合设计分析各因素及其交互作用对GABA与氨基酸态氮的影响并获得最优制酱发酵条件,实现豆酱中GABA的过量富集。同时,通过总酸含量、pH值、氨基酸态氮含量、GABA含量及色泽等多指标综合评价GABA豆酱的品质,为高品质豆酱的开发提供了借鉴。
1 材料和方法
1.1 材料与试剂
大豆、糙米、小麦粉(73.5%淀粉、11%蛋白质):购于广西南宁市冠超市;米曲霉孢子粉(Aspergillusoryzae3.042):上海佳民酿造食品有限公司;商业发酵酱样品:均购于市场。其中,厨邦黄豆酱(S1)、李锦记黄豆酱(S2)、李锦记辣豆酱(S3)、海天辣豆酱(S4)、海天黄豆酱(S5)、欣和黄豆酱(S6)、家庭自制黄豆酱(S7)、欣和甜面酱(S8)、嘉泰甜面酱(S9)及GABA豆酱(S10)。
氢氧化钠、蔗糖、氯化钠:均为国产分析纯;乙酸钠、浓盐酸(优级纯);γ-氨基丁酸标准品(纯度>99%)、邻苯二甲醛、β-巯基乙醇:上海麦克林生化科技有限公司;乙腈、甲醇(色谱纯):广东光华科技股份有限公司。
1.2 主要仪器与设备
Cenlee 16R高速冷冻离心机 湖南湘立科学仪器有限公司;安捷伦1100高效液相色谱仪 安捷伦科技有限公司;CM-3600d分光测色计 日本柯尼卡美能达公司;BMJ-160C霉菌培养箱 上海博迅实业有限公司;电热恒温鼓风干燥箱 上海精宏实验设备有限公司;STARTER 3100酸度计、PWN124ZH电子天平 奥豪斯仪器有限公司;KQ-500DB数控超声波清洗器 昆山市超声仪器有限公司。
1.3 方法
1.3.1 豆酱制曲、制酱工艺
使用前期研究条件制曲,将酱曲与不同盐浓度盐水按重量比例1∶1.1混合于发酵罐中,于霉菌培养箱中恒温发酵,每日进行一次翻酱,取样前对发酵酱充分混合。
1.3.2 豆酱中氨基酸态氮及总酸含量的测定
使用甲醛滴定法测定豆酱样品中的氨基酸态氮含量,操作参考国标GB/T 5009.40-2003《酱卫生标准的分析方法》。
1.3.3 样品中γ-氨基丁酸含量的测定
样品处理:称取豆酱样品2.5 g,充分研磨后使用蒸馏水定容至100 mL,取稀释样液2 mL,使用0.22 μm针式过滤器过滤至样品瓶中待测,测定条件同前期研究。
1.3.4 关键制酱条件单因素试验
按1.3.1制曲,发酵时间对豆酱品质的影响试验:盐水盐含量设置为15%,制酱温度设置为30 ℃,发酵时间设定为14,21,28,35,42 d;盐水盐含量对豆酱品质的影响试验:发酵时间设置为28 d,制酱温度设置为30 ℃,盐水盐含量为5%、10%、15%、20%、25%;制酱温度对豆酱品质的影响试验:发酵时间设置为28 d,盐水盐含量设置为15%,制酱温度设置为20,25,30,35,40 ℃。
1.3.5 二次回归正交旋转组合设计试验
在1.3.4单因素试验基础上确定因素水平编码范围,见表1。选取发酵时间、盐水盐含量、制酱温度3个因素,应用三因素二次回归正交旋转组合设计进行优化。

表1 因素水平编码表Table 1 The factors and levels
1.3.6 发酵酱色值的测定验
发酵酱色值通过分光测色计测定,使用ΔE、L*、a*及b*值表述,色值ΔE的计算公式为:
式中:ΔE代表色值,L*代表亮度,a*代表红绿差异,b*代表黄蓝差异。
1.3.7 发酵酱pH的测定
准确称取样品5 g,使用蒸馏水定容至100 mL,通过酸度计测定pH值,结果保留两位小数[14]。
1.4 数据统计分析
所有数据均为3次平行所得,使用SPSS 26.0和Origin 9.6.5对数据进行处理及显著性分析,使用Design Expert 10设计二次回归正交旋转组合设计试验,使用Illustrator 23.0.2软件制图。
2 结果与分析
2.1 单因素试验结果
发酵时间、盐水盐含量及制酱温度对发酵豆酱中氨基酸态氮与GABA含量的影响见图1。
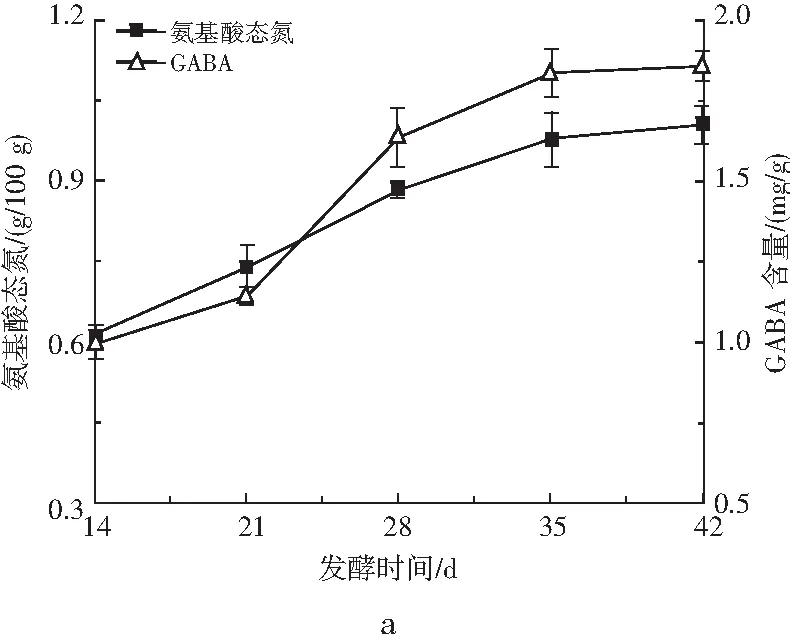


图1 发酵时间、盐水盐含量及制酱温度对豆酱氨基酸态氮及GABA含量的影响Fig.1 Effect of fermentation time, brine salt content and fermentation temperature on the amino acid nitrogen and GABA content of soybean paste
传统豆酱的开放式发酵工艺存在昼夜温差大且蛋白酶酶活较低等问题,导致生产周期较长及品质受季节性温度变化影响。研究表明,恒温发酵通常在发酵28 d左右即可达到国标要求的氨基酸态氮含量0.5 g/100 g以上[15]。本研究也证实随着发酵时间的延长,豆酱中的氨基酸态氮含量随时间增加而逐渐增加,并且在35 d之后上升速度减缓,仅从35 d的0.97 g/100 g增加至42 d的1.00 g/100 g ,见图1中a。可能是发酵前期因基质蛋白质丰富及微生物代谢活跃,使得氨基酸态氮含量快速上升。在35 d后,蛋白降解速度放缓,但由于氨基酸态氮在制酱过程中是逐步累积过程,因此表现为缓慢上升。同时,GABA含量与氨基酸态氮呈现出相似的前期快速上升,35 d后缓慢上升趋势(r=0.986)。故综合考虑后选择制酱时间35 d为优化试验的中心点。
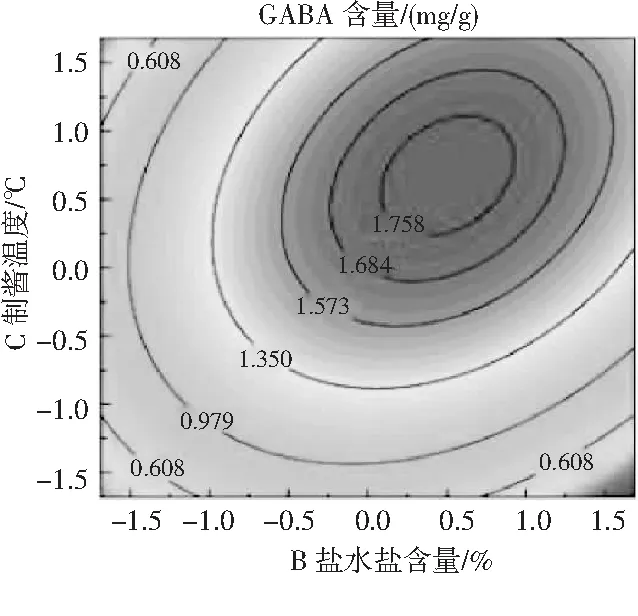
通常,在豆酱制酱过程中会添加大比例高浓度盐水以抑制杂菌生长,盐水盐含量的高低及与酱曲混配比例会较大程度影响豆酱的品质[16]。考察盐水盐含量对豆酱氨基酸态氮含量及富集GABA影响的研究结果表明,豆酱中的氨基酸态氮含量随着盐水盐含量增加呈现先上升后下降的趋势,在盐水盐含量为10%时,氨基酸态氮含量达到最大(0.82 g/100 g, P<0.01)。盐含量导致的氨基酸态氮差异可能为低盐环境下,微生物代谢较为旺盛,蛋白质降解形成的游离氨基酸被微生物用于机体生长。在高盐环境下,微生物代谢受到较大程度抑制,蛋白质降解缓慢进而导致氨基酸态氮含量较低[17]。此外,对GABA的观测发现其含量也呈现先上升后下降的趋势,与氨基酸态氮含量变化有一定的相似性(r=0.792),见图1中b。在盐水盐含量为10%时,GABA含量达到最大,为1.663 mg/g (P<0.01)。在综合考虑氨基酸态氮、GABA含量后,选择盐水盐含量10%为优化试验中心点。
传统发酵采用日晒夜露生产方式,制酱温度随昼夜更替变化。虽然有研究表明,变温发酵能提升风味物质的种类及丰度,但在连续化及工业化生产中,利用恒温发酵技术可使产品品质更加稳定可控。本研究发现,豆酱中的氨基酸态氮在试验范围内随着温度上升呈现先上升后下降的趋势,在制酱温度为35 ℃时氨基酸态氮达到最大值1.13 g/100 g (P<0.01)。温度导致的氨基酸态氮差异可能为较低,发酵温度时米曲霉降解蛋白质效率较低,导致氨基酸态氮含量较低,而在40 ℃发酵环境下,微生物的代谢及酶活受到一定抑制,导致蛋白质降解速度降低,进而使氨基酸态氮含量出现差异。GABA含量则与氨基酸态氮含量呈现相似的变化趋势(r=0.928),见图1中c,在35 ℃时达到最大值1.808 mg/g(P<0.01)。故综合考虑后选择35 ℃为优化试验中心点。
2.2 二次回归正交旋转组合设计试验结果
2.2.1 二次回归正交旋转组合设计试验结果
根据图1单因素试验结果,选取发酵时间(A)、盐水盐含量(B)及制酱温度(C)作为3个因素,以氨基酸态氮、GABA含量为响应值,试验方案及结果见表2。
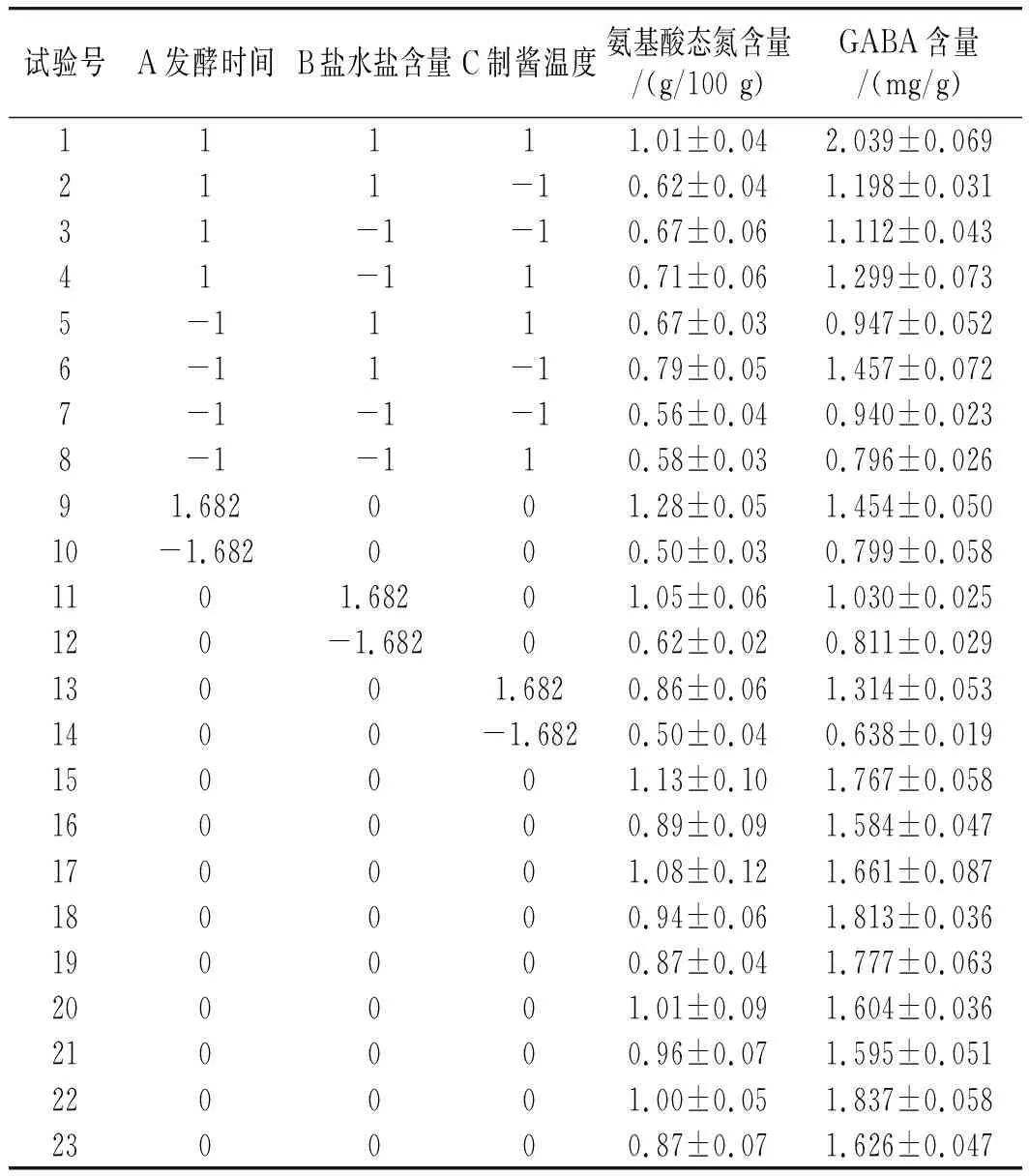
表2 二次回归正交旋转组合设计试验结果Table 2 Quadratic regression orthogonal rotation combination design and experimental results
2.2.2 以氨基酸态氮、GABA含量为指标的回归模型方差分析及交互作用的影响
对表2所得数据整理分析得表3,可拟合氨基酸态氮(Y1)与GABA含量(Y2)的二次回归方程为:
Y1=0.97+0.13A+0.10B+0.08C-0.01AB+0.04AC+0.06BC-0.05A2-0.07B2-0.12C2;
Y2=1.690+0.191A+0.136B+0.206C+0.020AB+0.047AC+0.127BC-0.148A2-0.221B2-0.201C2。
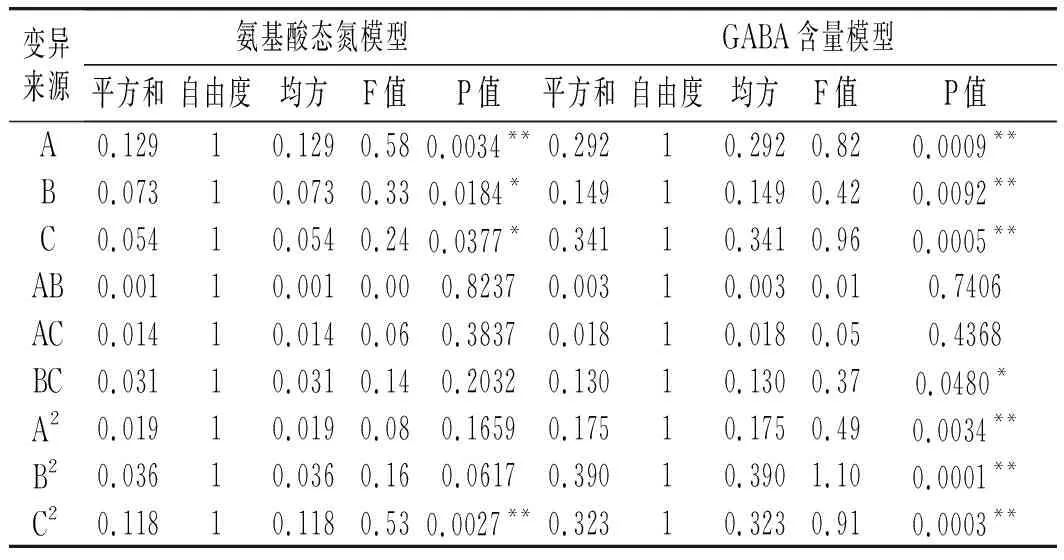
表3 以氨基酸态氮、GABA含量为评价指标的回归模型方差分析结果Table 3 Variance analysis results of regression model using amino acid nitrogen and GABA content as the evaluation indexes
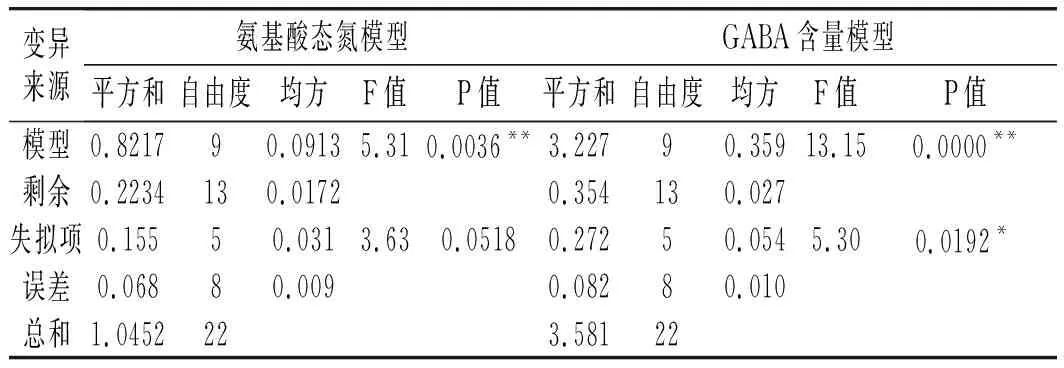
续 表
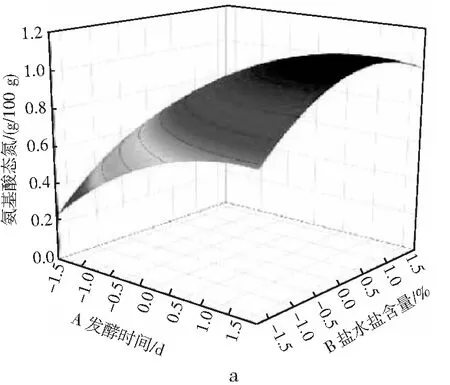
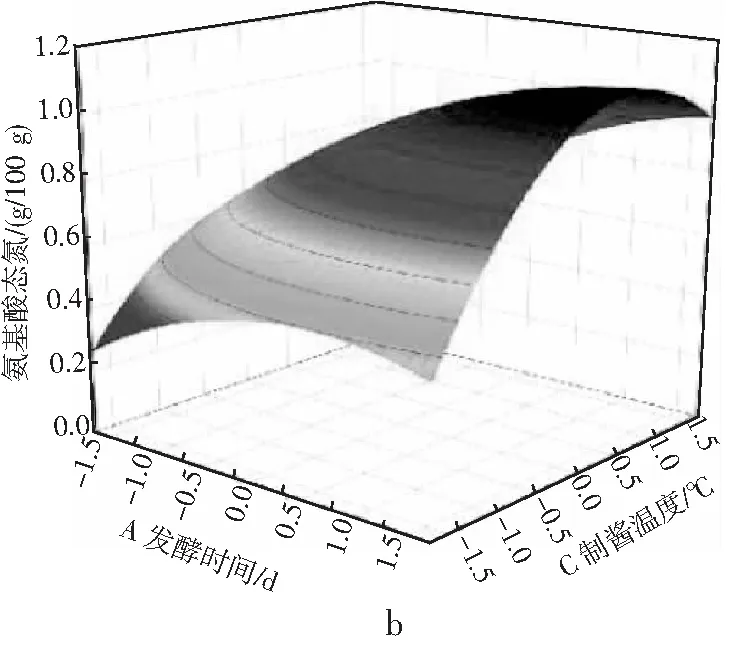
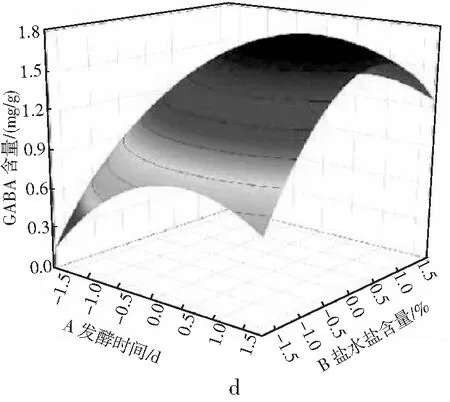
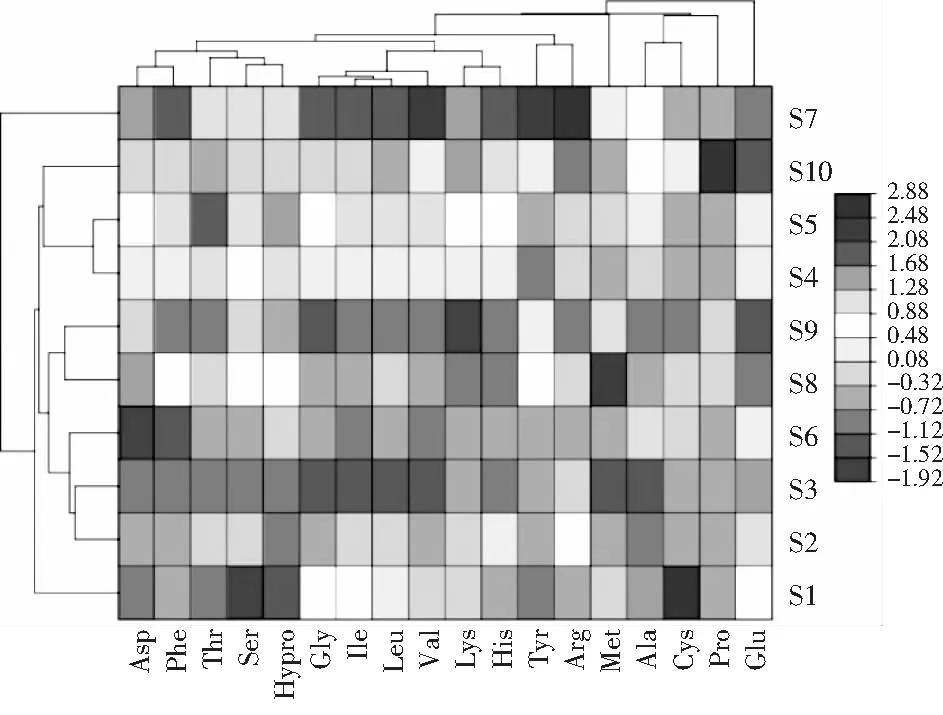
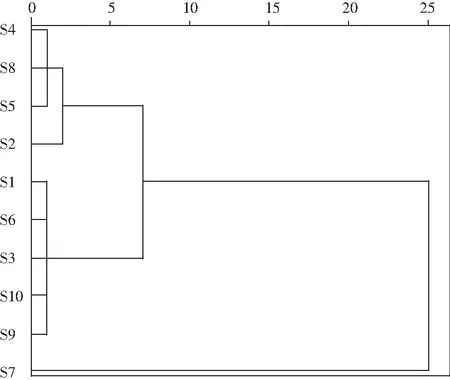
由表3可知,氨基酸态氮模型拟合十分显著(P<0.01),无显著失拟性因素(P=0.0518>0.05),方差分析结果显示,A与C2对回归方程的影响极显著(P<0.01),B与C对回归方程的影响显著(0.01 同理得GABA含量模型十分显著(P<0.01),但存在失拟性因素(P=0.0192>0.01),方差分析结果显示,A、B、C、A2、B2及C2对回归方程的影响极显著(P<0.01),BC对回归方程有显著影响(0.01 图2 发酵时间、盐水盐含量及制酱温度对豆酱中氨基酸态氮及GABA含量的影响Fig.2 Effects of fermentation time,brine salt content and fermentation temperature on amino acid nitrogen and GABA content of soybean paste 由图2中a可知,随着发酵时间的延长与盐水盐含量的增加,氨基酸态氮呈现先快速上升后略微下降的趋势,通过二维等高线图可知两因素交互作用较弱。由图2中b可知,随着发酵时间的延长,氨基酸态氮逐渐升至最高后出现略微下降,随着制酱温度的升高呈现先上升后下降的趋势,其二维等高线图呈椭圆形,可知两因素存在交互作用。由图2中c可知,随着盐水盐含量及制酱温度逐渐增大,氨基酸态氮含量均呈现先上升后下降的趋势,但其二维等高线图呈椭圆形,可知两因素间存在显著的交互作用。综合表3和图2可知,3个因素对氨基酸态氮的影响力依次为:发酵时间>盐水盐含量>制酱温度。 由图2中d可知,随着发酵时间的延长与盐水盐含量的升高,GABA含量均呈现先上升后下降的趋势,二维等高线图表明两因素间存在一定交互作用。由图2中e可知,随着发酵时间的延长和制酱温度的增加,GABA含量呈现先上升后下降的趋势,二维等高线图表明两因素间存在较弱的交互作用。由图2中f可知,随着盐水盐含量的增加与制酱温度的升高,GABA含量均呈现先上升后下降的趋势,且二维等高线图呈现椭圆形(交互项BC,P<0.05),可知两因素间存在显著的交互作用。综合图2和表3可知,3个因素对GABA含量的影响力依次为:制酱温度>发酵时间>盐水盐含量。 2.2.3 最佳工艺点验证性实验 根据氨基酸态氮与GABA回归模型分别可得出最优组合:发酵时间38 d、盐水盐含量18%及制酱温度38 ℃时,预测氨基酸态氮含量为1.157 g/100 g,GABA含量为1.775 mg/g。以GABA含量模型可得出:发酵时间34 d、盐水盐含量17%及制酱温度37 ℃时,预测氨基酸态氮含量为1.117 g/100 g,GABA含量为1.888 mg/g。两个回归模型的最佳预测条件较为接近,与单因素试验中GABA含量与氨基酸态氮含量呈现相似变化趋势相吻合。 综合考虑实际操作后,选择发酵时间35 d、盐水盐含量17%及制酱温度37 ℃为优选条件,此时,模型预测氨基酸态氮含量为1.136 g/100 g,GABA含量为1.876 mg/g。验证性试验得氨基酸态氮含量为(1.126±0.048) g/100 g,GABA含量为(1.868±0.093) mg/g。验证结果与回归模型预测值基本一致,显著高于Xu等[18]在豆酱成品中测得的0.260~1.130 mg/g,证明通过制曲、制酱工艺优化可有效提升豆酱中的GABA含量[19]。 2.3.1 不同发酵酱的游离氨基酸组成 发酵酱中的游离氨基酸主要由酶催化蛋白质降解产生,与各项品质指标均存在相关性,是评价发酵酱品质的重要指标[20]。游离氨基酸作为重要的呈味物质,如天冬氨酸及谷氨酸等是发酵酱中主要的鲜味来源,根据呈现的味道大致可将表4中的18种氨基酸分为鲜味、甜味、苦味和不呈味氨基酸。此外,游离氨基酸还会参与色泽及风味的形成,因此,探明发酵酱的游离氨基酸组成对评价鉴定发酵酱品质具有重要意义。 表4 10种发酵酱样品的游离氨基酸含量Table 4 The content of free amino acids of ten kinds of fermented soybean paste samples mg/g 因发酵酱生产工艺及原料差异,不同样品的游离氨基酸组成有一定差异(见表4)。10种发酵酱的游离氨基酸总量由高到低依次为:S2>S5>S3>S4>S1>S10>S7>S6>S8>S9,其中S2的游离氨基酸总量最高为13.55 mg/g,与S5差异较小(P>0.05),与其余8个样品的差异明显(P<0.01)。S10作为优化后的GABA豆酱,其游离氨基酸总含量较高,达11.70 mg/g,与样品S4、S1和S7相比无显著性差异(P=0.73>0.05),显著高于S6、S8及S9(P<0.01)。谷氨酸及天冬氨酸作为发酵酱中主要的呈鲜氨基酸,S1~S6 6种商业豆酱中的鲜味氨基酸总百分比显著高于其余样品(P<0.01),可能是因为商业豆酱呈现更加浓郁的鲜味,在后期调配加入谷氨酸钠调味导致。S7除甲硫氨酸、丙氨酸、半胱氨酸、脯氨酸及谷氨酸外,其余13种氨基酸含量均较高(见图3),可能因S7发酵周期较长(12个月),蛋白质降解较充分导致。此外,在S7和S10中存在较高含量的第一限制性必需氨基酸赖氨酸(见表4和图3),两者的必需氨基酸总量也分别达到4.38 mg/g (37.46%)和2.96 mg/g (25.31%),在10个样品中处于较高水平。同时,S10中可作为豆酱主要评价指标的脯氨酸也显著高于其余样品,达4.42 mg/g (P<0.01)。综上,S10作为快速发酵产品,已有较高的游离氨基酸含量呈现较好品质。 图3 不同发酵酱的18种游离氨基酸热力图Fig.3 Thermogram of 18 free amino acids in different fermented soybean paste 2.3.2 不同发酵酱的游离氨基酸主成分分析 以18种游离氨基酸含量构成10×18矩阵进行主成分分析,得到各主成分的特征值、方差贡献率及累计贡献率。根据主成分分析法提取累计贡献率≥80%主成分的原则,共提取出5个主成分(见图4)。其中,前5个主成分的特征值均大于1,累计方差贡献率为96.394%,包含10个发酵酱氨基酸含量的大部分信息,能有效代替18种游离氨基酸对发酵酱品质进行评价。 图4 不同发酵酱第1,2主成分因子得分图及载荷图Fig.4 The scoring diagram and loading diagram of the first and second principal component factors of different fermented soybean paste 2.3.3 不同发酵酱的游离氨基酸的综合评价及聚类分析 由主成分分析可知,使用前5个主成分可以有效解释游离氨基酸含量与品质的关系,因此综合得分公式为:F=0.526PC1+0.173PC2+0.118PC3+0.085PC4+0.062PC5。10个样品以综合得分大小对样品进行排序,依次为:S7>S5>S8>S4>S2>S9>S10>S3>S6>S1。结合图3可知,S7因未添加谷氨酸钠调味导致谷氨酸含量及总游离氨基酸含量均小于部分商业化产品,但发酵周期较长,使多数氨基酸含量均相对较高,因此在主成分评价体系中得分最高。而S5的各类氨基酸含量也相对均衡,在综合得分中排名第二。S10作为快速发酵产品,基质的降解程度较低,使游离氨基酸含量偏低,但在综合评价中仍为中等水平(见表5)。 表5 因子综合得分表Table 5 The comprehensive scoring table of factors 对10种发酵酱的综合得分进行聚类分析,由图5可知,S7因多种游离氨基酸含量较高,获得了较高的综合得分单独成类。S2、S4、S5及S8则归为第二大类,S10、S1、S3、S6及S9归为第三大类,其中S10的综合得分已优于部分商业发酵酱(见表5)。综上,经优化后的发酵酱S10样品,通过快速发酵虽品质不及长周期发酵样品S7,但品质已接近甚至优于部分商业发酵酱。 图5 10种发酵酱的游离氨基酸综合得分聚类图Fig.5 The cluster diagram of comprehensive scores of free amino acids of 10 fermented soybean paste 通过试验建立发酵时间、盐水盐含量制酱温度3种影响因素对豆酱中氨基酸态氮含量及GABA含量的相互作用模型,得出在发酵时间35 d、盐水盐含量17%及制酱温度37 ℃的条件下,氨基酸态氮含量为(1.126±0.048) g/100 g,GABA含量为(1.868±0.093) mg/g,与回归模型预测值基本一致。研究结果表明,本研究中所制得的GABA豆酱具有高氨基酸态氮、GABA含量等特点,相比市售产品分别提高了28%~103%与46%~244%。综上,通过本试验优化后,可有效提升豆酱中的氨基酸态氮及GABA含量,提供了一种稳定生产高品质GABA豆酱的规范化方法。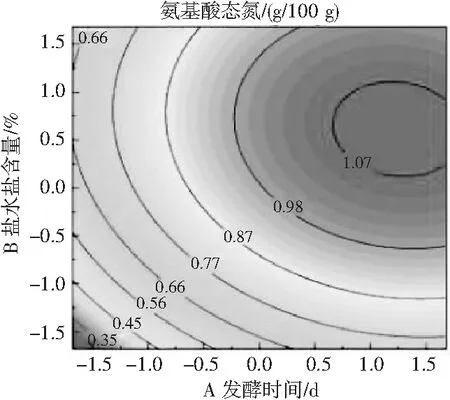







2.3 GABA豆酱与市售发酵酱的游离氨基酸组成对比




3 结论
