曼尼希碱缓蚀剂的组成和缓蚀性能相关性的量子化学研究
2021-11-18董笑程杨敬一司英伟徐心茹
董笑程,杨敬一,司英伟,徐心茹
(华东理工大学化工学院,绿色能源化工国际联合研究中心,上海 200237)
随着原油趋于劣质化及石油天然气开采中酸化技术的应用,在含硫含酸原油的集输、加工及酸化开采过程中引起管道和设备严重腐蚀。采用咪唑啉类及曼尼希碱类等缓蚀剂是抑制金属材料腐蚀的重要方法[1]。
近年来为了研发新型高效缓蚀剂,采用量子化学法对缓蚀剂分子结构与缓蚀性能相关性进行的研究受到广泛关注。Ayowole等[2]以3-甲基苯酚、哌嗪和甲醛为原料合成了一种曼尼希碱缓蚀剂,采用密度泛函理论计算了该缓蚀剂分子前线轨道分布,并对其在0.2 mol/L硫酸溶液中对碳钢的缓蚀性能与分子结构的关系进行了研究。Jeeva等[3]以烟酰胺为原料合成了3种曼尼希碱衍生物缓蚀剂,计算了3种缓蚀剂分子的前线轨道能隙(ΔE)、偶极矩(μ)、全局硬度(H)和软度(σ),结果表明缓蚀剂在1.0 mol/L盐酸溶液中对碳钢的缓蚀性能与计算的量子化学参数与缓蚀率有良好的关联性。Lashkari等[4]优化了8种吡啶衍生物分子构型结构,计算了电子转移数(ΔN)、溶剂化自由能(ΔG)、化学势(Φ)等量子化学参数,结果表明,吡啶衍生物在盐酸中对Fe和Al的缓蚀率与其量子化学参数的线性决定系数R2为0.717~0.962。胡松青等[5]对4种咪唑啉衍生物在CO2饱和的3%NaCl溶液中对Q235A钢片的缓蚀性能进行了研究,采用在量子化学计算和分子动力学模拟结合的方法分析了咪唑啉衍生物的缓蚀机理,结果表明,咪唑啉衍生物的缓蚀率与其量子化学参数最高占据轨道能级(EHOMO)、最低未占轨道能级(ELUMO)和ΔE的线性决定系数R2为0.412~0.967。鞠虹等[6]对2种嘧啶衍生物的EHOMO,ELUMO,ΔE,μ,ΔN等量子化学参数进行了计算,比较了嘧啶衍生物在0.5 mol/L硫酸中对Austgenitic不锈钢的缓蚀率与其量子化学参数的关系。王太杨等[7]采用量子化学和分子动力学方法对3种有机磷酸分子及其与阳离子改性的β-环糊精形成的包合物作为缓蚀剂进行了研究,并在0.1 mol/L硫酸中对Q235钢的缓蚀性能进行了试验验证。
综上,量子化学计算能够在试验的基础上进一步探讨缓蚀剂分子微观构效关系,因此在缓蚀剂研究中得到广泛应用。曼尼希碱具有结构稳定、毒性较低及溶解分散性好的特点,为进一步提升曼尼希碱类缓蚀剂的性能及研究缓蚀机理,本研究合成8种曼尼希碱缓蚀剂,研究在酸性介质中曼尼希碱缓蚀剂对N80试片的缓蚀作用,并采用量子化学泛函密度理论探讨对合成的曼尼希碱缓蚀剂分子结构和缓蚀性能的关系。
1 研究方法
1.1 试 剂
苯甲胺、环己胺和无水乙醇,分析纯,购于上海泰坦股份有限公司;正己胺和苯乙酮,分析纯,购于上海阿拉丁生化科技股份有限公司;丙酮,分析纯,购于国药集团化学试剂有限公司;环己基甲酮,分析纯,购于上海迈瑞尔化学技术有限公司;甲醛,化学纯,购于上海泰坦股份有限公司;盐酸,化学纯,购于国药集团化学试剂有限公司。
1.2 曼尼希碱缓蚀剂的合成
以正己胺、苯甲胺和环己胺 3种胺为原料,分别与苯乙酮和甲醛反应合成单曼尼希碱。在四口烧瓶中加入一定量胺后,加入适量无水乙醇作溶剂,并用盐酸将pH调至2,搅拌条件下升温至90 ℃,然后按照胺、苯乙酮、甲醛的摩尔比为1∶1.2∶1.2加入苯乙酮和甲醛,反应8 h。反应结束后用旋转蒸发仪对产物进行提纯,得到单曼尼希碱。分别以正己胺、苯甲胺、环己胺为胺原料得到的3种单曼尼希碱依次记作BK1,BK2,BK3,此3种单曼尼希碱统称为BK组缓蚀剂。
在与BK组缓蚀剂合成条件相同的条件下,分别将正己胺、苯甲胺和环己胺与丙酮和甲醛反应,得到另外3种单曼尼希碱,依次记作PA1,PA2,PA3,此3种单曼尼希碱统称为PA组缓蚀剂。
称取一定质量的BK2加入反应烧瓶中,加入适量无水乙醇作溶剂,并用盐酸将pH调至2,搅拌升温至90 ℃后按照BK2、丙酮、甲醛摩尔比为1∶1.2∶1.2加入丙酮与甲醛,反应8 h。然后用旋转蒸发仪对产物进行提纯,得到双曼尼希碱D1。在与D1合成条件的相同条件下将PA1与环己基甲酮和甲醛反应,合成得到双曼尼希碱D2。D1、D2统称为D组缓蚀剂。
1.3 曼尼希碱缓蚀剂缓蚀效果的测定
使用静态失重法测定曼尼希碱的缓蚀效果。首先用350号金相砂纸对N80钢片进行打磨处理,然后在腐蚀温度为90 ℃、腐蚀时间为4 h、盐酸质量分数为20%的条件下测定曼尼希碱缓蚀剂的缓蚀性能,按式(1)和式(2)计算N80钢片腐蚀速率和曼尼希碱的缓蚀率。

(1)
(2)
式中:v为添加曼尼希碱缓蚀剂时钢片的腐蚀速率,g/(m2·h);w0、w分别为腐蚀前和腐蚀后N80试片的质量,g;S为试片面积,m2;t为腐蚀时间,h;η为缓蚀率,%;v0为未添加缓蚀剂时钢片的腐蚀速率,g/(m2·h)。
1.4 曼尼希碱缓蚀剂的量子化学计算方法
曼尼希碱分子几何构型优化:采用量子化学计算软件GaussView构建分子初始结构,通过Gaussian 09软件中ωB97X-D泛函[8]在cc-pVDZ基组[9]水平上对曼尼希碱分子进行结构优化,得到曼尼希碱分子的最优化结构,采用严格收敛条件确保优化后的结构振动分析无虚频,使得优化后结构处于势能面上极小点。通过对缓蚀剂DMN分子键长和键角的分析,确定优化过程的合理性。
前线轨道分布计算:在曼尼希碱分子优化结构的基础上,采用波函数分析软件Mutiwfn[10],结合量子化学可视化程序VMD[11]生成等值面数值为0.05 a.u.的等值面图,以确定缓蚀剂分子最高占据轨道HOMO以及最低未占轨道LUMO的离域分布。
缓蚀剂量子化学参数计算:采用量子化学计算软件Gaussian 09中ωB97X-D泛函在cc-pVDZ基组水平上计算曼尼希碱分子的EHOMO,ELUMO,ΔE和范德华表面负静电势面积(AS-),在含弥散函数的aug-cc-pVDZ[12]基组水平上计算曼尼希碱分子的μ和分子极化率(α)等量子化学参数。
1.5 关联度分析方法
采用灰色关联度分析法[13]计算结果衡量量子化学参数对缓蚀率的影响程度[14],首先指定各缓蚀剂的缓蚀率为参考数列,各缓蚀剂的量子化学参数为对比数列,然后使用归一化法对参考数列和对比数列进行无量纲处理,计算灰色系数ξi(k),然后取分辨系数为0.5,求得关联度系数r。
2 结果与讨论
2.1 缓蚀剂分子构型优化及量子化学参数计算
2.1.1 曼尼希碱缓蚀剂的分子结构图1所示为BK组、PA组和D组所有曼尼希碱缓蚀剂通用分子结构示意,它们的详细分子结构构成见表1。其中:BK1,BK2,BK3的R1分别为正己基、苯甲基和环己基,R2为苯甲酰基;PA1,PA2,PA3的R1分别为正己基、苯甲基和环己基,R2为乙酰基;BK组和PA组的R3均为氢基。D1的R1为苯甲基,R2为苯甲酰基;D2的R1为正己基,R2为环己酰基;D组的R3均为两个亚甲基连接的乙酰基。
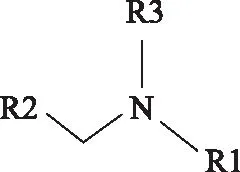
图1 曼尼希碱缓蚀剂通用分子结构示意
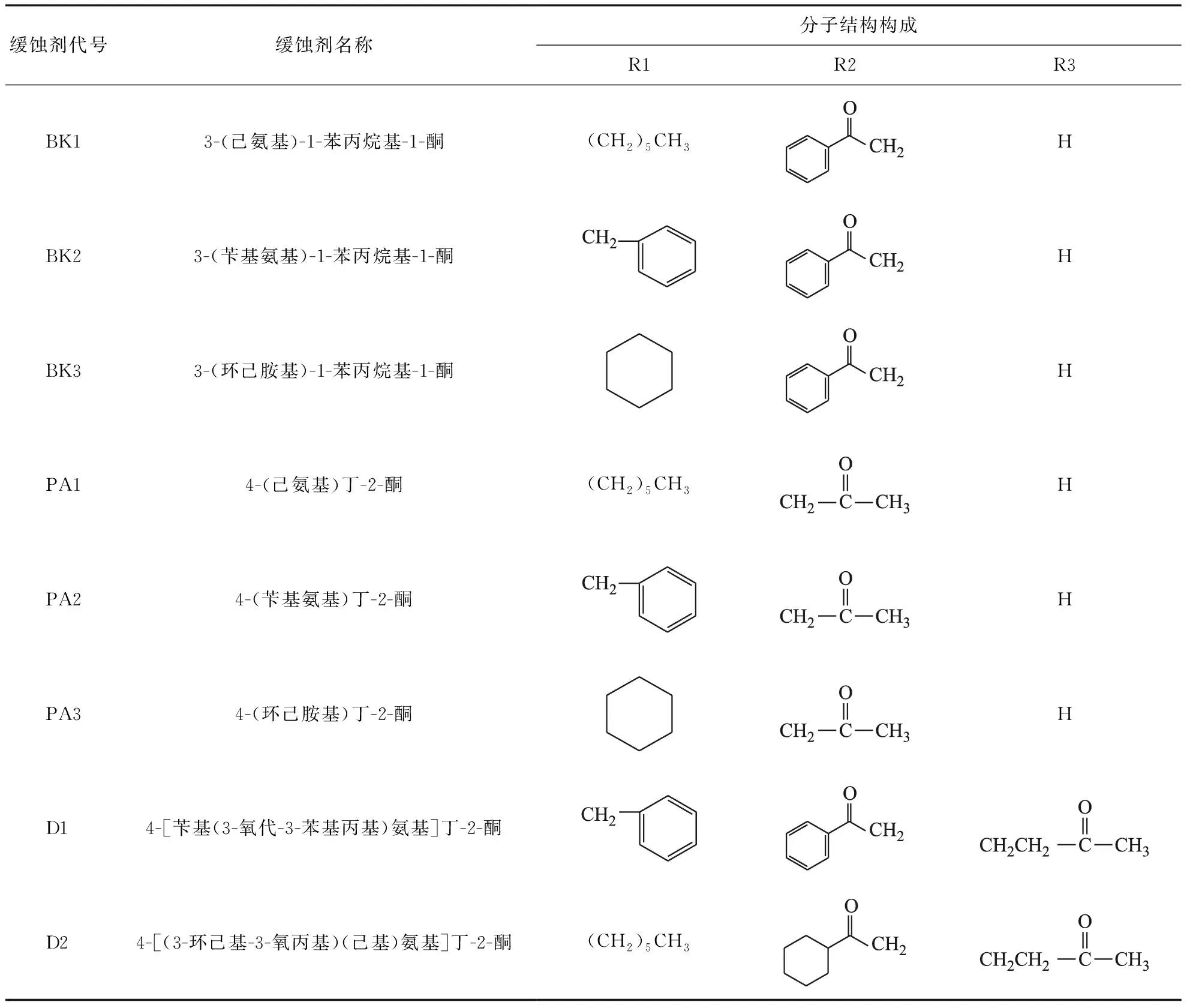
表1 8种曼尼希碱缓蚀剂的分子结构


图2 缓蚀剂分子优化后的几何构型

图3 缓蚀剂分子的原子标号
2.1.3 缓蚀剂分子量子化学参数计算及灰色关联度分析在曼尼希碱缓蚀剂分子结构优化的基础上计算量子化学参数EHOMO,ELUMO,ΔE,μ,α,AS-,以探究缓蚀剂分子量子化学参数与缓蚀效果的关系,结果如表2所示。

表2 8种缓蚀剂的缓蚀率和量子化学参数
在质量分数20%的盐酸溶液中加入质量分数0.5%的缓蚀剂,在90 ℃和4 h条件下测定了N80试片的腐蚀速率,计算各缓蚀剂对试片的缓蚀率,结果列于表2。由表2可以看出,在不加缓蚀剂的条件下N80钢片的腐蚀速率为1 602.3 g/(m2·h),加入BK1,BK2,BK3时试片的腐蚀速率分别为16.7,12.4,35.2 g/(m2·h),缓蚀率分别为98.9%,99.2%,97.8%;加入PA1,PA2,PA3时试片的腐蚀速率分别为452.1,351.6,432.5 g/(m2·h),缓蚀率分别为71.7%,78.1%,73.0%;加入D1和D2时的腐蚀速率分别为8.3 g/(m2·h)和281.4 g/(m2·h),缓蚀率分别为99.4%和82.4%。可见BK组缓蚀剂的缓蚀效果优于PA组缓蚀剂,其中BK2的缓蚀效果最好;当以BK2为前体合成双曼尼希碱D1时,缓蚀性能进一步提升,由BK2时的99.2%提高至99.4%。
为了进一步分析缓蚀剂分子量子化学参数对缓蚀率的影响程度,采用灰色关联分析法计算了EHOMO,ELUMO,ΔE,μ,α,AS-各参数的关联度系数r,结果分别为0.574,0.891,0.884,0.810,0.736,0.759。一般认为:当某参数的r>0.8时,该参数对缓蚀率的影响显著;当r>0.6时,为有一定影响;当r<0.6时,为影响微弱[17]。ELUMO,ΔE,μ,α,AS-与曼尼希碱缓蚀率的关联度系数在0.736~0.891之间,而EHOMO与曼尼希碱缓蚀率的关联度较小,因此在后续分析中将仅从ELUMO,ΔE,μ,α,AS-角度讨论缓蚀剂的分子量子化学参数与缓蚀率间的关系。
2.2 缓蚀率与分子前线轨道间关系
2.2.1 曼尼希碱分子前线轨道分布为分析曼尼希碱分子在Fe表面的吸附机理,在曼尼希碱分子优化分子结构的基础上采用量子化学可视化程序VMD软件生成在等值面数值为0.05 a.u.时的缓蚀剂分子的HOMO和LUMO等值面图(见图4和图5),以分析曼尼希碱分子前线轨道分布。

图4 缓蚀剂分子的HOMO等值面图

图5 缓蚀剂分子的LUMO等值面图
由图4和图5可以看出:BK组、PA组和D组缓蚀剂分子的最高占据轨道HOMO均主要分布在N原子及与之直接相连的亚甲基上;BK1,BK2,BK3,D2分子的最低未占轨道LUMO离域分布于R2处苯甲酰基上;PA1,PA3,D1分子的最低未占轨道LUMO离域分布于R2处乙酰基上;PA2的R1处苯环成为LUMO离域分布的中心。
当曼尼希碱缓蚀剂吸附于Fe表面时,HOMO轨道中心向金属表面提供电子形成共价键,LUMO轨道中心接受金属表面电子形成反馈键[18]。通过观察曼尼希碱分子前线轨道分布可知,所研究的曼尼希碱分子均能通过给电子和接受电子方式与Fe表面相互作用,形成稳定的吸附膜,抑制腐蚀介质与金属相接触[19]。
2.2.2 前线轨道能隙对曼尼希碱分子的ΔE与η进行线性拟合,结果如图6所示。由图6得到η与ΔE的线性关系式为η=226.832-15.337ΔE,决定系数R2=0.968。
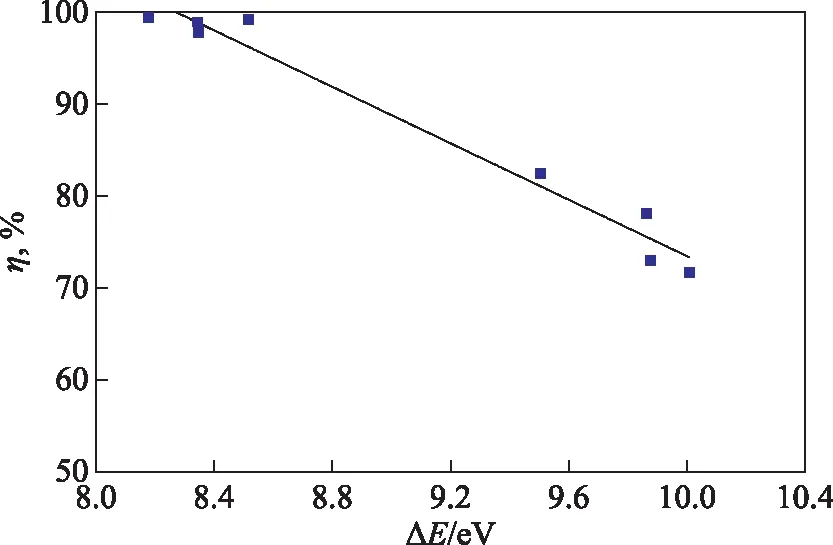
图6 8种缓蚀剂分子的η与ΔE的关系
BK组缓蚀剂的ΔE为8.345~8.517 eV,η在97.8%~99.2%之间;PA组缓蚀剂的ΔE为9.863~10.008 eV,η在71.7%~78.3%之间;D1和D2的ΔE分别为8.178 eV和9.506 eV,η分别为99.4%和82.4%。BK组缓蚀剂分子的ΔE低于PA组缓蚀剂的ΔE。D1和D2分子的ΔE分别低于BK2和PA1。缓蚀剂分子的EHOMO越高越有利于向金属表面提供电子,ELUMO越低越易于接受金属表面的自由电子,从而分子的ΔE越低其缓蚀率也越高。结合前线轨道能级与分布可知,BK组分子由于苯环与羰基的π-π共轭作用使得ELUMO和ΔE显著降低,因而BK组缓蚀剂的缓蚀率高于PA组缓蚀剂。由单曼尼希碱进一步合成得到双曼尼希碱后,双曼尼希碱D1和D2的ΔE分别低于单曼尼希碱分子BK2和PA1,表明双曼尼希碱更易与Fe表面形成配位/反馈键。双曼尼希碱分子D1和D2的缓蚀效果分别好于单曼尼希碱分子BK2和PA1。
2.3 缓蚀率与分子偶极矩的关系
分子偶极矩是衡量分子全局极性的重要参数,偶极矩越大缓蚀剂分子电荷分布越不均匀,就越容易通过分子间诱导力和色散力吸附在金属表面,从而使缓蚀率提高。对各缓蚀剂的μ和η进行拟合,结果如图7所示。由图7得到,其相应的线性关系式为η=-2.645+27.900μ,决定系数R2=0.826。
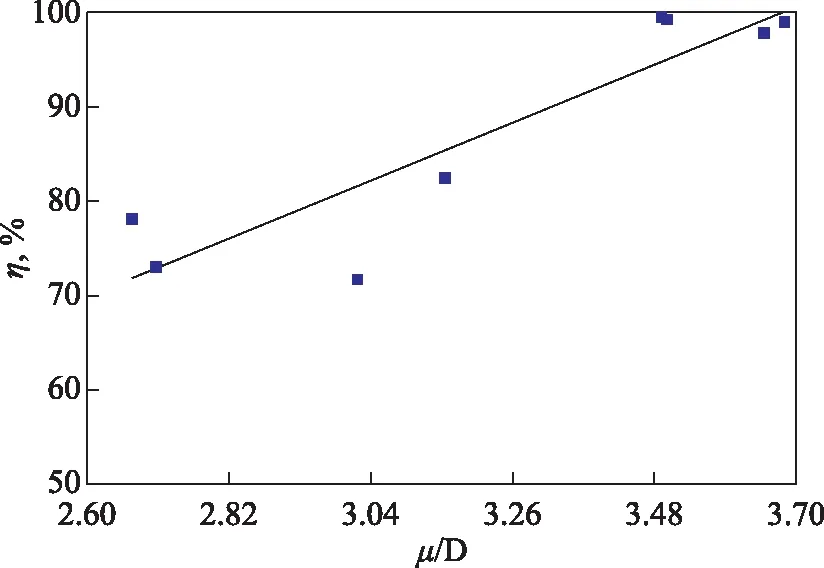
图7 8种缓蚀剂分子的η与μ的关系
BK组缓蚀剂分子的μ为3.50~3.68 D,D1的μ为3.51 D。PA组缓蚀剂分子的μ为2.67~3.02 D,D2的μ为3.16 D。BK组缓蚀剂分子的μ高于PA组,D1和D2分子的μ分别高于BK2和PA1。有机分子偶极矩的影响因素中原子平均电负性对μ的影响最大[20],研究表明结构相似的化合物原子平均电负性与μ成正相关关系。BK组缓蚀剂分子的苯甲酰基中羰基与一个苯基相连;PA组缓蚀剂分子的乙酰基中羰基与一个甲基相连。由于苯基碳原子是sp2杂化而甲基碳原子是sp3杂化,使得苯甲酰基比乙酰基具有更大的电负性,造成分子电荷局部分布更不均匀,因此BK组的分子μ均高于PA组。
在双曼尼希碱反应中BK2和PA1分子中与N原子相连氢基分别被β-羰基取代生成叔胺分子。D1和D2分子中的R3均为两个亚甲基连接乙酰基,R3中由于具有电负性的O原子,增加了R3基团上局部电荷分布不均匀程度,而BK2和PA1分子中的R3仅为氢基,因此曼尼希碱分子的μ由大到小的顺序为D1>BK2及D2>PA1。
2.4 缓蚀率与分子极化率的关系
将BK组缓蚀剂、PA组缓蚀剂和所有缓蚀剂分子的α与η进行拟合,得到的线性关系式及决定系数如表3所示,8种缓蚀剂分子的α与η的关系如图8所示。

表3 缓蚀剂分子的α与η的线性相关系式及决定系数

图8 8种缓蚀剂分子的η与α的关系
在化合物结构相似的情况下α与分子体积成正比。α越大在溶液中形成空腔要耗费的能量就越大,从热力学角度进行分析会有更多的缓蚀剂分子离开溶液主体而到达溶液与金属器壁的界面上,与金属器壁的界面上吸附成膜起缓蚀作用[21]。
BK1,BK2,BK3的α分别为194.6,197.7,188.5 a.u.,PA1,PA2,PA3的α分别为137.7,142.1,131.1 a.u.,D1和D2的α分别为250.7 a.u.和224.8 a.u.。可见缓蚀剂分子极化率的大小关系为BK组>PA组,BK组缓蚀剂α由大到小的顺序为BK2>BK1>BK3,PA组α由大到小的顺序PA2>PA1>PA3。BK组缓蚀剂分子苯甲酰基的存在对分子体积增加更高,因此其α高于PA系列缓蚀剂分子。单曼尼希碱引入第二个羰基增大了分子体积,从而使D1和D2的α增加。
2.5 缓蚀率与分子负静电势区域面积的关系
为分析曼尼希碱分子的反应活性,采用Mutiwfn软件计算静电势等值面数值为0.001 a.u.时的曼尼希碱分子范德华表面静电势分布和AS-,结果见图9。由图9可以观察到各个分子负静电势区域分布情况。

图9 缓蚀剂分子范德华表面静电势分布
将缓蚀剂的AS-与η进行线性拟合,得到的线性相关式及决定系数如表4所示,所有分子的AS-与η的关系如图10所示。

表4 缓蚀剂的AS-与η的线性关系式及决定系数

图10 8种缓蚀剂分子的η与AS-的关系
在亲核与亲电反应中分子的反应活性可以通过分子静电势的大小来确定。其中负的静电势是亲核反应区,静电势越负亲核反应活性越大,而正的静电势区是主要的亲电反应区,静电势越正亲电活性越大。实际应用中经常用分子中负的静电势区域来讨论反应的活性[22]。
由图10和表2可看出,BK组AS-为0.962~1.351 nm2,PA组AS-为0.448~0.826 nm2。BK组缓蚀剂中苯甲酰基π-π共轭产生的大范围负静电势区域,使得负静电势区域面积显著升高,PA组乙酰基上也存在负静电势区域,但其面积小于BK组,因此BK组的AS-大于PA组。
BK1,BK2,BK3分子的AS-分别为1.119,1.351,0.962 nm2,PA1,PA2,PA3 分子的AS-分别为0.596,0.826,0.448 nm2,D1和D2分子的AS-分别为1.716 nm2和0.815 nm2。BK2与PA2的R1苯甲基上的苯环上方π键使电子云密度上升,因而存在区域较大的负静电势区域;BK1与PA1的R1正己基上两侧氢附近也有一定的负静电势区分布,而BK3与PA3的R1环己基上没有负静电势区。苯环垂直于分子平面方向π键形成的负静电势区域有助于提高曼尼希碱的亲核程度从而与Fe表面稳定吸附,因而BK组缓蚀剂AS-由大到小的顺序为BK2>BK1>BK3,PA组缓蚀剂AS-由大到小的顺序为PA2>PA1>PA3。
D1分子中由于R1和R2处分别为苯甲基和苯甲酰基,D2的R1和R2处分别为环己基和乙酰基。苯环上方由于电子共轭形成π键,苯环上方存在较大的负静电势区域,因此D1负静电势面积高于D2,从而D1的缓蚀效果优于D2缓蚀剂。
3 结 论
(1)合成了BK组、PA组和D组曼尼希碱缓蚀剂并测定了其缓蚀效果,采用量子化学密度泛函理论计算得到曼尼希碱分子的优化几何结构、前线轨道、μ、α和AS-,用灰色关联分析法计算了量子化学参数与缓蚀率间的关联度。结果表明BK组缓蚀剂优于PA组,其中BK2的缓蚀率最佳,由其合成得到的双曼尼希碱D1缓蚀效果进一步提高,在90 ℃及4 h条件下在质量分数20%盐酸溶液中加入质量分数0.5%的D1对N80试片的缓蚀率为99.4%;ELUMO,ΔE,μ,α,AS-与曼尼希碱缓蚀率具有好的相关度。
(2)BK组缓蚀剂分子与PA组相比,BK组缓蚀剂分子的苯甲酰基比PA组分子的乙酰基电负性更大,使得电荷分布更不均匀,同时也增加了α和负静电势区域面积。BK组缓蚀剂分子的ELUMO、ΔE均低于PA组,其μ,α,AS-均高于PA组缓蚀剂。
(3)BK2和PA2分子的苯甲基与BK1和PA1分子的正己基及BK3和PA3分子的环己基相比,苯甲基使得α增加,负静电势区域面积增大。BK组缓蚀剂的α和AS-由大到小的顺序为BK2>BK1>BK3,PA组缓蚀剂的α和AS-由大到小的顺序为PA2>PA1>PA3。
(4)双曼尼希碱D1和D2的分子由于第二个β-羰基的增加,ELUMO和ΔE分别低于单曼尼希碱BK2与PA1,D1和D2分子μ,α,AS-均分别高于BK2与PA1,双曼尼希碱D1和D2的缓蚀效果优于BK2与PA1,与D2相比D1具有更好的缓蚀性能。
