醇氧化酶aox 1基因缺失对毕赤酵母菌产植酸酶的影响
2021-11-18曹春红王海燕张广民蔡辉益
■曹春红 王海燕 李 爽 张广民 蔡辉益
(1.天津博菲德科技有限公司,天津 301906;2.北京挑战生物技术有限公司,北京 100081;3.中国农业科学院饲料研究所,北京 100081)
植酸酶可以解除植酸抗营养作用,提高动物饲料的营养价值,改善动物的生产性能,同时减少动物粪便中植酸磷的含量,降低磷对环境的污染程度,因此植酸酶对提高养殖业的经济效益及环保效益具有十分重要的意义。
毕赤酵母是甲醇营养型酵母,可利用甲醇作为唯一碳源生产植酸酶。甲醇代谢的第一步是醇氧化酶利用氧分子将甲醇氧化为甲醛,生成过氧化氢。编码醇氧化酶的两种基因分别是aox1和aox2,aox1转录水平远高于aox2。在甲醇条件下能够大量表达aox1,其生成的mRNA占总mRNA的5%,翻译生成的蛋白占总可溶性蛋白比例30%[1]。通过对两种醇氧化酶基因aox1和aox2的改造,目前毕赤酵母有三种表型,分别是Mut+、Muts、Mut-[2-3]。1985年,Ellis等[4]首次从毕赤酵母菌中分离出醇氧化酶aox1基因及其启动子PAOX1。Cregg等[5]用强启动子PAOX1,利用毕赤酵母来生产重组蛋白。毕赤酵母表达重组蛋白中菌株改造、构建表达载体、分子操作手册的制定都进一步推动毕赤酵母表达系统的广泛应用[5-6]。
毕赤酵母GS115菌株含有aox1基因,这种菌株能快速利用甲醇作为碳源和能源,能在甲醇培养基中以野生型速率生长,因此称为甲醇利用快型菌株(Mut+)。GS115菌株同时含有aox2基因,aox2基因与aox1基因同源性92%,其编码的蛋白与aox1基因编码的蛋白有97%同源性,能缓慢利用甲醇。
在实际发酵生产中,甲醇的成本超过整个发酵成本的50%,如果能够降低甲醇用量,则可以降低发酵成本。本研究以毕赤酵母appaT菌株为出发菌株,通过同源重组的方法敲除aox1基因,试图改变菌体利用甲醇的速度,从而减少甲醇用量,预期将降低发酵成本。
1 材料与方法
1.1 试验材料
1.1.1 菌株与质粒
appaT菌株,是一株毕赤酵母菌株,作为出发菌株,本研究室保存;质粒pUG6(包含KanMX基因表达盒)、pUC19质粒(用于构建重组质粒),均由天津科技大学郭学武老师赠送。
1.1.2 主要试剂和工具酶
PCR引物由鼎国生物技术有限公司合成;DNA测序分析由华大基因完成。DNA聚合rTaq、限制性内切酶、DNA连接酶购自大连宝生物公司。
1.2 基因组提取和PCR方法
DNA提取、凝胶电泳、大肠杆菌转化等均使用标准技术,参考Joseph等[7]文献进行操作。
1.3 培养基
1.3.1 LB培养基
蛋白胨1%、氯化钠1%、酵母粉0.5%,pH 7.0。
1.3.2 YPD培养基
葡萄糖2%、蛋白胨2%、酵母粉1%,pH 6.0。
1.3.3 一级、二级种子罐、发酵罐培养基
甘油30 g/L、磷酸二氢铵30 g/L、磷酸二氢钾2 g/L、硫酸钾10 g/L、硫酸镁5 g/L、硫酸钙0.5 g/L、氢氧化钾0.5 g/L、PTM1 4.37 g/L。
1.4 培养方法
将摇瓶菌液以0.5%接种量接种一级种子罐,通气量40 m3/h,搅拌转速300 r/min,培养过程中pH维持在5.0,培养周期25 h。将一级种子液以10%接种量接种二级种子罐,通气量400 m3/h,搅拌转速200 r/min,培养过程中pH维持在5.0。培养周期8 h,种子成熟后全部移种发酵罐。发酵过程中用氨水将pH维持在4.5,培养温度29℃,当甘油耗尽后,流加质量分数为50%的甘油,流加速率为15 mL/(L/h),将菌体湿重维持在220 g/L,然后开始甲醇诱导,甲醇流速控制在2.5 mL/(L/h)。整个发酵过程中通气比维持在1∶1,搅拌转速为130 r/min。
1.5 发酵罐能耗成本计算方法
单罐能耗成本(元)=单罐搅拌耗电量×单价+压缩空气流量×单价+冰机耗电量×单价+蒸汽用量×单价。单罐能耗节约成本(元)=工艺改进前单罐能耗成本-工艺改进后单罐能耗成本。
1.6 植酸酶活性的测定
按照GB/T 18634—2009《饲用植酸酶活性的测定分光光度法》进行酶活性的测定。在温度37℃、pH 5.50条件下,每分钟从浓度为5.0 mmol/L植酸钠溶液中释放1μmoL无机磷,即为一个植酸酶活性单位,以U表示。
1.7 数据处理与分析
试验数据采用Excel 2010初步整理后,利用SPSS 18.0软件进行独立样本t检验,数据均以“平均值±标准误”表示,P<0.05表示差异显著。
2 结果
2.1 目的片段的获得(见图1~图3)
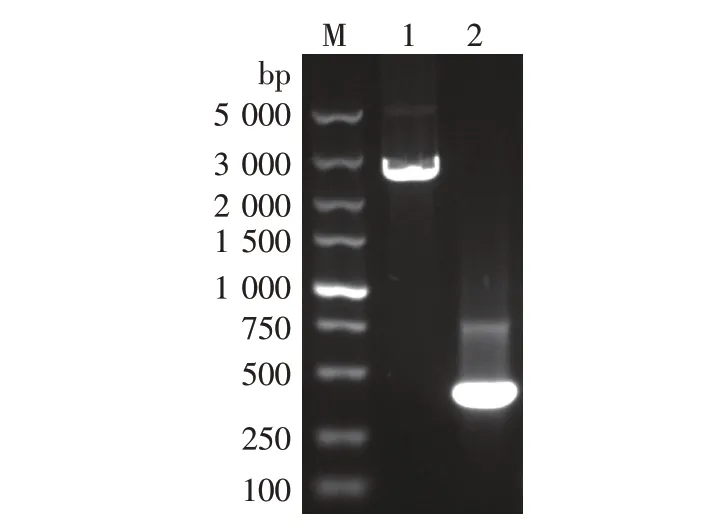
图1 pUC19质粒和AA片段
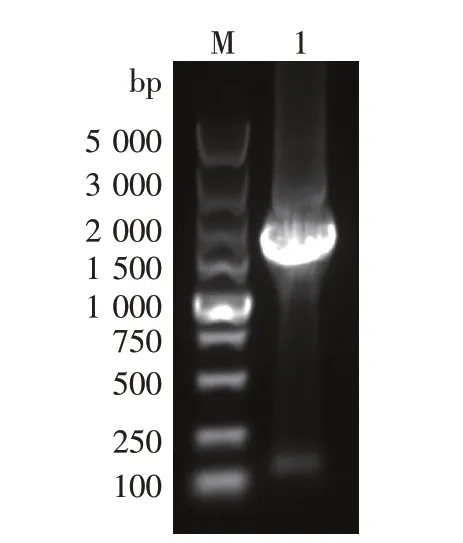
图2 KanMX基因PCR产物
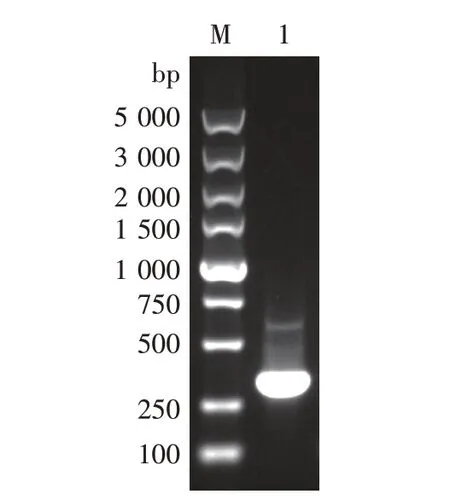
图3 BB片段PCR产物
在NCBI上查到Komagataella phaffiiGS115,Al⁃cohol oxidase基因序列。根据aox1基因及上下游基因序列,设计两对引物,一对为AA-U和AA-D,另一对为BB-U和BB-D。以appaT基因组为模板,利用引物AA-U和AA-D扩增AA片段(即aox1基因启动子的一部分,作为同源重组片段的上游同源臂),AA片段403 bp,利用引物BB-U和BB-D扩增BB片段(即aox1基因自身的一部分片段,作为同源重组片段的下游同源臂),BB片331 bp。以质粒pUG6为模板,利用引物K-U和K-D扩增1 613 bpKanMX基因片段。
2.2 重组质粒的构建与验证(见图4、图5)
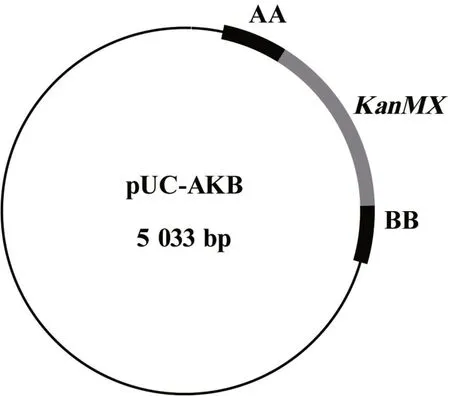
图4 重组质粒pUC-AKB的构建
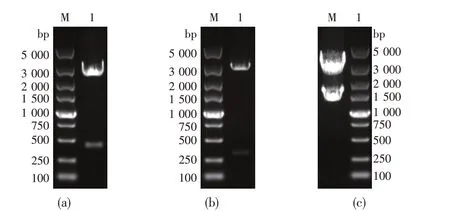
图5 重组质粒的酶切验证
将pUC19质粒(2 686 bp)和AA片段分别用HindⅢ和BamH I双酶切后,用DNA连接酶进行连接,并转化大肠杆菌DH5a感受态细胞。提取大肠杆菌中的质粒,对重组质粒进行HindⅢ和BamH I双酶切验证,得到片段大小分别是2 686 bp和403 bp,证明重组质粒pUC-A构建成功。

表1 PCR引物
将BB片段与pUC-A质粒分别用KpnI和EcoR I双酶切,用DNA连接酶进行连接,并转化大肠杆菌DH5a感受态细胞。提取大肠杆菌中的质粒,对重组质粒进行KpnI和EcoR I双酶切验证,得到片段大小分别为3 089 bp和331 bp,证明重组质粒pUC-AB构建成功。
将KanMX片段与pUC-AB质粒分别用BamH I和KpnI双酶切,用DNA连接酶进行连接,并转化大肠杆菌DH5a感受态细胞。提取大肠杆菌中的质粒,对重组质粒进行BamH I和KpnI双酶切验证,得到片段大小分别为3 420 bp和1 613 bp,证明重组质粒pUCAKB构建成功。
2.3 重组片段的获得(见图6)
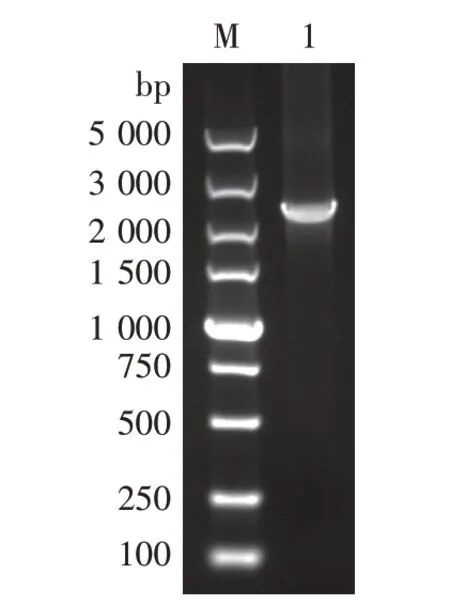
图6 PCR扩增AA-KanMX-BB片段
以重组质粒pUC-AKB为模板,以AA-U和BB-D为引物扩增得AA-KanMX-BB片段,片段大小为2 347 bp。
2.4 毕赤酵母的转化
在80μL酵母感受态细胞中加入待转化片段1~5μg,冰上放置15 min。迅速加入0.2 cm电击杯中,电击参数1 500 V、200Ω、25μF,迅速加入900μL山梨醇,30℃静置培养1 h,涂平板(含G418终浓度1 mg/mL)。
2.5 重组菌株的构建(见图7、图8)
将重组片段通过电击转化的方法转入酵母菌株中,通过G418抗性(具有KanMX的酵母菌株表现为一定浓度的G418抗性)进行筛选,再以∆上游(KanMX基因的675 bp处)和∆下游(染色体上aox1基因下游744 bp处)为引物进行PCR筛选验证,扩增大小为2 206 bp的片段。同时用appaT菌株基因组做对照。如图7所示,以∆上游和∆下游为引物,appaT菌株基因组为模板,没有PCR产物;重组菌株∆2因发生了同源重组,以∆上游和∆下游为引物能扩增出2 206 bp条带。同时用a-因子引物/3'AOX引物,如果PCR产物大小为1.4 kb左右(如图8所示)说明植酸酶基因在基因组上,没有被替换掉。证明重组菌株∆2构建正确。
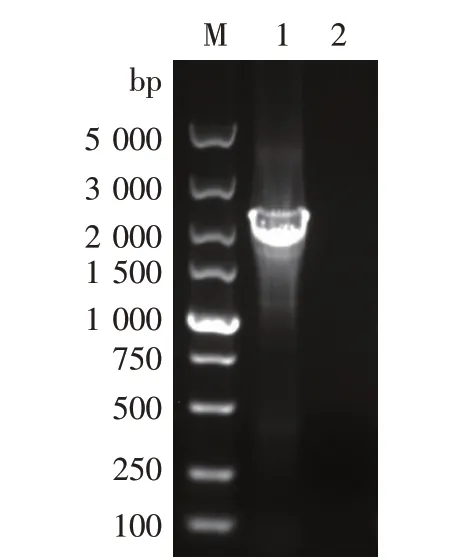
图7 以∆上游和∆下游引物筛选验证重组菌株
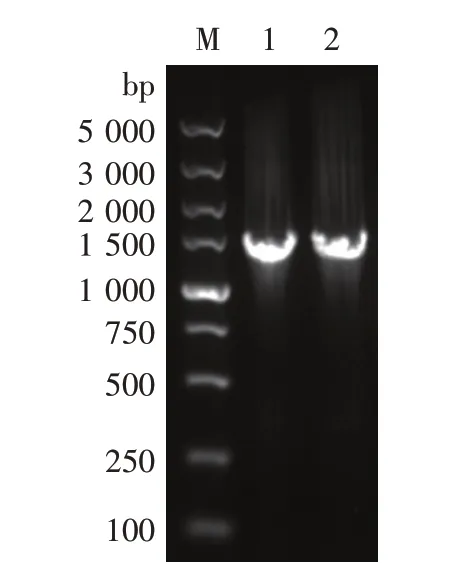
图8 以a-因子引物/3'AOX引物验证重组菌株的植酸酶基因
2.6 重组菌株摇瓶发酵结果
将得到的重组菌株∆2与出发菌株appaT在G418平板中三区划线,挑取平板上的单菌落,接种到30 mL YPD培养基中,进行种子活化。取500μL种子液,接种50 mL BMGY种子培养基中,30℃、200 r/min培养20 h,将培养液离心,弃上清,将菌体转接到25 mL BMMY发酵培养基中(含0.5%甲醇),每间隔24 h,向培养基中加入0.5%的甲醇,培养68 h。每株菌接种5个平行摇瓶,数据均以“平均值±标准误”表示。发酵结果见表2。
从表2可以看出,重组菌株∆2与appaT菌株生产植酸酶的性能并不相同,差异显著。appaT菌株发酵68 h,酶活为557 U/mL,此时∆2菌株酶活为621 U/mL,是appaT酶活的1.11倍。考虑菌体湿重对酶活的影响,计算可得∆2菌株比酶活是appaT菌株的1.38倍。说明∆2菌株有较好的发酵性能。
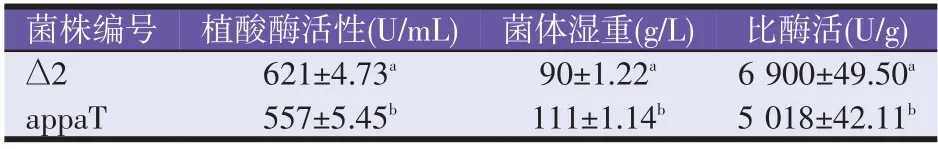
表2 重组菌株摇瓶发酵结果
2.7 重组菌株发酵生产
重组菌株的发酵过程中用氨水将pH维持在4.5,培养温度29℃,当甘油耗尽后,流加质量分数为50%的甘油,流加速率为15 mL/(L/h),将菌体湿重维持在220 g/L,然后开始甲醇诱导,甲醇流速控制在2.5 mL/(L/h)。整个发酵过程中通气比维持在1∶1,搅拌转速为130 r/mim。诱导160 h,放罐酶活在21 500 U/mL,放罐菌体湿重在320 g/L,整个发酵过程中甲醇用量约为18 t。10批次发酵罐数据统计结果见表3。

表3 重组菌株单罐发酵能耗成本
重组菌株∆2发酵能力同原菌株appaT接近,但生产能耗大幅降低。由表3可知,重组菌株单罐能耗总成本为46 790元,原生产菌株的单罐能耗总成本为78 427元,单罐能耗成本降低31 637元。甲醇用量降低10 t,按照3 000元/t计算,成本降低约3万元,单罐发酵成本降低约6.16万元。
3 讨论
目前国内外主要利用毕赤酵母作为植酸酶基因高效表达的宿主细胞,高密度发酵工艺已成为生物技术中进行中试生产的主要发酵工艺[8]。在不影响植酸酶表达量的前提下,为了降低发酵成本,通常会采用廉价的发酵培养基。Tang等[9]以毕赤酵母基因工程菌为生产菌株,研究了以生物柴油生产中的废弃甘油为碳源生产植酸酶的发酵工艺。Bai等[10]研究了利用谷氨酸生产废水作为培养基培养毕赤酵母基因工程菌生产植酸酶的工艺。
国内外学者目前在毕赤酵母利用甲醇生产重组蛋白的基因工程改造方面的研究多集中在对醇氧化酶启动子的改造,而对植酸酶生产菌株的醇氧化酶基因敲除方面的报道较少。王旗[11]对毕赤酵母转录因子编码基因MIT1和PRM1,以及碳源阻遏因子编码基因MIG1、MIG2和NRG1与AOX1启动子之间的相互作用进行研究。王小龙[12]通过对PAOX1调控网络的代谢工程改造,得到两个能够以甘油为碳源诱导PAOX1表达的非甲醇毕赤酵母表达系统,该系统有望用于工业上生产外源蛋白。沈伟[13]对毕赤酵母进行激酶基因系统性研究,有助于探讨毕赤酵母PAOX1调控机制。高娇[14]利用Cre/lox重组酶系统,通过构建不同的敲除表达盒,在一株毕赤酵母菌中连续敲除AOX1、AOX2等基因,得到5株重组菌株。将重组菌株在甘油和甲醇混合的培养基中进行发酵,其中∆AOX1/2-WT菌株在发酵工程中增强型绿色荧光蛋白(EGFP)的表达水平最好,较WT菌株提高了53.6%。
在毕赤酵母appaT的诱导表达阶段,甲醇是诱导剂。在实际发酵生产中,甲醇的成本超过整个发酵成本的50%,如果能够降低甲醇用量,则可以降低发酵成本。出发菌株appaT同时含有aox1基因和aox2基因,两个基因同源性92%,aox2基因编码的蛋白与aox1基因编码的蛋白有97%同源性,能缓慢利用甲醇。在甲醇存在下,菌株需要消耗大量的能量来代谢甲醇,醇氧化酶作为甲醇代谢途径上第一个关键酶,对菌体代谢甲醇非常重要。以appaT菌株为出发菌株,通过同源重组的方法敲除aox1基因,改变菌体利用甲醇的速度,从而减少甲醇用量,达到降低发酵成本的目的。出发菌株在甲醇代谢过程需要消耗大量的氧气,通过提高搅拌转速与通气量仍无法满足耗氧需求,同时氧气的消耗也会产生大量的热量,最终增加了高供氧和制冷的成本。与出发菌株相比,敲除aox1基因的∆2菌株的菌体湿重有所降低,菌体产热降低,因此减少了冰机的耗能;∆2菌株通气比较低,节约了空压机用气量;搅拌转速较低,节约了搅拌耗电量。因此,敲除aox1基因的∆2菌株从能耗方面降低了发酵成本。
研究通过同源重组的方法,敲除毕赤酵母菌的醇氧化酶aox1基因,得到的重组菌株∆2发酵能力同原菌株appaT接近,生产能耗大幅降低,同时降低了甲醇用量,从能耗和原料两方面都降低了发酵成本。因此,本研究的重组菌株具有创新性和先进性,在植酸酶工业化生产方面具有明显优势。
4 结论
以毕赤酵母appaT菌株为出发菌株,通过同源重组的方法敲除aox1基因,改变菌株利用甲醇的速度,降低甲醇用量,降低发酵成本。在实际发酵生产中,aox1基因缺失的菌株发酵能力与原有菌株接近,但生产能耗大幅降低,甲醇用量降低,最终单罐发酵成本降低约20%~24%。
