氧化槐果碱对小鼠急性酒精性肝损伤的保护作用
2021-11-18余建强王晓琴康艳生常人元刘静静
张 伟,王 彤,余建强,王晓琴,康艳生,常人元,刘静静*
(1.榆林市第一医院药剂科,榆林 719000;2.宁夏医科大学药学院,银川 750004)
酒精性肝病(ALD)是临床常见的一种因长期和/或大量饮酒所致的肝病,已成为除病毒性肝炎所致肝损伤以外的第二大常见肝病[1]。酒精摄入机体后90%以上在肝脏代谢,少量直接通过肺、尿液和汗液排出体外,其在肝脏代谢过程中会产生大量活性氧自由基(ROS)和活性氮自由基,当酒精摄入量超过肝脏的清除能力后,便会引起肝脏的氧化应激损伤,进一步导致酒精脂肪肝、肝炎、肝硬化,甚至肝癌[2]。氧化槐果碱(OSC)是从天然药物苦豆子中提取的药代动力学符合二房室模型的一种生物碱[3]。研究表明,OSC具有镇痛[4-5]、抗炎[6-8]、抗肺损伤[9]、抗肿瘤[10-11]、抗惊厥[12-13]、抗脑缺血/再灌注损伤[14-15]等多种药理作用,其肺损伤保护作用和神经保护作用皆与OSC抗氧化应激、炎症反应以及抗凋亡等机制有关。本研究旨在通过建立急性酒精性肝损伤小鼠模型,观察OSC对模型小鼠的肝功能指标、抗氧化指标以及肝脏组织结构的影响,探讨OSC对酒精诱导的急性肝损伤是否具有保护作用及其潜在的机制,为寻找保肝新药提供实验依据。
1 仪器与材料
1.1仪器 低温冰箱(-20 ℃,合肥荣事达电冰箱有限公司);超低温冰箱(-80 ℃,日本三洋电器股份有限公司);DK-600型电热恒温水浴箱(上海佳胜实验设备有限公司);752型紫外分光光度仪(上海精密科学仪器厂);超声波细胞破碎机(南京贝帝实验仪器有限公司);FM70型制冰机(美国Grant公司);WH-861型旋涡混匀器(太仓市科教器材厂);METTLER TOLED型电子天平(梅特勒-托利多仪器有限公司);pH计(德国Beckman公司);Olympus CHC-212光学显微镜(日本)奥林巴斯株式会社。
1.2试药 氧化槐果碱(OSC,批号80041122,南京泽朗医药科技有限公司);56°白酒(北京红星酒业有限公司);丙氨酸氨基转移酶(ALT)试剂盒、天冬氨酸氨基转移酶(AST)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、谷胱甘肽过氧化物酶(GSH-PX) 试剂盒和丙二醛(MDA)试剂盒,均购自南京建成生物工程有限公司;其他试剂均为国产分析纯。
1.3动物 50只SPF级昆明种雄性小鼠,体质量为(20±2) g,由西安交通大学实验动物中心提供,饲养于榆林市第一医院中心实验室清洁级动物房,12 h光照和黑夜循环,温度为(22±2) ℃,相对湿度为50%~60%,标准饲料饲喂,自由饮水。
2 方法
2.1动物分组、模型制备及动物处理 随机将50只小鼠分为5组,即正常对照组、模型组、OSC低(10 mg·kg-1)、中(20 mg·kg-1)、高(40 mg·kg-1)剂量组。适应性饲喂1周后,OSC各剂量组(10、20、40 mg·kg-1)提前预防给药2 d,同时正常对照组和模型组给予等体积(0.04 mL·g-1)的9 g·L-1生理盐水;根据文献方法[16]第3天模型组和OSC各剂量组小鼠均给予56°白酒(6 g·kg-1)灌胃,正常对照组给予等热量、等体积的糖水(0.5 kg·L-1)灌胃,灌胃后5组均禁食不禁水,6 h后称取各组小鼠体质量后眼静脉丛取血,室温下静置1 h,于4 ℃以4 000 r·min-1离心10 min,分离血清,分装于0.5 mL的离心管,置于-20 ℃低温冰箱中冻存。颈椎脱臼法处死小鼠,取肝脏全叶,用4 ℃预冷的生理盐水洗净,经滤纸轻柔吸去表面水分后称质量,计算肝脏指数。取肝脏小圆叶固定于多聚甲醛溶液(40 g·L-1)中做病理学检查,其余放入液氮速冻,置于超低温冰箱中(-80 ℃)保存。
2.2肝脏指数 用公式肝脏指数=肝脏质量÷体质量×100%计算肝脏指数。
2.3血清ALT和AST水平检测 取部分冻存于-20 ℃冰箱的血清,用752型紫外分光光度仪和AST、ALT试剂盒检测小鼠血清ALT和AST水平。
2.4肝组织SOD、CAT、GSH-Px活力和MDA含量测定 用4 ℃预冷的9 g·L-1生理盐水将超低温(-80 ℃)冰箱冷冻的肝组织制成10%肝组织匀浆液,于4 ℃以3 500 r·min-1离心10 min,取上层清液。按照 SOD、CAT、GSH-Px和MDA试剂盒操作说明,用752型紫外分光光度仪检测上层液中SOD、CAT、GSH-Px活性和MDA含量。
2.5病理学检查 将固定于40 g·L-1多聚甲醛溶液的肝脏小圆叶进行常规脱水、石蜡包埋切片、苏木素-伊红(HE) 染色,光镜下观察其肝组织形态学变化。

3 结果
3.1小鼠一般情况、体质量及肝脏指数的变化 模型组和OSC各剂量(10、20、40 mg·kg-1)组小鼠在酒精灌胃后数分钟出现翻正反射消失、嗜睡等醉酒状态,灌酒6 h后小鼠逐渐苏醒。各组小鼠在实验结束时均无中毒死亡情况,体质量亦无明显变化;模型组小鼠肝脏指数较正常对照组升高,差异具有显著统计学意义(P<0.01);与正常对照组相比,OSC各剂量组肝脏指数增加,差异有统计学意义(P<0.05)。见表1。

表1 OSC对小鼠初始体质量、终末体质量和肝脏指数的影响 (n=10)
3.2OSC对小鼠血清肝损伤标志酶ALT和AST的影响 与正常对照组比较,模型组小鼠血清ALT和AST水平明显升高,差异有统计学意义(P<0.01),表明小鼠急性酒精性肝损伤模型建立成功;给予OSC(10、20、40 mg·kg-1)预处理后,OSC各剂量组小鼠血清ALT和AST水平显著降低,差异具有统计学意义(P<0.01),提示OSC(10、20、40 mg·kg-1)预处理对小鼠酒精性肝损伤有保护作用。结果见表2。
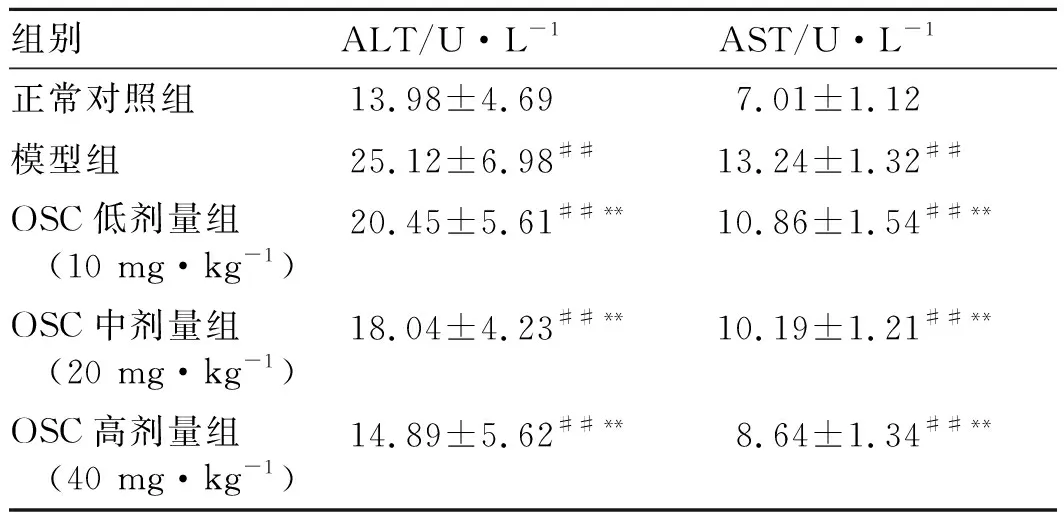
表2 OSC对小鼠血清肝损伤标志酶ALT和AST的影响 (n=10)
3.3肝脏病理学检查 光镜下,将小鼠肝脏组织切片进行HE染色后,正常对照组可见肝小叶轮廓清晰,肝板以小叶中央静脉为中心向四周呈放射状排列,肝细胞排列整齐(见图1);模型组可见肝小叶结构破坏,肝板列紊乱,呈点状、片状坏死,胞浆中可见大小不等、数量不一的圆形脂肪空泡,小叶中央静脉周围和汇管区有大量炎细胞浸润(见图1);OSC(10、20、40 mg·kg-1)预防给药后肝脏细胞间隙水肿明显减轻,有散在炎细胞浸润,肝细胞索排列较整齐,肝细胞呈多边形,细胞分界清晰,核圆而清晰,位于细胞中央,提示OSC具有显著改善急性酒精性肝损伤小鼠组织病理学结构的作用。

图1 急性酒精性肝损伤小鼠肝脏病理切片 (HE×200)
3.4OSC对小鼠肝组织SOD、CAT、GSH-Px和 MDA的影响 与正常对照组比较,模型组小鼠肝组织SOD、CAT和GSH-Px活性显著下降(P<0.01),MDA含量显著提高(P<0.01),提示酒精可诱导肝脏发生氧化应激损伤,导致氧化与抗氧化水平失衡;OSC(10、20、40 mg·kg-1)预防给药后可明显逆转肝组织SOD、CAT和GSH-Px等抗氧化酶的活性(P<0.05或P<0.01),且显著降低肝脏MDA含量(P<0.01),并且随着剂量增加效果更明显,提示给予OSC预防给药能够明显提高抗氧化酶的活性,减轻酒精引起的肝组织氧化损伤。见表3。

表3 OSC对小鼠肝组织SOD、CAT、GSH-Px和MDA的影响 (n=10)
4 讨论
ALD具有较高的发病率和严重的不良预后,严重危害人类的身体健康。因此,寻找合适的药物防止ALD的发生发展是当务之急。天然抗氧化植物及其成分已成为抗急性酒精性肝损伤药物研究的热点[3]。本研究参考文献方法[16]选用昆明种小鼠给予56°白酒一次性灌胃(6 g·kg-1),建立小鼠急性酒精性肝损伤模型;并参考文献[17-18]报道的OSC的半数致死量(LD50),设计了低、中、高3个剂量(10、20、40 mg·kg-1)组。实验结果显示,OSC(10、20、40 mg·kg-1)预处理2 d后,各剂量组均未出现小鼠死亡;OSC显著改善了急性酒精性肝损伤小鼠的肝肿大,降低了肝脏指数;组织病理学结果表明,OSC显著减轻肝脏炎性水肿,提示本研究OSC给药剂量范围设计适当,且在该剂量范围内OSC对急性酒精性肝损伤小鼠具有一定的保护肝作用。
ALT和AST是肝细胞损伤的重要标志酶,在正常血清中ALT和AST含量很低,当肝细胞受损时,肝细胞中的ALT和AST进入外周血清中,导致血清中ALT和AST含量明显升高[19]。本研究结果显示,模型组小鼠血清ALT和AST含量较正常对照组明显增高,且ALT增高幅度大于AST,此结果与文献[19]报道一致。而相关文献报道[20-21],AST的增高幅度大于ALT,其原因可能与小鼠饮酒量以及持续时间不同而导致肝损伤的严重程度不同有关。给予OSC(10、20、40 mg·kg-1)干预后,小鼠血清中的ALT和AST含量呈剂量依赖性下降,尤其是ALT含量显著降低,其降酶机制可能与OSC维持细胞膜稳定性、减少肝细胞损伤,进而减少肝细胞ALT、AST外漏有关,表明OSC对急性酒精性肝损伤具有一定的保护作用。
经胃肠道吸收的酒精约90%经过乙醇脱氢酶(ADH)途径、细胞色素P4502E1(CYP2E1)途径和还原型辅酶Ⅱ(NADPH )途径代谢为具有毒性的乙醛,并产生ROS。过量的 ROS 会导致氧化应激状态,促进脂质过氧化,产生脂质过氧化产物,如 MDA,还会耗尽抗氧化酶,如SOD、CAT和GSH-Px[21-22]。本研究结果显示,OSC(10、20、40 mg·kg-1)预处理后,肝组织中SOD、CAT、GSH-Px等抗氧化酶活性显著提高,而MDA含量显著下降,表明OSC可减轻急性酒精性肝损伤小鼠的肝脏肿大程度、改善肝组织病理学结构、降低血清中ALT和AST含量,并增加肝组织SOD、CAT和GSH-Px活性,从而提高小鼠的抗脂质过氧化能力,降低肝细胞的坏死程度,修复肝细胞损伤。
综上所述,OSC对急性酒精性肝损伤有一定的保护作用,该作用可能与其通过增强机体抗氧化能力、清除自由基、抑制脂质过氧化反应和维持肝细胞膜稳定性有关。
