干扰hTERT增强光动力疗法诱导宫颈癌细胞凋亡的体外实验
2021-11-17黄守国宗丽菊张友忠
王 颉,黄守国,宗丽菊,张友忠
(1.中南大学湘雅医学院附属海口医院妇产科,海口 570208;2.中国医学科学院北京协和医院妇产科,北京 100730;3.山东大学齐鲁医院,济南 250012)
宫颈癌是我国目前发病率和死亡率较高的妇科恶性肿瘤之一,严重威胁女性的健康及生命,随着宫颈癌筛查的推广及越来越多抗肿瘤药物的出现,宫颈癌的治疗已取得了很大的进步,但仍有很多患者存在转移及复发,预后差,因此仍需不断探索新的辅助治疗手段[1-2]。光动力疗法(photodynamic therapy,PDT)利用光敏剂和激发光源靶向治疗肿瘤,成为继手术、放化疗之后的新的微创疗法,已用于治疗皮肤癌、肺癌、宫颈癌、早期食管癌等[3]。四甲基吡啶卟啉[meso-5,10,15,20-Tetrakis-(N-methyl-4-pyridyl)porphine,TMPyP4]作为四价阳离子卟啉化合物,是一种人工合成的新型水溶性光敏剂,其进入细胞后通过结合并稳定端粒序列上的G-四联体结构,抑制端粒酶活性。早有研究证明,TMPyP4-PDT可加速宫颈癌细胞的调亡,从而有效抑制宫颈癌细胞的生长[4-5]。hTERT作为端粒酶逆转录酶的催化亚基,只在肿瘤组织中表达,对hTERT基因进行有效干扰会有效抑制宫颈癌的发生发展[6]。本研究拟通过干扰下调hTERT表达,观察能否增强光动力疗法对宫颈癌的作用,并探索其可能的作用机制,从而为探讨宫颈癌新的治疗手段提供一定的理论依据。
1 材料与方法
1.1 材料与试剂 人宫颈癌Caski细胞株(本实验室保存),Lenti-hTERT-shRNAs、Polybrene(上海吉玛),RNA提取、逆转录、PCR试剂盒(TaKaRa),RT-PCR引物(上海博尚),流式凋亡试剂盒(美国BD),hTERT、SP-1兔抗人单克隆抗体(Abcam),Bcl-2、Bax、caspase-3单克隆抗体(Santa Cruz),荧光二抗羊抗兔IgG(Abbkine)。
1.2 方法
1.2.1 细胞培养和转染 在37℃、5% CO2、饱和湿度孵育箱中用含10% FBS的DMEM培养液培养Caski细胞,选取对数生长期细胞。转染前24h,将细胞按20×104细胞/孔接种于6孔板,待细胞融合至60%左右,将慢病毒按说明进行转染(MOI为20,Polybrene使用浓度为5μg/mL),将四个干扰片段sh-1、sh-2、sh-3、sh-4分别转染至各孔,转染后72h观察转染效率并筛选出有效干扰片段。
1.2.2 hTERT干扰片段的转染与筛选 转染后72h,提取各孔细胞总RNA,按逆转录试剂盒说明合成cDNA,GAPDH作为内参比较各组细胞中hTERT基因的表达。选取表达量最低的sh-RNA组,利用免疫荧光的方法对初筛结果进行验证,经爬片(4%多聚甲醛固定,30min),室温通透(1% TritomX-100,30min),室温封闭(山羊血清,30min),hTERT抗体孵育过夜(1∶100,4℃),荧光二抗羊抗兔IgG(1∶200),室温避光孵育1h,DAPI避光染核5min,抗荧光淬灭的封片剂封片,观察hTERT蛋白表达情况,结果用Image Pro-Plus 6.0软件进行统计分析。
1.2.3 实验分组 空白对照组(A组);TMPyP4-PDT组(B组):将TMPyP4用DMEM培养基(不含血清)配置成750μmol/L的储存液(严格避光、无菌),选取宫颈癌Caski细胞,给予7.5μmol/L的TMPyP4工作液,37℃、饱和湿度、5% CO2条件下避光孵育4h后进行光照。光照条件:波长470nm,功率为0.4W,激光能量密度为4J/cm2,光照时间为1min。光照后所有细胞换成完全培养液。干扰hTERT组(C组):成功稳定转染Lenti-hTERT-sh4的Caski细胞;联合处理组(D组):选取成功稳定转染Lenti-hTERT-sh4的Caski细胞,给予和B组同样的处理。照光24h后,流式细胞仪检测细胞凋亡率,48h后提取RNA进行RT-PCR,72h后提取蛋白进行Western blot实验。
1.2.4 流式细胞仪检测细胞凋亡 照光24h后,将细胞接种于6孔板,调整细胞浓度为105~106细胞/mL,按凋亡检测试剂盒说明进行操作,于1h内采用流式细胞仪检测细胞早期凋亡率情况,实验重复3次。
1.2.5 RT-PCR检测Bcl-2、Bax、caspase-3、SP-1 mRNA表达 照光48h后,采用Trizol法提取细胞总RNA,检测其浓度及纯度后,进行反转录反应:20μL,37℃ 15min、85℃ 5s。反转录产物作为模板进行RT-PCR反应:10μL体系,95℃ 10s,1个循环;95℃ 5s、57℃ 30s、72℃ 30s,40个循环;65℃ 15s。GAPDH作为内参,PCR反应引物序列:hTERT:F:5'-TCACGGAGACCACGTTTCAAA-3',R:5'-TTCAAGTGCTGTCTGATTCCAAT-3';Bcl-2:F:5'-TGGCCAGGGTCAGAGTTAAA-3',R:5'-TGGCCTCTCTTGCGGAGTA-3';Bax:F:5'-TTGCTTCAGGGTTTCATCCA-3',R:5'-AGACACTCGCTCAGCTTCTTG-3';caspase-3:F:5'-TAAATGAATGGGCTGAGCTG-3',R:5'-ATGGAGAAATGGGCTGTAGG-3';SP-1:F:5'-AACCCACAAGCCCAAACAATCACC-3',R:5'-CCCCGAGCCCCTTCCTTCACT-3';GAPDH:F:5'-ATGGGGAAGGTGAAGGTCG-3',R:5'-GGGGTCATTGATGGCAACAATA-3'。用2-△△CT方法分析以上基因mRNA相对表达量。实验重复3次。
1.2.6 Western blot检测Bcl-2、Bax、caspase-3、SP-1蛋白表达 照光72h,提取各组处理后的细胞总蛋白,测定蛋白浓度,取30μg蛋白行电泳、转膜,封闭;分别加兔抗人Bcl-2、Bax、caspase-3、SP-1单克隆抗体(1∶1000)及小鼠抗人β-actin单克隆抗体(1∶500),孵育、洗膜,ECL法进行分析。实验重复3次。

2 结 果
2.1 获得hTERT干扰的细胞 所有干扰片段中,转染sh-4细胞的hTERT表达量明显降低,且差异有统计学意义(P<0.05),结果见图1。sh-4作为有效干扰片段用于后续实验。
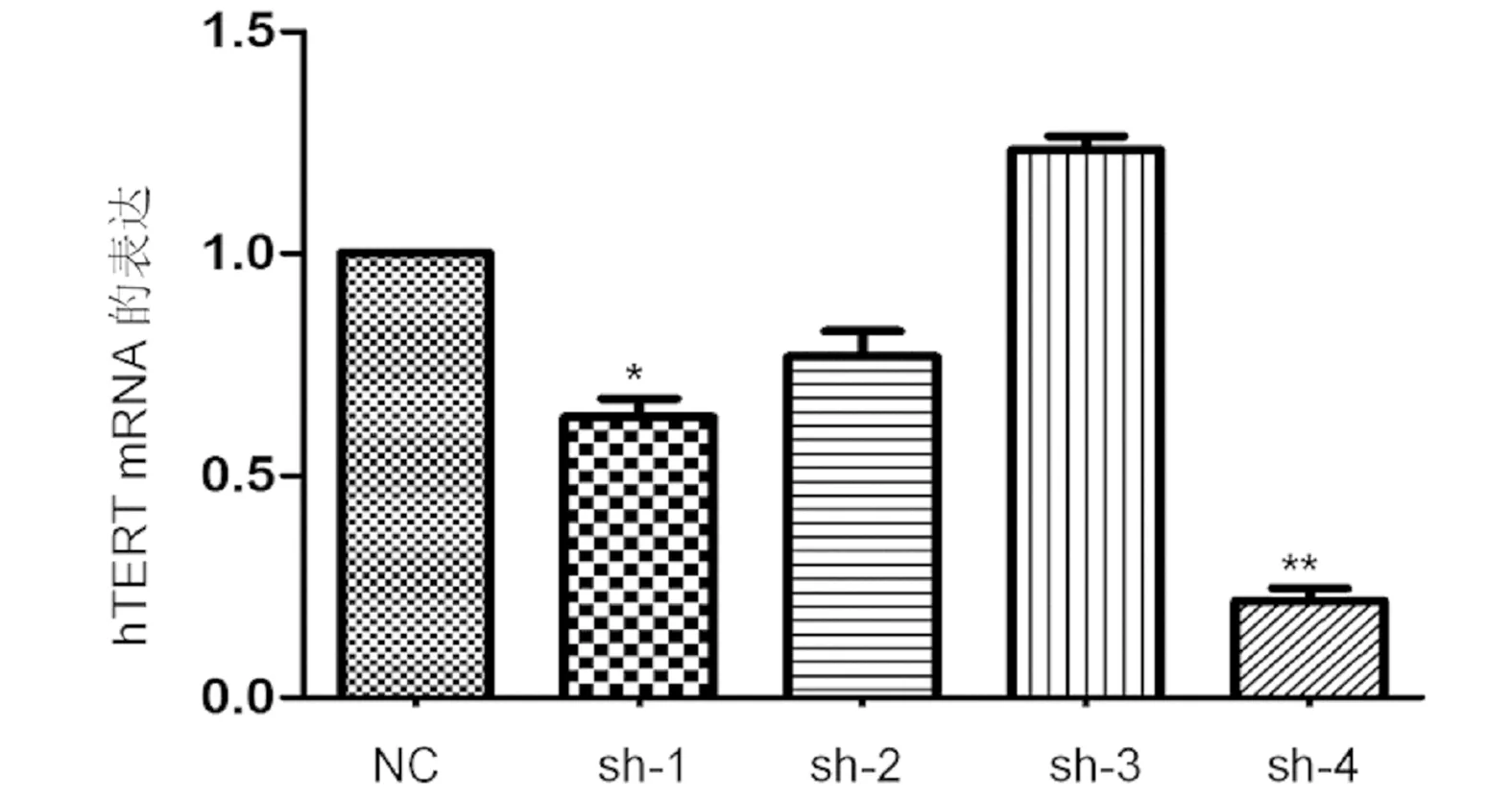
图1 hTERT有效干扰片段的筛选
2.2 干扰hTERT增强光动力疗法对宫颈癌细胞的诱导凋亡 空白对照组、TMPyP4-PDT组、转染hTERT组、联合处理组细胞的早期凋亡率分别为(3.68±0.5352)%、(28.79±0.8473)%、(12.13±0.6225)%、(57.88±1.07)%。给予hTERT转染和TMPyP4-PDT的联合处理组的细胞早期凋亡率明显高于其他3组(P<0.05),而TMPyP4-PDT组和转染sh-4组的早期凋亡率较空白对照组明显增加(P<0.05),且两者比较差异有统计学意义(P<0.05)。
2.3 干扰hTERT联合光动力疗法降低Bcl-2、SP-1 mRNA表达和上调Bax、caspase-3 mRNA表达 见图2。转染hTERT的细胞,接受TMPyP4-PDT后caspase-3、Bax mRNA表达量明显增加(P<0.01),SP-1、Bcl-2 mRNA表达量明显下降(P<0.01),Bcl-2/Bax比值相应增加(P<0.01),而其余两组之间无明显差异(P>0.05)。
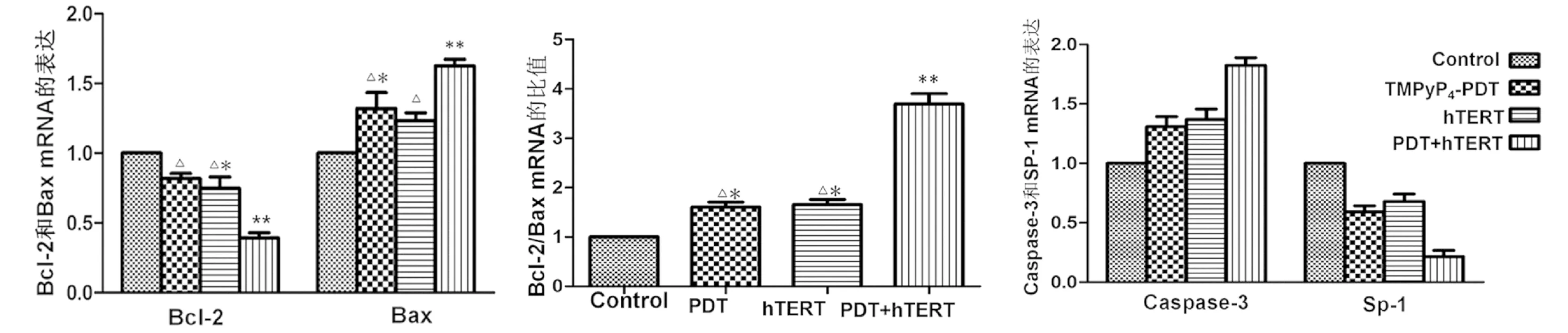
图2 四组宫颈癌细胞中Bcl-2、Bax、caspase-3、SP-1 mRNA表达
2.4 干扰hTERT联合光动力疗法降低Bcl-2、SP-1蛋白表达和上调Bax、caspase-3蛋白表达 与单独处理组和空白对照组相比,给予hTERT转染和TMPyP4-PDT联合处理的细胞组Bcl-2、SP-1蛋白表达量明显减少(P<0.05),Bax、caspase-3蛋白表达量明显增多(P<0.05)。TMPyP4-PDT组和转染sh-4组的Bcl-2、Bax蛋白表达量比较,差异有统计学意义(P<0.05);两组的SP-1、caspase-3蛋白表达比较,差异无统计学意义(P>0.05)。见图3。

图3 宫颈癌细胞中Bcl-2、Bax、caspase-3、SP-1蛋白的表达
3 讨 论
宫颈癌的发生是一个多基因参与的多步骤过程,目前发病率日渐升高,手术、放疗、化疗作为宫颈癌的基本治疗方法,其存在的风险及某些不良反应让许多患者无法耐受[7]。光动力治疗利用光敏剂和一定波长的光源对照射部位的病变组织、细胞产生杀伤作用,是一种对正常组织无损伤、靶向性好的治疗方法,特别对于年轻有生育要求的早期宫颈癌患者及年老不适宜手术的宫颈癌患者,是一种可选择的治疗手段[8]。TMPyP4是较早发现的G-四联体稳定剂,可选择性聚集于肿瘤细胞细胞核[9],TMPyP4的作用效果已在宫颈癌、卵巢癌、肝癌等细胞中得到证实[10-11],近年来TMPyP4在肿瘤的光动力治疗中备受关注。端粒酶在正常组织中不表达或低表达,而在许多肿瘤组织中呈高表达状态,因此其可能参与多种肿瘤的发生、发展机制[12]。hTERT作为端粒酶的活性成分,利用慢病毒作为载体将其有效干扰,转染至宫颈癌细胞,定位于细胞核使端粒长度不能得到维持,从而加速细胞凋亡。以上两种治疗方法均能准确定位于细胞核而起到杀伤肿瘤细胞的作用。
Bcl-2家族是最早被发现的与细胞凋亡相关的蛋白,在细胞凋亡信号转导途径中发挥重要作用[13]。抑制细胞凋亡的Bcl-2和促进细胞凋亡的Bax相互拮抗,两者之间的比例是决定细胞凋亡还是存活的关键,Bax蛋白高表达时促进细胞凋亡,Bcl-2蛋白高表达时抑制细胞凋亡[14]。caspase是细胞凋亡过程中的关键元素,其激活与过表达均可引起细胞凋亡[15],caspase-3位于凋亡级联反应的下游,是最重要的效应型caspase,是细胞凋亡的关键执行者,是多种凋亡信号传递的汇聚点,其活化是凋亡进入不可逆阶段的标志[16]。SP-1作为转录因子的成员之一,在胃癌、胰腺癌、乳腺癌及甲状腺肿瘤细胞中高表达[17-18],是肿瘤发生、发展中的一个重要因素,这与其能激活与肿瘤生长相关的基因有关,如hTERT、SP-1转录因子明显促进端粒酶活性和hTERT mRNA的转录活性[19]。本研究显示,联合处理组(成功稳定转染Lenti-hTERT-sh4的Caski细胞并给予7.5μmol/L的TMPyP4治疗),其凋亡相关基因Bax、caspase-3表达均增加,Bcl-2表达减少,转录因子SP-1的表达也减少,表明干扰hTERT的表达可增强光动力治疗的疗效,可能作用机制是通过加速细胞凋亡和(或)特异地降低端粒酶的活性而实现。
综上所述,通过体外实验发现干扰hTERT可增加Bax、caspase-3表达,降低Bcl-2、SP-1表达,增强光动力疗法对宫颈癌细胞的诱导凋亡作用,从而为宫颈癌的光动力治疗提供了一定的理论依据。
