燕麦β-葡聚糖的提取制备及纯化研究进展
2021-11-17孟续李言钱海峰张晖齐希光王立
孟续,李言,钱海峰,张晖,齐希光,王立
(江南大学 食品学院,江苏 无锡,214122)
葡聚糖是由D-吡喃葡萄糖苷残基通过α或β糖苷键连接而成的一类高分子化合物,包含线性、支化和环状结构,大部分可溶于水,也有部分类别不可溶(如细菌凝胶多糖类)。葡聚糖的性质因链的构象、异构体构型、键的顺序排列、分支长度和主链结构而异。根据葡聚糖的构型可分为α-葡聚糖和β-葡聚糖[1]。立体化学结构上,α-葡萄糖苷键沿轴向位置,而β-糖苷键在椅式构象中的赤道位置[2]。β-葡聚糖主要来源于麦类谷物(大麦、燕麦、小麦等)、酵母、菌类、细菌,玉米皮、褐藻海带、雪松树皮等也含有部分β-葡聚糖,其分子质量在2.1×103~2×106Da[3]。据估计,到2024年β-葡聚糖的市场价值将达到10.3亿美元[1],其中谷物β-葡聚糖更是预达到4.765亿美元(占比近50%)[4]。谷物β-葡聚糖一般存在于籽粒的亚糊粉层和胚乳细胞壁中,其中燕麦β-葡聚糖(3%~7%)大多存在糊粉层,尤其是亚糊粉层,而淀粉胚乳中含量则很少[5]。燕麦β-葡聚糖优良的品质特性使其一直处于国内外研究热点。本文简述了燕麦β-葡聚糖的品质特性,并对多年来燕麦β-葡聚糖的提取纯化工艺进行了详尽阐述和总结,旨在为燕麦β-葡聚糖的深入研究和全面开发提供科学依据。
1 品质特性
燕麦β-葡聚糖由β-(1→4)连接的葡萄糖单元每隔2~3个单元由一个β-(1→3)连接,是吡喃葡萄糖组成的高分子无分支线性非淀粉多糖,其中约含有70%的β-(1→4)键和30%的β-(1→3)键,摩尔比1.5~2.1,分子质量6.5×104~3.1×106Da,特殊的分子结构决定了其良好的品质特性,作为一种可溶性膳食纤维,对人体具有较好的健康作用[6-7]。燕麦β-葡聚糖由于具有良好的水溶性、高黏度、凝胶性等功能特性,被广泛应用于食品医药等领域。同时,在热、酸、碱等条件下都比较稳定,常作为乳化剂、增稠剂、稳定剂和天然防腐剂应用于相应食品开发中。研究表明,高纯度燕麦β-葡聚糖作为结构改良剂对无麸质酵母发酵蛋糕理化和感官特性有较大影响,用量为66.12%时,可以改善蛋糕的比容、亮度、色差以及硬度[8]。将富含β-葡聚糖的燕麦壳制成的凝胶作为脂肪替代品,可以制作具有较好品质的高β-葡聚糖含量低脂肪牛肉汉堡[9]。有实验表明,添加80 g/kg燕麦β-葡聚糖纤维粉可以使意大利面在烹调过程中具有较好的吸水率和黏附性,且色泽与未处理熟面条相近[10]。此外,燕麦β-葡聚糖还可应用于小麦面包、粥、小麦面条、低脂牛肉饼、乳制品、蛋清面食等食品开发中。
随着消费者对营养与健康的追求,燕麦β-葡聚糖除品质改良剂之外具有的生理健康作用也逐渐引起了研究者的关注,相应的生理活性和作用机制也逐渐被提出。研究表明,燕麦β-葡聚糖能刺激蠕形微生物种群的扩张,从而对盲肠微生物起到益生作用,同时燕麦β-葡聚糖还能显著促进脂质循环,降低主动脉斑块比例,并调节改善与高脂肪/胆固醇诱导的动脉粥样硬化相关的负面影响[11]。有报道显示,燕麦β-葡聚糖在降低低密度脂蛋白胆固醇和改善其他心血管疾病风险方面有显著效果[12]。同时,β-葡聚糖能调节餐后血糖和胰岛素水平,可用于预防糖尿病[13]。此外,燕麦β-葡聚糖也具有良好的抗癌作用、抗炎作用、降低胆固醇水平、调节脂质代谢、减肥和治疗肥胖症、降血压、改善人体肠道健康、治疗慢性肾病、益生元作用、抗氧化和抗菌活性等生理活性。
2 提取工艺
由于燕麦β-葡聚糖良好的品质特性,围绕燕麦β-葡聚糖提取分离纯化方面开展了较多的工作。随着技术的进步,燕麦β-葡聚糖的前处理、提取及纯化工艺也不断更新(见图1)。从对物料的处理上大致可分为两种提取方法:干法和湿法。干法提取主要包括研磨和筛分,以达到葡聚糖的分离和浓缩,但其中需要大量的分离步骤,并且产率通常较低。SIBAKOV等[14]利用超细研磨和静电分离方法得到了燕麦富集物,其中β-葡聚糖含量高达56.2%,显著高于传统研磨筛分法。因此,相比于传统的干法提取,静电分离可能是一种提高葡聚糖得率的方法。湿法提取即溶剂提取,可分为:(热)水提、碱提、酶提以及亚临界提取等,这些技术或单独使用,或组合使用,或外加辅助提取,如超声波、微波或脉冲电场等。湿法提取相比于干法,其相关影响因素较多,如溶剂的类型和浓度、温度、时间、pH、搅拌、粒度以及原料中各种成分等。
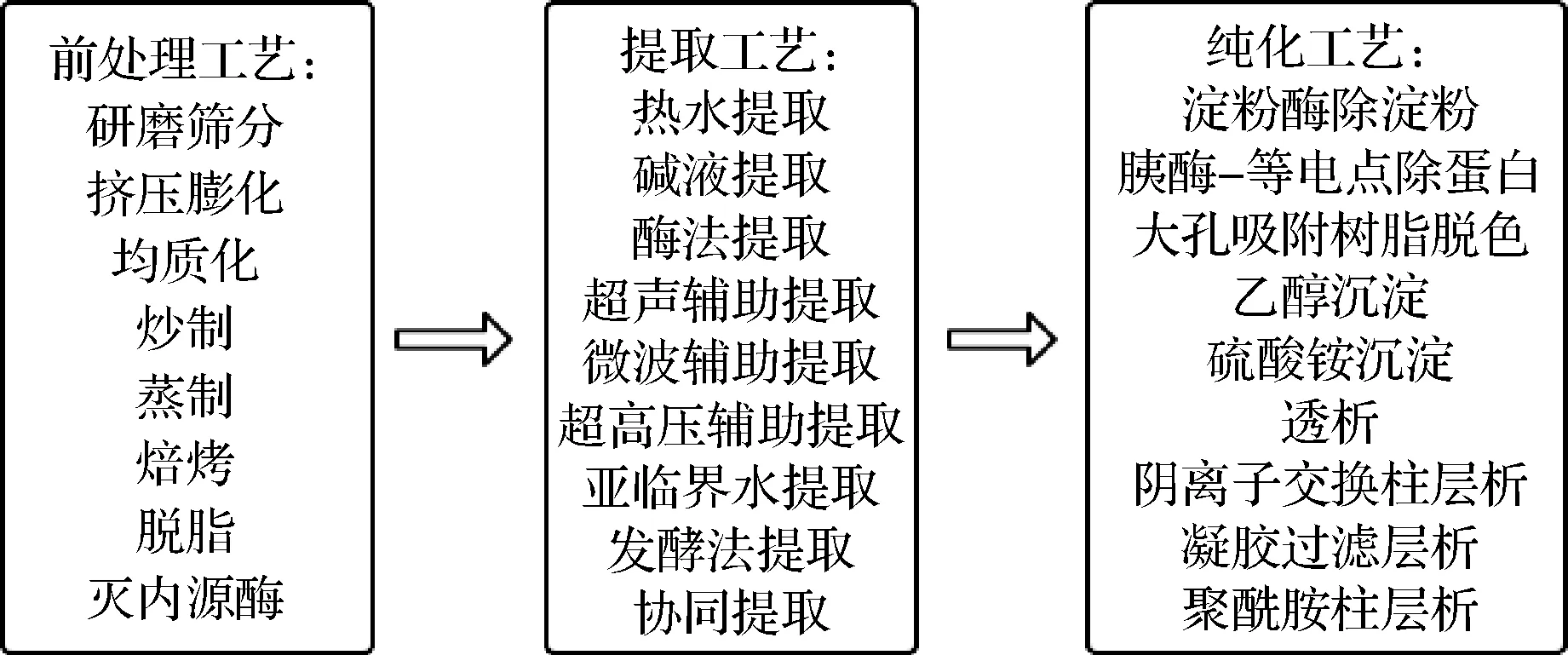
图1 燕麦β-葡聚糖的提取、纯化工艺流程Fig.1 Extraction and purification process of oat β-glucan
2.1 前处理
为了提高β-葡聚糖的提取率,通常需要对原料进行前处理。干法的研磨筛分可以作为湿法提取的前处理工艺,另外炒制、蒸制、焙烤、挤压膨化、均质化等前处理也会影响燕麦β-葡聚糖的提取率。研究显示,与未经处理的样品相比,经挤压处理后燕麦β-葡聚糖的提取率最高,其次是蒸制和焙烤[15]。湿法提取之前还需要进行脱脂、灭酶活性处理,从而进一步提高提取率和纯度,常用的脱脂溶剂有石油醚、乙醚、乙醇、异丙醇等,而在使用乙醇脱脂的过程中,控制温度80 ℃可使内源β-葡聚糖酶快速失活,同时还能够除去小分子糖、蛋白以及脂溶性物质。
2.2 水提法
燕麦β-葡聚糖不溶于醇、醚或酮等有机溶剂而易溶于水,所以可用热水提取。有研究采用热水从燕麦麸皮中提取β-葡聚糖,干燥后β-葡聚糖得率最高,为(5.3±0.3)%,而酶法、酸法和碱法提取的β-葡聚糖得率相对较低[16]。WANG等[17]采用水提法从燕麦麸皮浓缩物中提取β-葡聚糖,其中常规水提工艺的产品中含有66%的β-葡聚糖,乙醇沉淀前酸化(pH 3)处理的含有69%,植酸盐去除后的β-葡聚糖含量达到72.7%。吴佳等[18]采用热水浸提-冻融循环提取燕麦β-葡聚糖,不灭活内源酶,55 ℃提取2 h,将提取液浓缩至β-葡聚糖质量分数为1%,冻融3次,β-葡聚糖的得率为1.5%,纯度92%。
可以看出,水提法虽然提取条件较温和,但提取时间长导致时间成本增加,提取溶剂用量大且需要回收导致能耗高,最重要的是单纯水提产品的纯度和得率都较低,所以往往只作为基础提取方式。
2.3 碱提法
一些酸性或高分子量的β-葡聚糖不易溶于热水而易溶于稀碱溶液,因此,可用一定浓度的NaOH溶液或Na2CO3溶液进行提取。CHAIYASUT等[19]采用1.0 mol/L NaOH溶液提取燕麦样品中总葡聚糖,所得到的提取物中总葡聚糖含量为(89±4)%,其中β-葡聚糖为(84±4)%。RIMSTEN等[20]分别用碳酸盐(60 ℃)、0.05 mol/L NaOH(室温)以及含耐热α-淀粉酶的热水(100 ℃)提取燕麦和燕麦麸皮中的β-葡聚糖,其中两种碱法β-葡聚糖的提取率为86%~98%,而热水提取的分别为36%和28%。一项研究采用稀碱溶液提取,在提取液pH 10.9、时间1.9 h、料液比1∶21(g∶mL)、温度85 ℃的最佳提取条件下,β-葡聚糖的得率为4.36%[21]。
碱提法近年来研究相对较少,虽然提取得率相对较高,但同时会伴随分子的部分解聚,造成β-葡聚糖分子量降低,而且碱提会造成提取液中蛋白质和淀粉污染加重,颜色加深,不利于后续的纯化和脱色。
2.4 酶提法
酶提法是利用酶的特异性使提取液中杂质分解去除。据报道,酶法、碱法和酸法3种提取方法的燕麦胶得率在3.74%~5.14%,其中酶法得率最高(5.14%);β-葡聚糖的提取率在82.1%~86.8%,酶法最高(86.8%),碱法最低,可能是酶对淀粉和蛋白质的脱除率较高[22]。类似研究发现,酶提的β-葡聚糖分子量大、得率高、胶体稳定性好,且其中蛋白质含量最少,β-葡聚糖得率为13.9%,而酸性和碱性提取的得率分别为6.97%和5%[23]。NEHA等[24]采用碱法、酸法、热水法和酶法分离β-葡聚糖,其中提取率最高的是使用耐热α-淀粉酶和蛋白酶的酶法(86.7%),且具有最高的抗氧化和抑菌活性。
酶提相比于化学试剂法提取较为安全,对环境无污染,最终产品纯度较高,而且可以替代部分化学反应,使提取效率更高。而酶的使用常存在于其他提取工艺中,以进一步提高得率和纯度,所以将生物酶用于燕麦β-葡聚糖的提取有良好的应用前景。
2.5 超声波辅助提取法
超声波辅助提取法是利用其空化效应使得提取液局部高温、高压,另外附加超声波的机械扰动作用,减小固液两相间的传质阻力,从而缩短提取时间,提高提取率,且不会破坏β-葡聚糖活性。有研究优化了超声波联合酶法提取燕麦麸皮β-葡聚糖的工艺,在料液比1∶10(g∶mL)、水浴加热温度75 ℃、加热时间4 h、淀粉酶添加量1.5%、酶解时间30 min、超声波功率400 W、超声波温度50 ℃、超声波时间30 min条件下,β-葡聚糖的得率为5.09%[25]。苏畅等[26]研究了超声波辅助热碱水提取裸燕麦中β-葡聚糖,其最佳工艺参数为5%裸燕麦浆料、360 W超声波预处理6 min、pH 8、50 ℃水浴提取60 min,提取液中β-葡聚糖含量可达1 153 μg/mL。黄玉炎等[27]采用超声浸提、蒸发浓缩、反复冻融从燕麦麸中提取β-葡聚糖,当料液比为1∶20(g∶mL)、超声波功率500 W、提取温度55 ℃、时间50 min时,提取液蒸发浓缩至体积的4.0%,反复冻融2次,燕麦麸β-葡聚糖的得率为6.0%,纯度可达82.3%。刘少娟等[28]确定了燕麦麸皮多糖的最佳提取工艺条件为:超声波温度66 ℃,pH 9.2,超声波时间21 min,功率401 W,在此工艺参数的条件下,多糖的平均提取得率为(7.48±2.6)%。
超声波辅助提取相比传统热水浸提法的提取条件温和, 提取温度较低,用水量少,时间短, 得率高,但其处理的原料相对较少,过多原料可能造成超声波能耗过高,原料处理不充分。
2.6 微波辅助提取法
微波能够进入籽粒内部形成内热源,利用其加热的选择性,使得糊粉层、亚糊粉层胚乳细胞壁破解分裂,在缩短β-葡聚糖提取时间的同时,提高其得率。王尚玉等[29]优化了燕麦麸皮β-葡聚糖的微波辅助浸提工艺:料液比1∶15(g∶mL),微波时间4 min,功率640 W,温度80 ℃,β-葡聚糖的得率达5.1%。申瑞玲等[30]从裸燕麦麸皮中微波提取β-葡聚糖,在料液比为1∶12(g∶mL)、微波功率720 W、提取时间9 min、pH 10的条件下,β-葡聚糖的得率为8.31%。
微波辅助提取不仅大大缩短了提取时间, 减少了溶剂消耗量,而且β-葡聚糖的提取率也高于传统热水提取法。但微波的内部升温操作不易控制,易使β-葡聚糖遭到破坏,从而相对降低提取率。
2.7 亚临界水提取法
亚临界萃取是一种以亚临界水为溶剂的萃取技术,亚临界水表现出比水更低的黏度和更高的扩散系数,从而提高向样品基质的扩散速度,加快β-葡聚糖的提取[31]。YOO等[32]从燕麦粉中提取β-葡聚糖:提取温度200 ℃、溶剂pH 4.0、提取时间10 min、粒度425~850 μm,β-葡聚糖的得率为(6.98±1.17)%,提取率为88.08%,显著高于热水提取率(36.62%);中试规模的最佳工艺条件为:温度210 ℃、时间10 min,β-葡聚糖得率为(3.01±0.27)%,提取率为76.36%。DU等[33]采用加速溶剂提取技术从麸皮中提取β-葡聚糖,其最佳提取工艺参数为:提取时间9 min,提取温度70 ℃,循环4次,提取压力10 MPa,在此条件下β-葡聚糖的得率为(16.39±0.3)%。
与传统的溶剂提取相比,亚临界萃取β-葡聚糖的得率更高,提取体系和溶剂体系更环保,提取时间更短,β-葡聚糖的降解损失小,有利于工业化提取工艺的发展。
2.8 发酵法
发酵法提取燕麦β-葡聚糖是将菌液接种到燕麦培养基中,在适宜条件下发酵,然后对发酵液离心提取得到β-葡聚糖。吴迪等[34]采用3种药用真菌(黄伞、大杯伞和灰树花)经双向发酵提取燕麦β-葡聚糖,其得率均比未经发酵的高,其中黄伞真菌与燕麦在发酵温度28 ℃、料液比1∶20 (g∶mL)、pH 5、发酵时间48 h的最佳双向发酵条件下得率最高(289 μg/mL)。刘新琦等[35]优化了发酵法提取β-葡聚糖最佳工艺参数为:料液比1∶6(g∶mL),接种0.05%的高活性干酵母,32 ℃下发酵34 h,得率为(5.21±0.02)%,与传统水提法相比不仅得率提高了60.8%,而且含有更少量的蛋白质,再通过活性炭吸附可以清除97.81%,β-葡聚糖纯度高达91.21%,平均分子质量为1.366×105Da。顾飞燕[36]报道了活性干酵母发酵提取β-葡聚糖的最佳发酵条件为:料液比1∶6(g∶mL)、接种量0.05%、发酵时间34 h、温度32 ℃,β-葡聚糖的得率为5.21%,收得率和纯度为94.96%和91.20%。
发酵法相比于传统水提法,β-葡聚糖的提取率和纯度较高,且相对经济,但优势发酵菌种的筛选以及从所得到的混合β-葡聚糖中分离纯化出燕麦β-葡聚糖都增加了提取的工作量。
2.9 其他
除以上的提取方式外,还有一些研究相对较少的提取方式以及联合工艺技术。KUREK等[37]采用天然絮凝剂(壳聚糖、瓜尔豆胶和明胶)从燕麦中提取纯化β-葡聚糖,絮凝剂的使用相对减少了提取物总量,但能有效去除其中的蛋白质和灰分等杂质,提高提取物的纯度,当壳聚糖浓度为0.6%时,提取物中β-葡聚糖含量最高,为(79.0±0.19)%。游茂兰等[38]采用超声波-微波协同法提取β-葡聚糖,最佳工艺参数如下:超声波功率250 W、超声波时间20 min、微波功率800 W、微波时间3 min、料液比1∶25(g∶mL),β-葡聚糖得率为2.29%,分别比水提、超声波和微波法提高了120.19%、57.93%和18.65%。王冲等[39]采用超高压-超声波协同法提高了β-葡聚糖得率,在超声波功率300 W、超声波时间15 min、超高压压力300 MPa、超高压时间4 min、水提pH 10、料液比1∶18(g∶mL)的条件下,葡聚糖得率为1.66%,分别比水提法、超声法法和超高压法提高了159.38%、43.10%和23.88%。以上表明协同提取工艺不仅可以显著缩短提取时间,提高提取效率,而且能够有效提高得率及纯度。
从现有研究可知,不同的提取工艺对燕麦β-葡聚糖的提取率、得率和纯度都有很大的影响。除此之外,不同燕麦种类、品质、生长环境、以及前处理工艺也会在一定程度上影响β-葡聚糖提取率、得率及纯度。所以,要综合考虑相关影响因素,以求得率和纯度最大化。
3 纯化工艺
从燕麦中提取得到的β-葡聚糖往往还含有淀粉、蛋白质、杂多糖、色素以及小分子物质等成分,由于纯度不够,而达不到实际生产及使用的要求,所以一般都需要将其中的杂质去除以提高纯度。
3.1 淀粉和蛋白质的去除
现有燕麦β-葡聚糖的提取工艺(水提法、碱提法、亚临界提取法)大多在较高温度下进行,导致其中淀粉糊化,并与β-葡聚糖一起被提取出来,从而影响葡聚糖的纯度。实际生产中一般用α-淀粉酶将淀粉水解为小分子糊精,再利用糖化酶水解为小分子葡萄糖,经过透析而除去。PAPAGEORGIOU等[40]利用耐热α-淀粉酶进行处理(90 ℃、3 h、pH 4.5),最终产品中几乎检测不到淀粉。
在β-葡聚糖粗提液中,蛋白质是除淀粉外的又一大类杂质。而相比于淀粉的脱除,蛋白质的去除方法较多,如Sevag法、三氟三氯乙烷法、三氯乙酸法、酶法、等电点法、酶-Sevag 法、酶-等电点法等。罗燕平等[41]比较了β-葡聚糖粗品的3种除蛋白方法(三氯乙酸法、Sevag法及木瓜蛋白酶法),发现木瓜蛋白酶法效果最佳,其蛋白质去除率可达88.6%,β-葡聚糖保留率可达91.3%。
HARASYM等[42]采用碱提法得到的高、低分子质量β-葡聚糖组分的含量分别为76.7%和87.1%,经胰酶、耐热α-淀粉酶和等电点沉淀(pH 4.5)除去蛋白质和淀粉杂质,两组分均可最高纯化达97%;若经胰酶、耐热α-淀粉酶、淀粉糖苷酶和木瓜蛋白酶连续除杂,可使β-葡聚糖含量分别提高到97.5%和99.25%。王振强等[43]采用耐热α-淀粉酶(6 U、40 min)去除提取液中的淀粉,等电点沉淀法(pH 4.5)除蛋白质,最终产品中糖含量为60.518%,残留的蛋白质含量为3.584%。
淀粉和蛋白质是燕麦β-葡聚糖粗提液中最主要的杂质。其中淀粉酶脱淀粉、胰酶-等电点法脱蛋白是国内外研究中经常使用的初级纯化方式,相比于其他方法,该法的脱除率和葡聚糖保留率也最高。
3.2 色素及小分子物质的去除
提取液中色素会影响产品的质量,所以需进行脱色处理。去除色素常采用活性炭吸附,同时可以去除蛋白质,不仅脱色效果好而且操作简单。此外,还可以用硅藻土、纤维素、H2O2、大孔吸附树脂、大孔吸附树脂-活性炭、离子交换柱(DEAE-纤维素)等。其中相比于活性炭脱色, 大孔吸附树脂脱色的β-葡聚糖保留率较高。贾莹等[44]优化了D-201树脂对葡聚糖的最佳脱色工艺为:样品溶液温度40 ℃,pH 5,流速0.5 mL/min,该条件下脱色率为67.8%,β-葡聚糖损失率约25%;XAD-7树脂的最佳脱色工艺为:样品溶液温度40 ℃,pH 6,流速0.5 mL/min,脱色率可达72.9%,β-葡聚糖损失率为4.3%。综合脱色效果和β-葡聚糖保留率两方面考虑, 大孔吸附树脂脱色最佳。
提取液中的小分子物质以及杂多糖等可以通过沉淀和膜分离技术去除。其中有机溶剂如乙醇、丙酮、异丙酮及硫酸铵等沉淀剂较为常用。RYU等[5]用Na2CO3溶液(pH 10.0)在45 ℃条件下提取燕麦β-葡聚糖,粗提液再使用300 g/L的(NH4)2SO4和50% (体积分数)的异丙醇纯化,β-葡聚糖得率为1.9%,纯度为78.8%。有报道在略低于淀粉糊化温度的条件下水提,再将淀粉酶解,调节pH至4.0~4.5除蛋白质,最后用80%(体积分数)乙醇沉淀,得到的燕麦β-葡聚糖纯度为90.4%~93.7%,分子质量为(0.44~1.10)×105Da[40]。整体考虑,相对于其他几种沉淀剂,乙醇沉淀的纯化效果最好,它不仅可以有效富集葡聚糖分子,同时还具有脱蛋白、脱脂、脱色的能力。
刘焕云等[45]将裸燕麦麸经水提、耐热α-淀粉酶去淀粉、等电点沉淀蛋白,醇析后粗品β-葡聚糖的得率为6.25%, 纯度为75.56%;再采用硫酸铵分级纯化去除其中残存的杂多糖,最终产品纯度可达90.66%。董兴叶[46]在分析水提和超声波提取对燕麦β-葡聚糖得率影响的实验中确定了最佳提取方法是超声波法,平均得率为(4.09±0.04)%;纯化工艺为淀粉酶除淀粉、胰蛋白酶-等电点法除蛋白、AB-8型树脂脱色素、60%乙醇沉淀β-葡聚糖,最终总糖量为95.25%,其中β-葡聚糖91.10%,并提出用层析法进一步纯化。
经过初级纯化工艺,燕麦β-葡聚糖提取液的纯度已经达到了较高的水平。若想得到完全纯化和单一组分的葡聚糖制剂,往往还需要层析等方法。
3.3 分级纯化
为获得高纯度、单一组分的β-葡聚糖,还需对经过初级纯化获得的β-葡聚糖提取物进行逐步分级纯化,多采用层析法。
袁建等[47]用硫酸铵沉淀、DEAE Sepharose CL-6B阴离子交换柱层析、Sepharose CL-4B凝胶过滤层析对β-葡聚糖进行分级纯化,得到两单一组分(无核酸、色素、蛋白),分子质量分别为4.87×105Da(纯度为98.57%)、6.13×104Da(纯度为97.03%)。谢昊宇等[48]采用碱提醇沉法提取β-葡聚糖,粗提物经硫酸铵沉淀、阴离子交换和凝胶层析等逐步纯化,产物的总糖含量和β-葡聚糖含量分别为96.88%和94.91%。汪海波等[49]将粗多糖经等电点脱蛋白、活性炭柱脱色、α-淀粉酶除淀粉、乙醇沉淀后得到燕麦β-葡聚糖的半纯品(得率约为1.8%),再用聚酰胺柱层析和乙醇多次沉淀的方法分离纯化,最终获得单一组分的β-葡聚糖纯品。
经过分级纯化后的燕麦β-葡聚糖,达到了单一组分的葡聚糖制剂的要求,能够满足食品以及医药制剂的高纯度标准。但纯化过程中层析柱或滤膜的消耗也成为了大规模工业化生产的阻碍。
4 结论与展望
随着对燕麦β-葡聚糖特性和生理活性研究的深入,其越来越多地被应用于食品、化妆品和医药等领域。而如何满足食品特别是医药领域对β-葡聚糖高纯度的要求,则成为了必须解决的难题。虽然已有较多关于β-葡聚糖提取纯化方面的报道,但在以下几个方面还需要进一步研究:⑴提取纯化工艺大多停留在实验室规模,缺乏工业化生产工艺,建议围绕现有工艺的放大开展系列研究;⑵现有研究表明适当的预处理可有效提高其提取率,建议对其预处理工艺进行优化研究;⑶已有一些辅助或联合工艺以及新兴技术,但还处于起步阶段,建议可以重点开发其联合工艺和新兴技术手段(如微波、超声波、脉冲电场等辅助手段,亚临界、超临界等新兴手段)。此外,在优化原有工艺时,应尽可能考虑所有影响因素,以得到最佳工艺参数;由于在分离纯化过程中应用到较多酶解手段,所以可以考虑固定酶技术,以延长酶的使用寿命,减少酶的消耗和酶与产品的分离工艺,实现资源消耗最小化。实现工业化高得率、高纯度的大规模生产,对于提升燕麦及其副产品(燕麦麸皮、燕麦米渣)精深加工水平和功能性食品医药研发等具有重要意义。
